
Original Article - Year 2017 - Volume 32 -
Reconstrução de calota craniana com prótese customizada de PMMA após craniectomias descompressivas
Skull reconstruction with PMMA customized prostheses after decompressive craniectomies
RESUMO
INTRODUÇÃO: A craniectomia descompressiva é uma cirurgia indicada no tratamento da hipertensão intracraniana em situações graves de traumas cranioencefálicos. Esta cirurgia confere uma aparência bizarra ao paciente, como se "parte da cabeça" houvesse sido retirada. Após a regressão do edema cerebral e quando o paciente reunir boas condições clínicas, a reconstrução craniana está indicada. A reconstrução da calota craniana poderá ser realizada com osso autólogo ou com materiais aloplásticos. Este estudo objetiva apresentar a experiência do autor com reconstruções de calota craniana utilizando próteses customizadas de PMMA.
MÉTODOS: Foram selecionados 14 pacientes submetidos à craniectomia descompressiva que, após serem liberados clinicamente pela Neurocirurgia, realizaram a reconstrução da calota craniana com próteses de PMMA customizadas por prototipagem entre os anos de 2014 e 2015 e com, no mínimo, 6 meses de pós-operatório. Sinais e sintomas de síndrome do Trefinado, tomografia computadorizada e aparência estética dos pacientes foram analisadas no pré e no 6º mês pós-operatório.
RESULTADOS: Todos os pacientes apresentaram melhora sintomatológica, melhora estética e expansão cerebral após a cirurgia.
CONCLUSÃO: A reconstrução da calota craniana com prótese customizada de PMMA promoveu a melhora dos sinais e sintomas e da aparência estética de todos os 14 pacientes operados. A utilização de protótipos para customizar próteses cranianas facilitou a técnica operatória e possibilitou a recuperação de um contorno craniano muito próximo da normalidade.
Palavras-chave: PMMA; Hipertensão intracraniana; Craniectomia descompressiva; Traumatismos craniocerebrais; Próteses e implantes; Estética.
ABSTRACT
INTRODUCTION: Decompressive craniectomy is indicated for the treatment of intracranial hypertension in cases of serious traumatic brain injury. This surgery results in a bizarre appearance, as if "part of the head" had been. After regression of cerebral edema and when the patient is in good clinical condition, the reconstruction of the skull is indicated. Reconstruction of the skull can be performed with autologous bone or with alloplastic materials. This study sought to present the experience of the author with skull reconstructions using custom PMMA prostheses.
METHODS: In between 2014 and 2015, fourteen patients with previous (longer than 6 months) decompressive craniectomies were selected after Neurosurgery medical clearance and underwent skull reconstruction with customized PMMA prototyped prostheses. Signs and symptoms of syndrome of the trephined, computed tomography, and aesthetic appearance of the patients were analyzed preoperatively and at 6 months after reconstruction.
RESULTS: All patients presented with improved symptomatology, aesthetic improvement and expansion of the brain after surgery.
CONCLUSION: Reconstruction of the skull with customized prototyped PMMA prostheses improved the signs and symptoms and the aesthetic appearance in all 14 patients of this series. The use of prototypes to customize cranial prostheses facilitates the operative technique and enables patients to develop a nearly normal cranial contour.
Keywords: PMMA; Intracranial hypertension; Decompressive craniectomy; Craniocerebral injuries; Prostheses and implants; Aesthetics.
A craniectomia descompressiva é uma cirurgia indicada no tratamento da hipertensão intracraniana em situações graves de traumas cranioencefálicos1-4 que consiste na retirada em monobloco de grande parte do osso frontal, temporal, parietal e esfenoide do lado acometido, permitindo a livre expansão do edema cerebral sem as limitações da caixa craniana. Apesar de salvar vidas em muitos casos, esta cirurgia confere uma aparência bizarra ao paciente, como se "parte da cabeça" houvesse sido retirada.
Após a regressão do edema cerebral e quando o paciente reunir boas condições clínicas, a reconstrução craniana está indicada5. A cirurgia objetiva readquirir a proteção cerebral contra traumas, recuperar o contorno craniano e melhorar os sintomas neurológicos com o restabelecimento da pressão fisiológica intracraniana. A restauração da barreira anatômica entre as estruturas intracranianas e o meio ambiente normaliza a dinâmica liquórica e do fluxo sanguíneo cerebral. O conjunto de sinais e sintomas decorrentes da perda parcial da calota craniana é chamado de síndrome do Trefinado6-11.
A reconstrução da calota craniana poderá ser realizada com osso autólogo ou com materiais aloplásticos12,13. O osso autólogo tem uma resistência maior à infecção e menor probabilidade de extrusão, no entanto, pode sofrer absorção variável, é difícil de modelar e há a morbidade da área doadora5,6,14-16.
O enxerto de osso parietal é a primeira escolha sempre que for possível. No caso das reconstruções após craniectomia descompressiva, o tamanho do defeito praticamente inviabiliza esta opção por falta de área doadora. Os aloplásticos oferecem um contorno excelente, mas há um risco maior de infecção e extrusão. Os aloplásticos mais utilizados em nosso meio são o polimetil metacrilato (PMMA), a hidroxiapatita (HA) e o titânio14,17-19.
O PMMA é usado desde 1940 por Zander (apud Sanan e Haines20) para reparo dos defeitos craniofaciais e é escolha de muitos autores21-24. No Brasil, é o aloplástico mais frequentemente disponível no Sistema Único de Saúde (SUS) para a reconstrução craniana. Consiste em um kit com um componente do polímero em pó (30 g) e um componente do monômero líquido (17 ml) que, quando misturados, formam uma resina acrílica em um processo de polimerização20. Durante a polimerização, o PMMA vai endurecendo gradativamente e pode ser moldado de forma que se adapte ao defeito ósseo.
A moldagem do PMMA poderá ser realizada no pré-operatório ou no transoperatório; podendo ser modelado manualmente no defeito25,26, manualmente com ajuda de moldes27-30 ou por uma impressora 3D utilizando prototipagem. A impressão da prótese customizada por prototipagem é uma excelente alternativa neste tipo de reconstrução, visto seus benefícios na precisão do contorno craniano e na facilitação de técnica operatória, entre outras vantagens31,32. Infelizmente, o custo das próteses cranianas customizadas, seja de qual material for, dificulta sua disponibilidade para o SUS atualmente.
O Hospital da Restauração (HR), em Recife, PE, é referência regional no atendimento a traumatismos cranianos e suas sequelas. As reconstruções de calota craniana nos pacientes submetidos a craniectomias descompressivas eram realizadas no transoperatório com moldagem manual do PMMA em cima do defeito ósseo. A partir de 2014, o serviço de Cirurgia Plástica do HR passou a realizar estas reconstruções com próteses de PMMA customizadas por prototipagem.
OBJETIVO
Este estudo objetiva apresentar a experiência do autor com reconstruções de calota craniana utilizando próteses customizadas de PMMA para obtenção de título de Membro Titular da Sociedade Brasileira de Cirurgia Plástica.
MÉTODOS
Este trabalho é um estudo prospectivo de intervenção, descritivo, realizado no Hospital da Restauração (HR), em Recife, PE, pela Cirurgia Plástica em conjunto com a Neurocirurgia. Foram selecionados 14 pacientes submetidos à craniectomia descompressiva que, após serem liberados clinicamente pela Neurocirurgia, realizaram a reconstrução da calota craniana com próteses de PMMA customizadas por prototipagem entre os anos de 2014 e 2015 e com, no mínimo, 6 meses de pós-operatório. Todos os pacientes assinaram um Termo de Consentimento Livre e Esclarecido e o estudo seguiu os princípios de Helsinque.
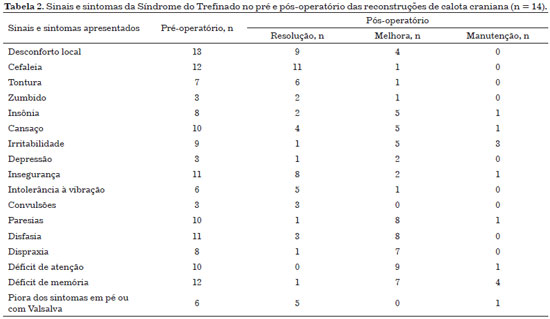
Um questionário com os sinais e sintomas da síndrome do Trefinado e avaliação de tomografia computadorizado (TC) no pré e no 6º mês pós-operatório foram realizados pelo serviço de Neurocirurgia. Os sinais e sintomas questionados foram: desconforto local, cefaleia, tontura, zumbido, insônia, cansaço, irritabilidade, depressão, insegurança, intolerância à vibração, convulsões, paresias, disfasia, dispraxia, déficit de atenção, déficit de memória e piora dos sintomas em pé ou com manobra de Valsalva. Em adição, também foram analisados dados do transoperatório, evolução pós-operatória e complicações.
No 6º mês pós-operatório os pacientes também responderam a respeito do resultado estético da cirurgia: se o contorno craniano estava satisfatório ou insatisfatório e uma avaliação em notas de 1 a 5. Os escores de 1 a 5 representavam muito ruim (1), ruim (2), bom (3), muito bom (4) e excelente (5).
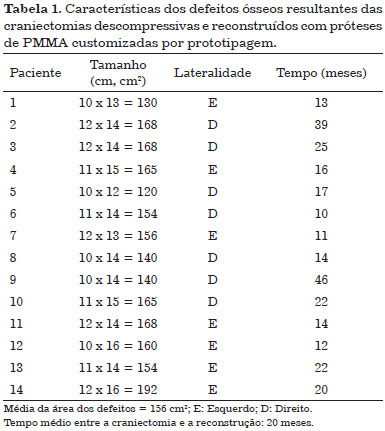
A faixa etária variou de 18 a 54 anos, a idade média foi de 31 anos, todos os pacientes eram do gênero masculino, o traumatismo craniano foi a causa de todas as craniectomias descompressivas e nenhum paciente havia sido submetido a alguma tentativa de reconstrução craniana prévia. Os defeitos ósseos resultantes das craniectomias descompressivas estão caracterizados na Tabela 1.
Os pacientes portadores dos defeitos ósseos foram submetidos a uma TC (Somatom Definition AS 64 slice, Simens®) com cortes ≤ 1 mm e os exames foram gravados como um arquivo em formato DICOM em um DVD (Figura 1). Estes DVDs são enviados ao Centro de Tecnologia da Informação Renato Archer (CTI RA) em Campinas, SP. As imagens das tomografias são trabalhadas no software InVesalius® para que os protótipos sejam desenvolvidos e, posteriormente, impressos por uma impressora 3D (SLS HiQ, 3D System®). Nos casos das reconstruções das calotas cranianas, são desenvolvidos:
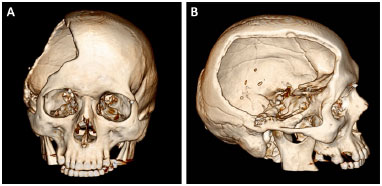
Figura 1. A e B: Tomografia computadorizada do crânio de um paciente com defeito resultante de uma craniectomia descompressiva.
• Protótipo 1: crânio defeituoso (Figura 2).
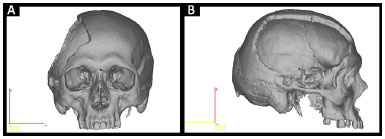
Figura 2. A e B: Planejamento do Protótipo 1 pelo InVesalius®: crânio defeituoso.
• Protótipo 2: peça que está faltando no crânio defeituoso (Figura 3).
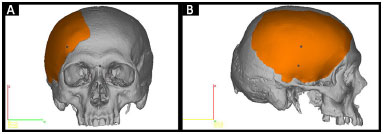
Figura 3. A e B: Planejamento do Protótipo 2 pelo InVesalius®: peça que está faltando no crânio defeituoso (em laranja).
• Protótipo 3: duas formas (duas peças) que nos possibilitam confeccionar uma cópia perfeita do Protótipo 2 (Figura 4).
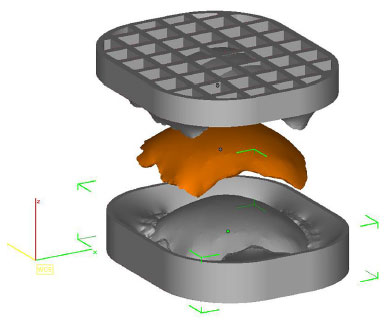
Figura 4. Planejamento das duas formas pelo InVesalius® que possibilitam confeccionar uma cópia do Protótipo 2 (em laranja).
Os protótipos são impressos pela tecnologia de Sinterização de Material Plástico Poliamida (PA12) e, por conseguinte, não são biocompatíveis e não podem ser implantados em seres humanos. Daí a importância do protótipo 3, que possibilita a fabricação da prótese craniana em material biocompatível no transoperatório. Todos os protótipos são esterilizados no autoclave a vapor em 134 ºC por 5 minutos e levados à sala de cirurgia (Figura 5).

Figura 5. A, B e C: Protótipos 1, 2 e 3 impressos e estéreis na sala de cirurgia.
Enquanto os pacientes são submetidos à anestesia geral e antissepsia com clorexidina degermante e alcoólica, confecciona-se a prótese customizada com cimento cirúrgico de PMMA (Subiton Cranioplastias® ou Codman Cranioplastic®) (Figura 6). A parte em pó do produto é misturada com a parte líquida em uma cuba até que esteja pronta para modelar em alguns minutos, quando o material não adere mais às luvas.
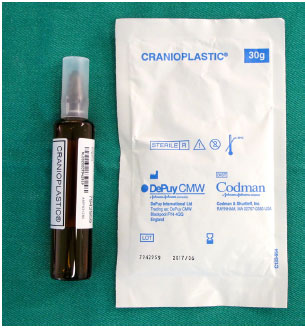
Figura 6. Cimento cirúrgico de PMMA para cranioplastia: componente em pó e componente líquido.
Neste momento, o cimento é colocado nas formas prototipadas e estas são fechadas. Depois de alguns minutos, o cimento endurece e retiramos a prótese (Figura 7). Com a prótese já confeccionada em mãos e usando o Protótipo 1, podemos checar o seu encaixe, fazer possíveis ajustes, posicionar corretamente, e dobrar e fixar as placas na prótese (Figura 8).
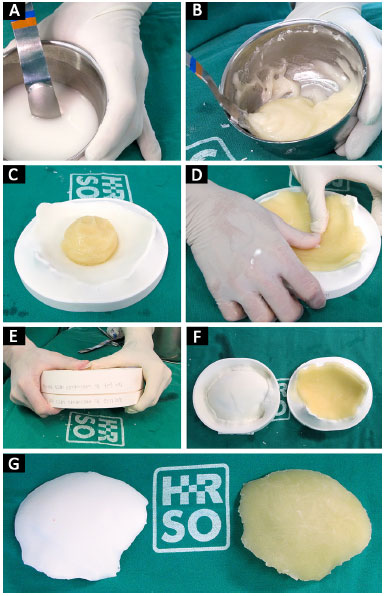
Figura 7. A, B, C, D, E, F e G: Polimerização do PMMA do estado líquido para o sólido; modelamento do PMMA na forma; fechamento das formas; prótese confeccionada.
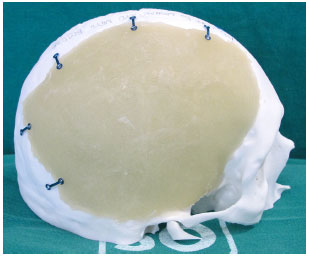
Figura 8. Prótese ajustada, posicionada e com as placas dobradas e fixadas com parafusos.
O acesso cirúrgico é feito na cicatriz prévia da craniectomia sem a ressecção das bordas cicatriciais para não haver tensão no fechamento (Figura 9). O defeito é exposto com a elevação do couro cabeludo no plano logo acima da dura-máter, deixando a cobertura o mais espessa possível. Na região temporal, o músculo temporal também é elevado da dura-máter (Figura 10).
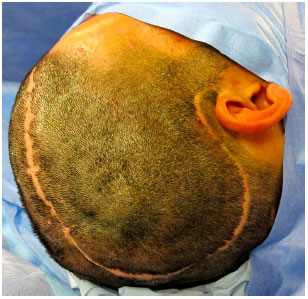
Figura 9. Acesso cirúrgico na cicatriz prévia da craniectomia sem ressecção das bordas cicatriciais.
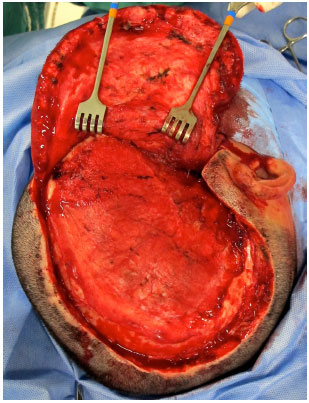
Figura 10. Defeito exposto no plano logo acima da dura-máter.
A prótese, então, é encaixada no defeito e fixada com placas e parafusos de titânio (Bioplate®, sistema 1.6 de 2 furos cada placa) (Figura 11). Um dreno de aspiração contínua tubular de silicone é posicionado e a ferida operatória é fechada no plano galeal com Capofril® 2-0 e no plano cutâneo com Mononylon® 2-0 em pontos separados. Após a cirurgia, o paciente é encaminhado para a Unidade de Suporte Avançado de Neurocirurgia (USAN), onde é feita uma tomografia de controle nas primeiras 12 horas. O dreno é retirado quando o débito é menor do que 50 ml nas últimas 12 horas e a alta hospitalar ocorre geralmente em 48 horas.
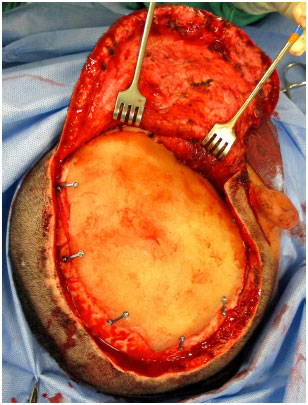
Figura 11. Prótese craniana customizada de PMMA já fixada no defeito com placas e parafusos.
RESULTADOS
Todos os pacientes apresentaram melhora sintomatológica após a reconstrução da calota craniana (Tabela 2).
Foram realizadas TC de crânio no 6º mês pós-operatório que evidenciaram expansão cerebral em todos os pacientes (Figura 12). Excepcionalmente, um dos exames foi realizado no 2º mês de pós-operatório e também evidenciou o cérebro expandido.
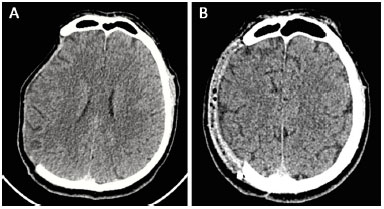
Figura 12. A e B: Tomografia computadorizada realizada no pré-operatório e no 6º mês pós-operatório evidenciando expansão cerebral após a reconstrução da calota craniana com prótese.
Todas as 14 reconstruções tiveram um resultado estético satisfatório. Onze pacientes acharam o resultado excelente e três pacientes acharam o resultado muito bom. Nenhum paciente classificou o resultado estético como muito ruim, ruim ou bom (Figuras 13 e 14).
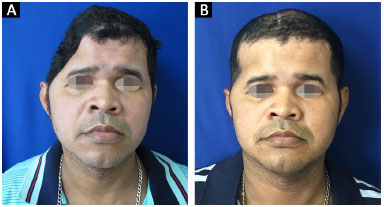
Figura 13. A e B: Paciente 10 no pré e 6º mês pós-operatório.
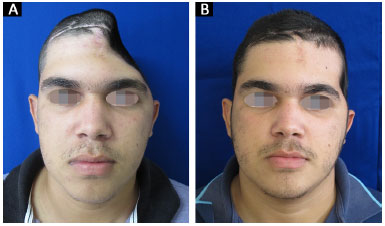
Figura 14. A e B: Paciente 14 no pré e 6º mês pós-operatório.
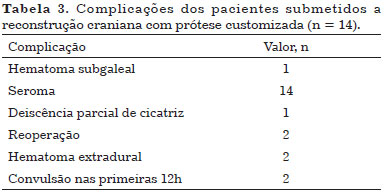
Todos os pacientes apresentaram seroma no pós-operatório e foram tratados com punções periódicas (duas vezes por semana) e curativos compressivos. Não houve nenhum caso de infecção.
Dois pacientes apresentaram hematoma extradural: um hematoma extradural assintomático no 4º dia pós-operatório (DPO) e outro sintomático no 10º DPO após a punção de um seroma. Ambos foram reoperados e as próteses foram recolocadas.
Dois pacientes apresentaram crise convulsiva nas primeiras 12 horas de pós-operatório, foram tratados com anticonvulsivante venoso e TC realizadas logo após as crises convulsivas não evidenciaram qualquer anormalidade. Não houve sequela neurológica em nenhum dos pacientes (Tabela 3).
DISCUSSÃO
O uso de próteses customizadas por prototipagem na reconstrução craniana tem como principais vantagens a facilitação de técnica operatória31,32 e o excelente contorno craniano adquirido. A partir de 2014, com a ajuda do CTI RA, que é uma unidade do Ministério da Ciência, Tecnologia e Inovação desde 1982 e faz prototipagens para pacientes do SUS sem custos, o setor de Cirurgia Plástica do HR passou a realizar um método alternativo de customização transoperatória com prototipagem.
O gasto da prótese customizada se resume a duas unidades de cimento para cranioplastia. Conseguir a realização desta cirurgia a custo acessível faz com que o paciente do SUS tenha acesso a uma tecnologia de 1º mundo.
Os sinais e sintomas neurológicos dos pacientes portadores de defeitos pós-craniectomia descompressiva podem ser secundários ao dano cerebral traumático ou à ausência do osso por si só. A falta do osso está relacionada a mudanças na circulação dos fluidos cérebro-espinhais33, ao efeito da pressão atmosférica comprimindo o córtex e à redução do retorno venoso causado pela obliteração do espaço sub-aracnoide34. Todos os pacientes apresentaram melhora dos sintomas no pós-operatório após a reconstrução. Em 1945, Gardner34 já atestava a melhora da função neurológica após cranioplastia, o que foi confirmado por muitos outros autores posteriormente35-43.
A síndrome do Trefinado também é chamada de "Sinking Skin Flap Syndrome"6-10 justamente pela depressão observada no couro cabeludo do lado acometido. Muitas vezes, após a colocação da prótese craniana, observa-se um espaço morto residual entre a dura-máter e a face interna da prótese na tomografia do pós-operatório imediato que pode ir de milímetros a centímetros.
Este espaço morto, teoricamente, pode ser um fator facilitador de um processo infeccioso que, no mínimo, exigirá a retirada imediata da prótese. Felizmente, os resultados constataram que o cérebro se expande e ocupa este espaço morto em todos os casos. Na TC de controle feita 6 meses após a cirurgia, o cérebro havia se expandido em todos os pacientes.
É uma cirurgia com ganhos funcionais na qual o fator estético tem um impacto significativo na ressocialização dos pacientes. Apesar dos pacientes terem considerado o novo contorno craniano excelente e muito bom, quase sempre há uma assimetria variável na região temporal.
Esta assimetria é de partes moles, visto que a prótese consegue uma simetria óssea excelente, e acreditamos que isto aconteça por dois motivos: a falta de reposicionamento do músculo temporal ao final da cirurgia de descompressão craniana e a atrofia deste mesmo músculo pelo tempo que ficou desinserido da fossa temporal. Então, o músculo temporal tende a ficar menos volumoso e a "retrair" caudalmente, criando um abaulamento acima do arco zigomático em alguns casos.
Em 2014, Reddy et al.44 publicaram uma grande série de cranioplastias (n = 195) na qual relataram infecção em 15,9% dos casos, seroma em 2,5%, deiscência em 4,6%, reoperação em 23% e extrusão do material em 11,8%. Comparando com este estudo (n = 14) no qual encontra-se 0% de infecção, 100% de seroma, 7% de deiscência, 14% de reoperação e 0% de extrusão do material, destacam-se a presença de seroma e ausência de infecção em todos os pacientes.
O grande descolamento tecidual e a presença de um espaço morto residual são fatores contributivos para a formação do seroma. Optamos por um tratamento com punções duas vezes por semana e curativo compressivo até a resolução, sendo que três pacientes cursaram com seroma até o 2º mês de pós-operatório. Apesar de não haver nenhum caso de infecção, tivemos um caso de deiscência por um ponto de drenagem espontânea de um seroma. Esta deiscência resolveu-se apenas com curativos e punção do seroma. A aplicação de pontos de adesão entre o retalho do couro e a prótese talvez seja um artifício técnico que diminua estes altos índices de seroma.
Mesmo com a prótese customizada adaptando-se perfeitamente ao defeito ósseo, dificilmente haverá uma separação completa entre o espaço extradural (dura-máter - prótese) e o espaço subgaleal (prótese - retalho de couro cabeludo). Isso quer dizer que na presença de uma coleção subgaleal possivelmente haverá também uma coleção extradural sempre.
Isso foi o que aconteceu com um paciente cujo hematoma subgaleal não conseguiu ser evacuado pelo dreno e nem por punção com agulha calibrosa e a TC constatou um hematoma extradural assintomático com desvio de linha média. Este paciente fazia uso de um anticonvulsivante a base de ácido valproico que, posteriormente, descobrimos alterar a coagulação.
O outro caso aconteceu após punção de seroma em que houve lesão inadvertida de um vaso na região temporal e, da mesma forma, um hematoma subgaleal transformou-se um hematoma extradural sintomático de rápida evolução. Ambos os hematomas foram drenados cirurgicamente, as próteses foram recolocadas e não houve qualquer sequela neurológica.
CONCLUSÃO
A reconstrução craniana com prótese customizada de PMMA promoveu a melhora dos sintomas e da aparência estética de todos os 14 pacientes operados. A utilização de protótipos para customizar próteses cranianas facilitou a técnica operatória e possibilitou a recuperação de um contorno craniano muito próximo da normalidade.
COLABORAÇÕES
JPBRM Análise e/ou interpretação dos dados; aprovação final do manuscrito; concepção e desenho do estudo; realização das operações e/ou experimentos; redação do manuscrito ou revisão crítica de seu conteúdo.
ACC Aprovação final do manuscrito; redação do manuscrito ou revisão crítica de seu conteúdo.
REFERÊNCIAS
1. Aarabi B, Hesdorffer DC, Ahn ES, Aresco C, Scalea TM, Eisenberg HM. Outcome following decompressive craniectomy for malignant swelling due to severe head injury. J Neurosurg. 2006;104(4):469-79. PMID: 16619648 DOI: http://dx.doi.org/10.3171/jns.2006.104.4.469
2. Guerra WK, Gaab MR, Dietz H, Mueller JU, Piek J, Fritsch MJ. Surgical decompression for traumatic brain swelling: indications and results. J Neurosurg. 1999;90(2):187-96. PMID: 9950487 DOI: http://dx.doi.org/10.3171/jns.1999.90.2.0187
3. Honeybul S, Ho KM, Lind CR, Corcoran T, Gillett GR. The retrospective application of a prediction model to patients who have had a decompressive craniectomy for trauma. J Neurotrauma. 2009;26(12):2179-83. DOI: http://dx.doi.org/10.1089/neu.2009.0989
4. Polin RS, Shaffrey ME, Bogaev CA, Tisdale N, Germanson T, Bocchicchio B, et al. Decompressive bifrontal craniectomy in the treatment of severe refractory posttraumatic cerebral edema. Neurosurgery. 1997;41(1):84-92. DOI: http://dx.doi.org/10.1097/00006123-199707000-00018
5. Honeybul S, Ho KM. How "successful" is calvarial reconstruction using frozen autologous bone? Plast Reconstr Surg. 2012;130(5):1110-7. PMID: 23096611
6. Baumeister S, Peek A, Friedman A, Levin LS, Marcus JR. Management of postneurosurgical bone flap loss caused by infection. Plast Reconstr Surg. 2008;122(6):195e-208e. PMID: 19050490 DOI: http://dx.doi.org/10.1097/PRS.0b013e3181858eee
7. Dujovny M, Aviles A, Agner C, Fernandez P, Charbel FT. Cranioplasty: cosmetic or therapeutic? Surg Neurol. 1997;47(3):238-41. PMID: 9068693
8. Dujovny M, Agner C, Aviles A. Syndrome of the trephined: theory and facts. Crit Rev Neurosurg. 1999;9(5):271-8. DOI: http://dx.doi.org/10.1007/s003290050143
9. Grant FC, Norcross NC. Repair of cranial defects by cranioplasty. Ann Surg. 1939;110(4):488-512. PMID: 17857467 DOI: http://dx.doi.org/10.1097/00000658-193910000-00002
10. Yamaura A, Makino H. Neurological deficits in the presence of the sinking skin flap following decompressive craniectomy. Neurol Med Chir (Tokyo). 1977;17(1 Pt 1):43-53. DOI: http://dx.doi.org/10.2176/nmc.17pt1.43
11. Honeybul S. Decompressive craniectomy: a new complication. J Clin Neurosci. 2009;16(5):727-9. DOI: http://dx.doi.org/10.1016/j.jocn.2008.06.015
12. Aydin S, Kucukyuruk B, Abuzayed B, Aydin S, Sanus GZ. Cranioplasty: Review of materials and techniques. J Neurosci Rural Pract. 2011;2(2):162-7. DOI: http://dx.doi.org/10.4103/0976-3147.83584
13. Manson PN, Crawley WA, Hoopes JE. Frontal cranioplasty: risk factors and choice of cranial vault reconstructive material. Plast Reconstr Surg. 1986;77(6):888-904. PMID: 3520618 DOI: http://dx.doi.org/10.1097/00006534-198606000-00003
14. Yadla S, Campbell PG, Chitale R, Maltenfort MG, Jabbour P, Sharan AD. Effect of early surgery, material, and method of flap preservation on cranioplasty infections: a systematic review. Neurosurgery. 2011;68(4):1124-9. DOI: http://dx.doi.org/10.1227/NEU.0b013e31820a5470
15. Cheng YK, Weng HH, Yang JT, Lee MH, Wang TC, Chang CN. Factors affecting graft infection after cranioplasty. J Clin Neurosci. 2008;15(10):1115-9. DOI: http://dx.doi.org/10.1016/j.jocn.2007.09.022
16. Gao LL, Rogers GF, Clune JE, Proctor MR, Meara JG, Mulliken JB, et al. Autologous cranial particulate bone grafting reduces the frequency of osseous defects after cranial expansion. J Craniofac Surg. 2010;21(2):318-22. DOI: http://dx.doi.org/10.1097/SCS.0b013e3181cf5f8b
17. Sahoo N, Roy ID, Desai AP, Gupta V. Comparative evaluation of autogenous calvarial bone graft and alloplastic materials for secondary reconstruction of cranial defects. J Craniofac Surg. 2010;21(1):79-82. DOI: http://dx.doi.org/10.1097/SCS.0b013e3181c3ba58
18. Gosain AK; Plastic Surgery Eductional Foundation DATA Committee. Biomaterials for reconstruction of the cranial vault. Plast Reconstr Surg. 2005;116(2):663-6. PMID: 16079708 DOI: http://dx.doi.org/10.1097/01.prs.0000176289.05374.5b
19. Zins JE, Langevin CJ, Nasir S. Controversies in skull reconstruction. J Craniofac Surg. 2010;21(6):1755-60. DOI: http://dx.doi.org/10.1097/SCS.0b013e3181c34675
20. Sanan A, Haines SJ. Repairing holes in the head: a history of cranioplasty. Neurosurgery. 1997;40(3):588-603. PMID: 9055300
21. Matsuno A, Tanaka H, Iwamuro H, Takanashi S, Miyawaki S, Nakashima M, et al. Analyses of the factors influencing bone graft infection after delayed cranioplasty. Acta Neurochir (Wien). 2006;148(5):535-40. DOI: http://dx.doi.org/10.1007/s00701-006-0740-6
22. Blum KS, Schneider SJ, Rosenthal AD. Methyl methacrylate cranioplasty in children: long-term results. Pediatr Neurosurg. 1997;26(1):33-5. DOI: http://dx.doi.org/10.1159/000121158
23. Marchac D, Greensmith A. Long-term experience with methylmethacrylate cranioplasty in craniofacial surgery. J Plast Reconstr Aesthet Surg. 2008;61(7):744-52. DOI: http://dx.doi.org/10.1016/j.bjps.2007.10.055
24. Moreira-Gonzalez A, Jackson IT, Miyawaki T, Barakat K, DiNick V. Clinical outcome in cranioplasty: critical review in long-term follow-up. J Craniofac Surg. 2003;14(2):144-53. DOI: http://dx.doi.org/10.1097/00001665-200303000-00003
25. Kanashiro E, Goldenberg DC, Lima DSC, Alonso N, Ferreira MC. Protocol of using methylethacrylate in craniofacial reconstructive surgery. Rev Soc Bras Craniomaxilofac. 2007;10(1):11-8.
26. Bot GM, Ismail NJ, Usman B, Shilong DJ, Obande JO, Aliu S, et al. Using the head as a mould for cranioplasty with methylmethacrylate. J Neurosci Rural Pract. 2013;4(4):471-4. DOI: http://dx.doi.org/10.4103/0976-3147.120207
27. Cerqueira A, Pereira Júnior FB, Azevêdo MS, Ferreira TG. Reconstruction of frontal vault with polimethylmethacrylate implant: a report of two cases. Rev Cir Traumatol Buco-Maxilo-Fac. 2011;11(3):61-8.
28. Caro-Osorio E, De la Garza-Ramos R, Martínez-Sánchez SR, Olazarán-Salinas F. Cranioplasty with polymethylmethacrylate prostheses fabricated by hand using original bone flaps: Technical note and surgical outcomes. Surg Neurol Int. 2013;4:136. DOI: http://dx.doi.org/10.4103/2152-7806.119535
29. Sharavanan GM, Jayabalan S, Rajasukumaran K, Veerasekar G, Sathya G. Cranioplasty using presurgically fabricated presterilised polymethyl methacrylate plate by a simple, cost-effective technique on patients with and without original bone flap: study on 29 patients. J Maxillofac Oral Surg. 2015;14(2):378-85. DOI: http://dx.doi.org/10.1007/s12663-014-0670-4
30. Fernandes da Silva AL, Borba AM, Simão NR, Pedro FL, Borges AH, Miloro M. Customized polymethyl methacrylate implants for the reconstruction of craniofacial osseous defects. Case Rep Surg. 2014;2014:358569. DOI: http://dx.doi.org/10.1155/2014/358569
31. de Farias TP, Dias FL, Galvão MS, Boasquevisque E, Pastl AC, Albuquerque Sousa B. Use of prototyping in preoperative planning for patients with head and neck tumors. Head Neck. 2014;36(12):1773-82. DOI: http://dx.doi.org/10.1002/hed.23540
32. Gerstle TL, Ibrahim AM, Kim PS, Lee BT, Lin SJ. A plastic surgery application in evolution: three-dimensional printing. Plast Reconstr Surg. 2014;133(2):446-51. PMID: 24469175 DOI: http://dx.doi.org/10.1097/01.prs.0000436844.92623.d3
33. Dujovny M, Fernandez P, Alperin N, Betz W, Misra M, Mafee M. Post-cranioplasty cerebrospinal fluid hydrodynamic changes: magnetic resonance imaging quantitative analysis. Neurol Res. 1997;19(3):311-6. DOI: http://dx.doi.org/10.1080/01616412.1997.11740818
34. Richaud J, Boetto S, Guell A, Lazorthes Y. Effects of cranioplasty on neurological function and cerebral blood flow. Neurochirurgie. 1985;31(3):183-8.
35. Gardner WJ. Closure of defects of the skull with tantalum. Surg Gynecol Obstet. 1945;80:303-12.
36. Grantham EC, Landis HP. Cranioplasty and the posttraumatic syndrome. J Neurosurg. 1948;5(1):19-22. DOI: http://dx.doi.org/10.3171/jns.1948.5.1.0019
37. Agner C, Dujovny M, Gaviria M. Neurocognitive assessment before and after cranioplasty. Acta Neurochir (Wien). 2002;144(10):1033-40. DOI: http://dx.doi.org/10.1007/s00701-002-0996-4
38. Harner SG, Beatty CW, Ebersold MJ. Impact of cranioplasty on headache after acoustic neuroma removal. Neurosurgery. 1995;36(6):1097-9. DOI: http://dx.doi.org/10.1227/00006123-199506000-00005
39. Isago T, Nozaki M, Kikuchi Y, Honda T, Nakazawa H. Sinking skin flap syndrome: a case of improved cerebral blood flow after cranioplasty. Ann Plast Surg. 2004;53(3):288-92. DOI: http://dx.doi.org/10.1097/01.sap.0000106433.89983.72
40. Schiffer J, Gur R, Nisim U, Pollak L. Symptomatic patients after craniectomy. Surg Neurol. 1997;47(3):231-7. PMID: 9068692 DOI: http://dx.doi.org/10.1016/S0090-3019(96)00376-X
41. Segal DH, Oppenheim JS, Murovic JA. Neurological recovery after cranioplasty. Neurosurgery. 1994;34(4):729-31. DOI: http://dx.doi.org/10.1227/00006123-199404000-00024
42. Tabaddor K, LaMorgese J. Complication of a large cranial defect. Case report. J Neurosurg. 1976;44(4):506-8. PMID: 1255240 DOI: http://dx.doi.org/10.3171/jns.1976.44.4.0506
43. Yamaura A, Sato M, Meguro K, Nakamura T, Uemura K. Cranioplasty following decompressive craniectomy--analysis of 300 cases (author's transl). No Shinkei Geka. 1977;5(4):345-53.
44. Reddy S, Khalifian S, Flores JM, Bellamy J, Manson PN, Rodriguez ED, et al. Clinical outcomes in cranioplasty: risk factors and choice of reconstructive material. Plast Reconstr Surg. 2014;133(4):864-73. PMID: 24675189 DOI: http://dx.doi.org/10.1097/PRS.0000000000000013
1. Sociedade Brasileira de Cirurgia Plástica, Recife, PE, Brasil
2. Associação Brasileira de Cirurgia Crânio-Maxilo-Facial, São Paulo, SP, Brasil
3. Hospital da Restauração, Recife, PE, Brasil
4. Hospital das Clínicas, Universidade Federal de Pernambuco, Recife, PE, Brasil
5. AVIVA Cirurgia Plástica, Recife, PE, Brasil
Instituição: Hospital da Restauração, Recife, PE, Brasil.
Autor correspondente:
Pablo Maricevich
AVIVA Cirurgia Plástica AVIVA Cirurgia Plástica
Av. Antônio de Góes, 275, sala 407 - Pina
Recife, PE, Brasil CEP 51110-000
E-mail: pablo@avivacirurgiaplástica.com.br
Artigo submetido: 29/7/2015.
Artigo aceito: 29/9/2015.
Conflitos de interesse: não há.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter