

Original Article - Year 2016 - Volume 31 -
Cranioplastias: estratégias cirúrgicas de reconstrução
Cranioplasties: surgical reconstruction strategies
RESUMO
INTRODUÇÃO: As reconstruções dos ossos do crânio podem ser especialmente desafiadoras. Existem três indicações para se realizar uma cranioplastia: readquirir proteção contra traumas, recuperação do contorno craniano e tratamento da síndrome de trefinado. Este trabalho tem como objetivo mostrar a experiência do autor com cranioplastias e discutir as estratégias cirúrgicas de reconstrução.
MÉTODOS: Foi feita uma análise retrospectiva de 16 casos consecutivos de reconstrução craniana operados na saúde pública (INTO - RJ) e na prática privada em 2013 e 2014.
RESULTADOS: De janeiro de 2013 a janeiro de 2014, 16 pacientes foram operados. Treze eram homens. A idade foi de 10 a 72 anos. Doze pacientes tiveram sua reconstrução feita com enxerto de parietal, 2 com prótese customizada, 1 com redução e fixação da fratura, e 1 com reconstrução de partes moles. A maioria dos defeitos estavam localizados na região fronto-orbital. As próteses customizadas foram usadas em defeitos de 192 e 22,5 cm2. Tivemos complicações em 5 pacientes: lesão de seio sagital, irregularidade no contorno, seroma, não integração do enxerto, vazamento de líquor e extrusão da prótese. Todas as complicações foram resolvidas sem prejuízo à reconstrução. O seguimento variou de 10 a 22 meses. Todos mostraram-se satisfeitos com as reconstruções e houve melhora de funções neurológicas.
CONCLUSÃO: A cranioplastia é uma cirurgia primariamente reparadora para recuperar a função protetora do crânio e tratar a síndrome do trefinado. O enxerto autólogo de parietal segue sendo a primeira escolha. A prótese está indicada quando há um grande defeito ou quando a captação do enxerto parietal não é possível.
Palavras-chave: Autoenxertos; Próteses e implantes; Procedimentos cirúrgicos reconstrutivos; Crânio/cirurgia; Craniotomia.
ABSTRACT
INTRODUCTION: Reconstruction of the skull bones can prove challenging. There are three indications for carrying out cranioplasty: (1) recovery of protection against trauma, (2) recovery of the cranial contour, and (3) treatment of the syndrome of the trephined. The objective of this report is to present the experience of the author with cranioplasties, and discuss surgical reconstruction strategies.
METHODS: This report presents a retrospective analysis of 16 consecutive cases of cranial reconstruction, which were operated in 2013 and 2014 in the public health service (INTO - RJ) and in the private practice.
RESULTS: From January 2013 to January 2014, 16 patients underwent surgery. Thirteen were men. Their age ranged from 10 to 72 years. Twelve patients underwent reconstruction with a parietal graft, two with custom prosthesis, one with fracture reduction and fixation, and one with reconstruction of soft parts . Most of the defects were located in the fronto-orbital region. The customized prostheses were used in defects of 192 cm2 and 22.5 cm2. Complications occurred in five patients: lesion of the sagittal sinus, irregularity in the contour, seroma, failure in graft integration, leakage of cerebrospinal fluid, and extrusion of the prosthesis. All the complications were resolved without impairment to the reconstruction. The follow-up time ranged from 10 to 22 months. All the patients were pleased with the reconstructions, and improvement of the neurological functions was reported.
CONCLUSION: Cranioplasty is a primarily restorative surgical procedure that is used to restore the protective function of the skull and to treat the syndrome of the trephined. The autologous parietal graft is the surgeons' first choice. The prosthesis is indicated when there is a major defect or when the harvesting of a parietal graft is not possible.
Keywords: Autografts; Prostheses and implants; Reconstructive surgical procedures; Skull/surgery; Craniotomy.
As reconstruções dos ossos do crânio podem ser especialmente desafiadoras para o cirurgião plástico craniofacial. Os defeitos muitas vezes são complexos, envolvendo outros tecidos além do osso, e a proximidade com o sistema nervoso central requer conhecimento técnico-anatômico e material cirúrgico de qualidade1.
Defeitos do crânio podem ser resultado de uma série de causas: trauma, sequela de intervenção neurocirúrgica, malformação congênita, neoplasia, radioterapia e infecções2-5. Existem, basicamente, três indicações para se realizar uma cranioplastia: readquirir proteção contra traumas, recuperação do contorno craniano e tratamento da síndrome de trefinado (Syndrome of the trephined ou syndrome of the sunken skin flap)6. As cranioplastias podem ser realizadas com osso autólogo, osso alogênico (banco de osso) ou material aloplástico (hidroxiapatita, titânio e polimetil metacrilato). O enxerto autólogo de tábua externa de parietal é a primeira escolha sempre que possível. Esta técnica ganhou popularidade nas décadas de 70 e 80 com os trabalhos de Psillakis & Cardim, no Brasil7, e Tessier, na França8.
A avaliação apropriada do paciente é crucial para a escolha da estratégia cirúrgica de reconstrução. O tamanho, natureza e localização do defeito; o intervalo entre a criação do defeito e sua correção; a qualidade da cobertura de partes moles; a preferência do cirurgião; e a história e características clínicas do paciente são aspectos que devem ser levados em conta nesta decisão9.
OBJETIVOS
Este trabalho tem como objetivo mostrar a experiência pessoal do autor com cranioplastias e discutir as estratégias cirúrgicas de reconstrução de acordo com as variáveis que cada caso pode apresentar.
METÓDOS
Foi feita uma análise retrospectiva de 16 casos consecutivos de reconstrução craniana operados na saúde pública (Instituto Nacional de Traumatologia e Ortopedia - RJ) e na prática privada em 2013 e 2014. O gênero mais comum foi o masculino (n = 13) a idade variou de 10 a 72 anos e as etiologias mais frequentes foram craniotomia descompressiva (n = 5) e sequelas de trauma (n = 5).
Todos estes casos foram realizados por equipes nas quais o autor era o 1º cirurgião e havia a presença de pelo menos mais um cirurgião crânio-maxilo-facial e um neurocirurgião.
Todos os dados relevantes em relação às características do defeito e do paciente, à técnica operatória utilizada e às complicações ocorridas foram analisados e comparados com a literatura mundial. As condutas tomadas neste trabalho refletem a conduta para cranioplastias do Centro de Atenção Especializada de Cirurgia Crânio-Maxilo-Facial do Instituto Nacional de Traumatologia e Ortopedia - RJ, local de formação em cirurgia crânio-maxilo-facial do autor.
A maioria das cranioplastias foi realizada com enxerto autólogo de tábua externa do parietal e seguindo um mesmo padrão técnico sempre que possível. Dois pacientes fizeram uso de próteses cranianas customizadas de cerâmica porosa (hidroxiapatita e beta tricálcio fosfato) da Eincobio®, sendo uma delas adquirida por meio de doação da empresa.
Técnica Operatória do Enxerto Parietal
Todos os pacientes foram submetidos a exames tomográficos pré-operatórios, anestesia geral durante a cirurgia, antibioticoprofilaxia nas primeiras 24 horas e drenagem a vácuo do sitio cirúrgico. O acesso de escolha é o bicoronal, com ampla exposição do defeito e da área doadora. A área doadora preferencial é a parietal posterior. A incisão não deve ser muito anterior e, algumas vezes, temos que ignorar a incisão prévia do neurocirurgião e fazer outra mais posterior (avaliar necessidade de exposição vs. risco de necrose) (Figura 1). A preferência é pela incisão em Z por motivos estéticos.

Figura 1. Acesso bicoronal posterior em Z ignorando acesso anterior prévio.
O plano de dissecção é o subgaleal. Mais especificamente, no tecido areolar frouxo situado entre a gálea aponeurótica e o pericrânio. A dissecção é feita com bisturi frio associada à tração do retalho pelo auxiliar, deixando o pericrânio íntegro na intenção de usá-lo como retalho posteriormente. Muitas vezes, isso não é possível por causa de cirurgias prévias. Ao redor do defeito e na área doadora, o plano de dissecção é subperiosteal, deixando o osso exposto. Esta dissecção é feita com elevadores de periósteo.
Com o defeito ósseo craniano delimitado, realiza-se a elevação de todo o tecido imediatamente acima da dura-máter com bisturi elétrico monopolar em baixa potência (< 30 watts), garantindo a cobertura mais espessa possível de partes moles sobre a reconstrução. O contato íntimo da dura-máter com o enxerto é desejável do ponto de vista da integração óssea, assim como o reavivamento das bordas do defeito, que deve ser feito com uma broca até achar osso sangrante. Usase irrigação contínua com soro fisiológico sempre que houver uso de brocas e serras para minimizar necrose óssea.
Um template do defeito é feito na falha óssea e transferido para a área doadora, preferencialmente parietal posterior, definindo o tamanho e a quantidade de enxertos. As osteotomias devem respeitar uma distância de 1,5 cm da sutura sagital e 1 cm da sutura coronal10 (Figura 2). Uma broca demarca os enxertos até alcançar a díploe, quando passa a se observar osso sangrante. A partir daí, uma serra sagital tangencia a tábua interna do osso parietal no plano da díploe, descolando a tábua externa. Faz-se isso circundando perifericamente o enxerto e o descolamento central é finalizado com uma serra de Gigli ou osteótomos (Figura 3).

Figura 2. Exposição do defeito craniano, template na área doadora mimetizando o defeito, suturas sagital e coronal demarcadas para referência anatômica e retalho de pericrânio confeccionado.
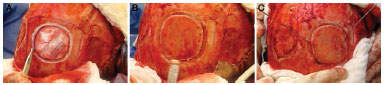
Figura 3. Captação do enxerto de tábua externa de parietal com broca, serra sagital e serra de Gigli.
Uma vez com o enxerto na mão, verifica-se a integridade da tábua interna e se houve alguma laceração da dura-máter. Caso haja algum vazamento de líquor ou sangramento proveniente de laceração da dura-máter, realiza-se um reparo imediato com sutura simples ou um patch de pericrânio, que pode ser reforçado com hemostáticos locais, cola biológica ou dura-máter biossintética, se houver disponibilidade.
O enxerto é, então, encaixado no defeito e fixado. Uma boa fixação e um encaixe adequado borda-a-borda com o osso reavivado maximizam a pega do enxerto. A fixação é realizada com placas e parafusos de perfil baixo (sistema < 2.0) ou, alternativamente, com fios de aço nº 0 ou 1. Uma placa com um furo e um parafuso da cada lado já é o suficiente. Finalmente, se houver possibilidade, são utilizados retalhos de pericrânio para cobrir a área reconstruída e hemostáticos para cobrir área doadora (Figura 4). Os retalhos de pericrânio, além da função de oferecer uma estrutura vascularizada para nutrir o enxerto ósseo, podem preencher espaços mortos e vir a mascarar alguma irregularidade no contorno craniano. A cobertura da reconstrução deve ser feita com tecidos moles viáveis e sem tensão.

Figura 4. Enxerto de tábua externa de parietal fixado no defeito craniano, área doadora coberta com hemostático e retalho de pericrânio cobrindo área reconstruída e área doadora.
Técnica Operatória da Prótese Customizada
No caso de uma prótese customizada, o procedimento é mais simples, pois não há área doadora. A incisão é reduzida objetivando apenas expor o defeito. Por vezes, uma incisão prévia pode ser aproveitada (Figura 5). Ao redor do defeito, o plano de dissecção é o subperiosteal realizado com elevadores de periósteo; e na área do defeito em si o plano de dissecção é realizado com bisturi monopolar em baixa potência (< 30 watts) logo acima da dura-máter. Dependendo da prótese (se porosa ou não), o reavivamento das bordas do defeito deve ser feito com broca até achar osso sangrante visando uma integração óssea do material (Figura 6A).

Figura 5. Acesso reduzido aproveitando a cicatriz prévia apenas para expor o defeito.

Figura 6. A: Defeito exposto com suas bordas reavivadas; B: Prótese customizada fixada no defeito. Publicado originalmente em: Prototipagem: aplicações na cirurgia crâniomaxilo-facial do Instituto Nacional de Traumatologia e Ortopedia (INTO)- RJ; Maricevich P, Pantoja E, Mansur A, Peixoto A, Amando J, Borges PYV, André Braune A, Nasser JA, Cruz RL. Revista Brasileira de Cirurgia Plástica 30(4)2015.
A prótese é fixada com placas e parafusos de perfil baixo (sistema < 2.0) e a cobertura de partes moles deve ser feita com tecido espesso, viável e sem tensão. Uma placa com um furo e um parafuso da cada lado já é o suficiente. Como na maioria das vezes usamos as próteses em grandes defeitos, um ponto de reparo na dura-máter pode ser necessário na tentativa de diminuir o possível espaço morto entre a prótese e a dura-máter (Figura 6B).
RESULTADOS
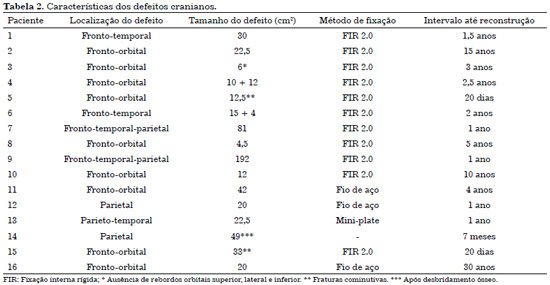
Dos 16 pacientes operados de cranioplastia, doze tiveram sua reconstrução feita com enxerto autólogo de parietal, dois com prótese customizada, um com redução e fixação da fratura, e outro com reconstrução de partes moles. Em um dos pacientes reconstruídos com enxerto parietal, foi usado cimento de hidroxiapatita em associação e em dois deles houve tentativas prévias de cranioplastias com material aloplástico em outros serviços: três tentativas para o paciente 2 e seis tentativas para o paciente 16 (Tabela 1).
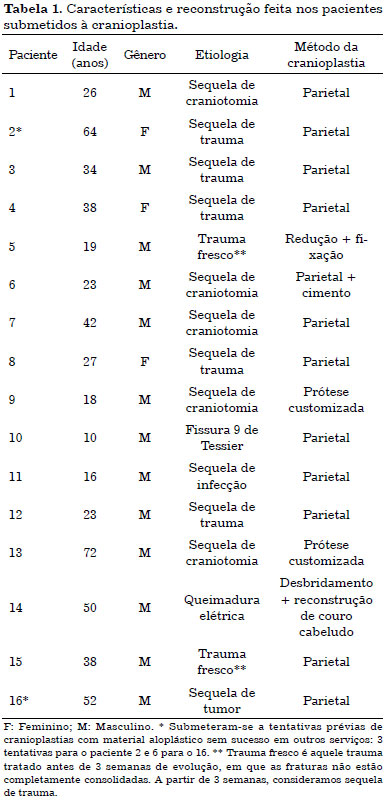
Todos os pacientes com sequela apresentavam defeitos de espessura total, exceto o paciente 14 do choque elétrico, em que havia osso presente, mas estava desvitalizado e com indícios radiológicos de osteomielite; e o paciente 16 de sequela de tumor, no qual havia uma reconstrução com tela de titânio que estava na iminência de extruir. No paciente 14 foi realizado apenas desbridamento de tecido desvitalizado e reconstrução do couro cabeludo (Figura 7); e no paciente 16 a tela foi retirada e a reconstrução foi feita com parietal (Figura 8).

Figura 7. Paciente 14 com osso parietal exposto e sinais radiológicos de osteomielite. O desbridamento ósseo resultou em um defeito craniano de 7 x 7cm. A reconstrução óssea foi postergada para um 2º tempo e a reconstrução de partes moles foi feita com dois grandes retalhos de rotação de couro cabeludo.
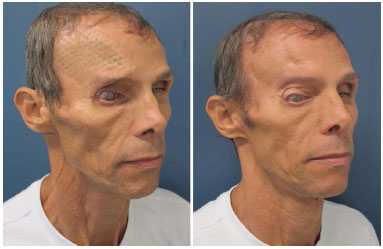
Figura 8. Paciente 16 com história de 6 tentativas prévias de cranioplastias com material aloplástico sem sucesso apresentando tela de titânio na iminência de extruir. Foi realizada a retirada da tela e reconstrução óssea com parietal.
Procedimentos associados às cranioplastias foram realizados em sete pacientes: reconstrução orbitária (sequelas de trauma), ressecção de xantelasma palpebral, tratamento de fratura panfacial (traumas frescos), reconstrução de pálpebra superior (coloboma na Fissura 9, Figura 9) e correção de lagoftalmo (decorrente da tela de titânio mal posicionada).

Figura 9. Paciente 10 portador de fissura 9 de Tessier submetido a cranioplastia com parietal e reconstrução de pálpebra.
A maioria dos defeitos estava localizada na região fronto-orbital (n = 9). Nos pacientes com trauma fresco na região frontal a patência do ducto frontonasal foi atestada pela tomografia no paciente 5; e garantida no transoperatório através de sondas no paciente 15. O tamanho do defeito variou de 4,5 a 192 cm2, com média de 39 cm2. As próteses customizadas foram usadas em defeitos de 192 cm2 (Figura 10) e 22,5 cm2. As duas próteses customizadas foram fixadas com fixação interna rígida (FIR): uma usando sistema 2.0 e outra, sistema mini plate. O paciente 5 de trauma fresco, no qual o defeito foi apenas reduzido e fixado, utilizou FIR 2.0 para fixação.

Figura 10. Paciente 9 portador de defeito craniano de 192 cm2 submetido a cranioplastia com prótese customizada. Figuras 5 a 7 ilustram seu transoperatório. Publicado originalmente em: Prototipagem: aplicações na cirurgia crâniomaxilo-facial do Instituto Nacional de Traumatologia e Ortopedia (INTO)- RJ; Maricevich P, Pantoja E, Mansur A, Peixoto A, Amando J, Borges PYV, André Braune A, Nasser JA, Cruz RL. Revista Brasileira de Cirurgia Plástica 30(4) 2015.
Dos 12 pacientes que foram reconstruídos com enxerto parietal, nove usaram FIR 2.0 e três usaram fio de aço nº 0 ou 1 como método de fixação. O paciente 14 não fez uso de meios de fixação, já que a reconstrução óssea foi postergada para um 2º tempo. O intervalo entre a criação do defeito e sua reconstrução definitiva variou de 20 dias até 30 anos, sendo que os pacientes 2 e 16 submeterem-se a tentativas prévias em outros serviços (Tabela 2).
Dos 16 pacientes operados, tivemos algum tipo de complicação em 5 (30%). Todas as complicações foram resolvidas sem prejuízo à reconstrução (Tabela 3).
Na paciente 4 houve uma lesão do seio sagital na retirada do enxerto parietal que foi prontamente corrigida com patch de pericrânio e hemostático sem qualquer repercussão hemodinâmica. Nesta mesma paciente, as placas do sistema 2.0 ficaram muito evidentes na fronte, causando irregularidade, e decidimos reoperá-la com 5 meses de pós-operatório para retirada dos meios de fixação e lipoenxertia.
O paciente 6 evoluiu com seroma no 14º DPO e houve perda de todo o cimento de hidroxiapatita pela ferida. O tratamento foi conservador com punções seriadas e expressão digital.
No paciente 7 não houve integração do enxerto parietal fixado no defeito. No 3º mês de evolução, palpávamos o enxerto completamente móvel e reoperamos o paciente para captação de mais enxertos parietais e nova reconstrução do defeito.
No paciente 11 observamos um pequeno vazamento de líquor durante a dissecção da área do defeito proveniente do orifício de trepanação prévia. A correção foi feita com retalho de pericrânio reforçado com hemostáticos, dura-máter biossintética e cola biológica. Ainda, o paciente ficou em decúbito elevado e mantivemos antibioticoterapia e diurético por 1 semana (Figura 11).

Figura 11. Paciente 11 apresentou vazamento de líquor pelo orifício de trepanação prévia durante a exposição do defeito. O vazamento foi tratado com retalho de pericrânio, hemostático, dura-máter biossintética e cola biológica. Defeito exposto; área doadora e retalho de pericrânio; enxertos fixados no defeito.
No paciente 13 houve sofrimento de uma pequena área do retalho de couro cabeludo (1 polpa digital) que evoluiu com extrusão parcial da prótese com 4 semanas de pós-operatório. O paciente foi levado ao centro cirúrgico para reoperação e durante a cirurgia decidimos por manter a prótese e cobri-la com dois grandes retalhos de couro cabeludo. Esta decisão foi baseada na ausência de infecção e no bom aspecto da prótese em aparente processo de integração (Figura 12).

Figura 12. Paciente 13 submetido à cranioplastia com prótese customizada que apresentou extrusão da prótese. O paciente foi reoperado, mantivemos a mesma prótese e fizemos a cobertura com um grande retalho de rotação do couro cabeludo.
Em adição, houve pequena exposição da duramáter, mas sem lesão da mesma, nos pacientes 6, 7 e 15.
O seguimento destes pacientes variou de 10 a 22 meses. Todos eles, atualmente, mostram-se satisfeitos com suas reconstruções. Houve restituição da continuidade craniana em todos os pacientes. Alguns procedimentos cirúrgicos foram realizados posteriormente às cranioplastias: em quatro deles (pacientes 2, 3, 4 e 8) realizou-se lipoenxertia para retoque do contorno; e no paciente 6 foi realizada uma rinoplastia para correção de laterorrinia.
Apesar de não termos quantificado isso objetivamente com testes pré e pós-operatórios, muitos pacientes relataram melhoras de funções neurológicas como a marcha e a fala. O paciente 1 é um Mestre em Matemática, atualmente está terminando seu Doutorado e nos relatou uma melhora evidente da sua concentração durante seus estudos.
DISCUSSÃO
Não há um consenso a respeito do tamanho mínimo de um defeito craniano para indicar cranioplastia. Gladstone et al.11 recomendam reconstrução a partir de 16 cm2 e Dujovny et al.12 a partir de 6 cm2. Em relação ao contorno craniano, além da evidente questão estética, a deformidade muitas vezes pode despertar nos outros preconceitos em relação à saúde neurológica e capacidade mental do paciente6. No entanto, em alguns pacientes, defeitos cranianos podem sim acarretar sintomas neurológicos.
Em 1939, Grant e Norcross13 descreveram a síndrome do trefinado em pacientes portadores de defeitos cranianos pós-craniectomias. Os sintomas incluem tonteiras, fadiga, desconforto vago no local do defeito, depressão mental, apreensão, insegurança e intolerância à vibração. A fisiopatologia destes sintomas ainda não é totalmente esclarecida, mas pode estar relacionada a mudanças na circulação dos fluidos cérebro-espinhais14 ou ao efeito da pressão atmosférica comprimindo o córtex ou à redução do retorno venoso causado pela obliteração do espaço subaracnoide15. Em 1945, Gardner16 atestou melhora da função neurológica após cranioplastia, o que foi confirmado por muitos outros autores posteriormente17-24.
Na nossa casuística, os pacientes procuraram ajuda médica principalmente para corrigir a deformidade estética e readquirir a proteção ao trauma. Independentemente do tamanho do defeito, o simples impacto psicológico decorrente preocupação constante com um possível trauma já pode justificar uma indicação cirúrgica, principalmente em jovens ativos6. Muitos dos nossos pacientes deixaram de trabalhar e praticar atividades físicas por conta do defeito craniano, prejudicando suas relações sociais e aspirações pessoais. O relato da melhora de algumas funções neurológicas em alguns pacientes foi algo que nos surpreendeu positivamente, visto que era um benefício que não poderíamos garantir no pré-operatório (Figuras 13 e 14).

Figura 13. Paciente 1 portador de defeito craniano evidente (sunken skin flap) submetido à cranioplastia com parietal. Foi um dos pacientes que, espontaneamente, relatou melhoras de funções neurológicas.

Figura 14. Paciente 12 submetido à cranioplastia com parietal também relatou melhoras de funções neurológicas após reconstrução. Figuras 2 a 4 ilustram seu transoperatório.
O enxerto autólogo de parietal é a nossa primeira escolha sempre que possível para reconstruções cranianas. O enxerto autólogo oferece menor risco de infecção e extrusão do que materiais aloplásticos. No entanto, há a possibilidade de absorção, o contorno pode não ficar perfeito e existe a morbidade da área doadora6,25-28. Em contrapartida, uma prótese customizada oferece um contorno perfeito, mas há um risco maior de infecção e extrusão25,29-31, e o custo pode ser um impedimento ao seu uso.
A decisão do método de reconstrução em nossos pacientes foi individualizada e passou por vários critérios9, mas principalmente avaliamos o tamanho do defeito e a qualidade da área doadora por tomografia (quantidade e espessura do parietal, e definição da díploe). Usamos prótese customizada em dois pacientes: um grande defeito (192 cm2) e um paciente com idade mais avançada (72 anos). Uygur9 propôs um algoritmo de cranioplastias em que defeitos grandes (> 200 cm2) seriam corrigidos com metil metacrilato, polietileno poroso ou o próprio osso ressecado após autoclavagem (no caso de craniectomias descompressivas).
A região parietal posterior 1,5 a 2 cm lateral à sutura sagital, 1 cm posterior à sutura coronal e 2 cm medial à sutura escamosa é a nossa preferência. Esta região tem espessura de 6,75 mm em média, é mais espessa em mulheres e na raça negra, e sua espessura não varia com a idade em adultos32. A maior dificuldade e risco de captação de enxerto parietal em idosos está mais relacionada à ausência de díploe bem definida e à maior fragilidade do osso nesta faixa etária32, como foi o caso de um dos nossos pacientes que indicamos prótese.
Alguns cuidados no transoperatório também podem maximizar a viabilidade do enxerto: irrigação contínua no uso de brocas e serras, reavivamento das bordas do defeito, guardar o enxerto em compressas úmidas com soro fisiológico pelo menor tempo possível (máximo 1 hora), encaixe exato do enxerto no defeito, boa fixação e estabilização do enxerto, preencher espaços mortos com material ósseo ou retalho de pericrânio, cobrir o enxerto com um envelope de partes moles espesso e bem vascularizado, e garantir que enxerto fique sobre um dura-máter viável10,33,34.
O contato do enxerto com pericrânio e duramáter contribui para a integração do enxerto de parietal, entretanto, o contato com a dura-máter parece ser mais efetivo e é responsável pelo crânio ser um sítio privilegiado para grandes enxertos ósseos35. Daí, a importância da dissecção do defeito ser em um plano exatamente acima da dura-máter, deixando-a limpa e em íntimo contato com o osso transplantando.
As próteses utilizadas para reconstrução craniana podem ser de vários materiais aloplásticos como hidroxiapatita (HA), titânio e polimetil metacrilato. Alguns materiais podem ser moldados no ato operatório e outros já vêm como uma prótese customizada. Estes materiais devem apresentar algumas características para serem considerados adequados: biocompatibilidade, compatibilidade com exames de imagem, facilidade em manusear e moldar, resistência adequada (parecida com o osso) e serem esterilizáveis.
As duas próteses que utilizamos foram da empresa Eincobio®, customizadas por prototipagem e feitas de cerâmica porosa (HA e beta tricálcio fosfato). A HA é um material que se aproxima bastante das características biológicas do osso (HA constitui 60% do tecido ósseo) e pode integrar-se com o tecido ósseo. A presença de poros de vários tamanhos é importante para que haja migração tanto de tecido fibroso como de tecido ósseo por dentro da prótese36.
Estudos experimentais em animais37 e a retirada de próteses de HA em humanos38 revelaram que a migração osteoblástica ocorre a partir de 4 a 8 meses e, a partir daí, há uma boa ósteointegração no perímetro da prótese. Após 1 ano de cranioplastia, em alguns casos de fraturas da prótese, há relatos de "consolidação" espontânea após tratamento conservador36. No paciente 13, em que houve a exposição da prótese de HA, além da ausência de infecção e o fato de termos conseguido uma boa cobertura com dois grandes retalhos de rotação de couro cabeludo, esta característica de ósteointegração da prótese de HA nos fez decidir por mantê-la no paciente durante a reoperação. Também consideramos outra vantagem o fato de prótese customizada de HA ter uma espessura maior do que a prótese de titânio, por exemplo. Isto faz que o espaço morto entre a prótese e a dura-máter seja menor.
Em um dos nossos casos, o paciente 14, não havia uma condição ideal para obtermos uma boa cobertura de partes moles e optamos por não realizar a reconstrução óssea nesta oportunidade. Ainda mais na presença de uma infecção local, quando a cranioplastia imediata é raramente indicada e devemos esperar um período de 639,40 a 1241-43 meses para garantir a resolução total do quadro infeccioso.
A qualidade da cobertura do couro cabeludo influencia diretamente na escolha da conduta cirúrgica. Independentemente do material usado, a cranioplastia deve ter uma cobertura de tecido bem vascularizado. Retalhos locais, expansão tecidual e retalhos livres são alternativas para se obter uma boa cobertura. Enxertos de pele não entram nas opções para cobertura de cranioplastias.
Em grandes defeitos ou áreas irradiadas, devemos pensar em retalhos livres ou expansão tecidual6. No caso da cranioplastia com enxerto ósseo autólogo, o acréscimo um retalho de pericrânio sobre a área reconstruída deve ser realizada sempre que possível35.
As possíveis complicações das cranioplastias10, principalmente quando se usa enxerto de parietal, são: laceração da dura-máter, hematoma subgaleal, infecção do sitio cirúrgico, não integração do enxerto, absorção do enxerto, extrusão do enxerto ou prótese, irregularidades do contorno craniano e possível injúria cerebral44. Lacerações da dura-máter são evitadas constatando a boa definição na díploe do paciente no pré-operatório e usando material cirúrgico de boa qualidade. No entanto, uma vez havendo lesão da dura-máter, esta é considerada uma complicação leve: corrigimos o defeito imediatamente assim como faríamos se fosse o peritônio ou pleura10.
A lesão de seio sagital em um de nossos pacientes foi tratada desta forma sem nenhuma dificuldade. As irregularidades do contorno não incomodam o paciente se forem localizadas em áreas pilosas. Contudo, podem ser evidentes na região frontal. Neste ponto, um encaixe adequado do enxerto e sua fixação com FIR de perfil baixo (sistema < 2.0) são importantes. Infelizmente, por questão de disponibilidade, tivemos que usar o sistema 2.0 em alguns pacientes, o que não achamos adequado na fronte. Problema de contorno quase que inexiste quando usamos próteses customizadas e mini plates.
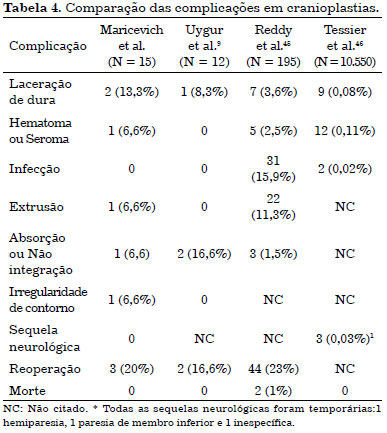
Se houver irregularidades no pós-operatório tardio, a solução pode ser a retirada dos meios de fixação, camuflagem com cimento de hidroxiapatita e/ou lipoenxertia. O nosso único caso de seroma provavelmente esteve ligado ao uso do cimento de hidroxiapatita. Comparamos nossas complicações de reconstrução craniana óssea com a literatura mundial (Tabela 4).
CONCLUSÃO
A cranioplastia é uma cirurgia primariamente reparadora para recuperar a função protetora do crânio e tratar a síndrome do trefinado. Por consequência, acaba por restabelecer o contorno craniano, trazendo um grande benefício estético e ressocializador. O enxerto autólogo de parietal segue sendo a primeira escolha sempre que possível. A prótese aloplástica está indicada principalmente quando há um grande defeito ou quando a captação do enxerto parietal não é possível por algum motivo: espessura inadequada ou díploe mal definida.
Para realizar uma reconstrução craniana com enxerto de parietal, é fundamental o uso de material cirúrgico de boa qualidade e conhecimento da anatomia com o uso de tomografia computadorizada. Quando a escolha é pela prótese customizada, o contorno craniano fica perfeito.
AGRADECIMENTOS
Agradeço ao Dr. José Augusto Nasser, neurocirurgião, que esteve comigo em todas estas cirurgias dando suporte neurocirúrgico, e agradeço, principalmente, ao Dr. Ricardo Cruz, chefe do CAE-CMF do INTO-RJ, meu professor e mentor na cirurgia craniofacial que, além dos aspectos teóricos e práticos da cirurgia, exemplifica no dia-a-dia a visão holística e humana que devemos ter com os nossos pacientes. Em adição, agradeço a toda equipe multidisciplinar do INTO-RJ, onde aprendi muito mais do que apenas colocar placas e parafusos.
REFERÊNCIAS
1. Hara T, Farias CASA, Costa MJM, Cruz RJL. Cranioplastia: parietal versus prótese customizada. Rev Bras Cir Plást. 2011;26(1):32-6. DOI: http://dx.doi.org/10.1590/S1983-51752011000100008
2. Agrawal A, Garg LN. Split calvarial bone graft for the reconstruction of skull defects. J Surg Tech Case Rep. 2011;3(1):13-6. DOI: http://dx.doi.org/10.4103/2006-8808.78465
3. Artico M, Ferrante L, Pastore FS, Ramundo EO, Cantarelli D, Scopelliti D, et al. Bone autografting of the calvaria and craniofacial skeleton: historical background, surgical results in a series of 15 patients, and review of the literature. Surg Neurol. 2003;60(1):71-9. DOI: http://dx.doi.org/10.1016/S0090-3019(03)00031-4
4. Neligan PC, Boyd JB. Reconstruction of the cranial base defect. Clin Plast Surg. 1995;22(1):71-7.
5. Erculei F, Walker AE. Posttraumatic epilepsy and early cranioplasty. J Neurosurg. 1963;20:1085-9. PMID: 14186110 DOI: http://dx.doi.org/10.3171/jns.1963.20.12.1085
6. Baumeister S, Peek A, Friedman A, Levin LS, Marcus JR. Management of postneurosurgical bone flap loss caused by infection. Plast Reconstr Surg. 2008;122(6):195e-208e. PMID: 19050490 DOI: http://dx.doi.org/10.1097/PRS.0b013e3181858eee
7. Psillakis JM, Nocchi VL, Zanini SA. Repair of large defect of frontal bone with free graft of outer table of parietal bones. Plast Reconstr Surg. 1979;64(6):827-30. PMID: 390579 DOI: http://dx.doi.org/10.1097/00006534-197912000-00023
8. Tessier P. Autogenous bone grafts taken from the calvarium for facial and cranial applications. Clin Plast Surg. 1982;9(4):531-8.
9. Uygur S, Eryilmaz T, Cukurluoglu O, Ozmen S, Yavuzer R. Management of cranial bone defects: a reconstructive algorithm according to defect size. J Craniofac Surg. 2013;24(5):1606-9. DOI: http://dx.doi.org/10.1097/SCS.0b013e3182a2101c
10. Tessier P, Kawamoto H, Posnick J, Raulo Y, Tulasne JF, Wolfe SA. Taking calvarial grafts, either split in situ or splitting of the parietal bone flap ex vivo--tools and techniques: V. A 9650-case experience in craniofacial and maxillofacial surgery. Plast Reconstr Surg. 2005;116(5 Suppl):54S-71S. PMID: 16217445 DOI: http://dx.doi.org/10.1097/01.prs.0000173949.51391.d4
11. Gladstone HB, McDermott MW, Cooke DD. Implants for cranioplasty. Otolaryngol Clin North Am. 1995;28(2):381-400.
12. Dujovny M, Aviles A, Agner C, Fernandez P, Charbel FT. Cranioplasty: cosmetic or therapeutic? Surg Neurol. 1997;47(3):238-41. PMID: 9068693
13. Grant FC, Norcross NC. Repair of cranial defect by cranioplasty Ann Surg. 1939;110(4):488-512.
14. Dujovny M, Fernandez P, Alperin N, Betz W, Misra M, Mafee M. Post-cranioplasty cerebrospinal fluid hydrodynamic changes: magnetic resonance imaging quantitative analysis. Neurol Res. 1997;19(3):311-6.
15. Richaud J, Boetto S, Guell A, Lazorthes Y. Effects of cranioplasty on neurological function and cerebral blood flow. Neurochirurgie. 1985;31(3):183-8.
16. Gardner WJ. Closure of defects of the skull with tantalum. Surg Gynecol Obstet. 1945;80:303-12.
17. Grantham EC, Landis HP. Cranioplasty and the post-traumatic syndrome. J Neurosurg. 1948;5(1):19-22.
18. Agner C, Dujovny M, Gaviria M. Neurocognitive assessment before and after cranioplasty. Acta Neurochir (Wien). 2002;144(10):1033-40.
19. Harner SG, Beatty CW, Ebersold MJ. Impact of cranioplasty on headache after acoustic neuroma removal. Neurosurgery. 1995;36(6):1097-9.
20. Isago T, Nozaki M, Kikuchi Y, Honda T, Nakazawa H. Sinking skin flap syndrome: a case of improved cerebral blood flow after cranioplasty. Ann Plast Surg. 2004;53(3):288-92.
21. Schiffer J, Gur R, Nisim U, Pollak L. Symptomatic patients after craniectomy. Surg Neurol. 1997;47(3):231-7. PMID: 9068692
22. Segal DH, Oppenheim JS, Murovic JA. Neurological recovery after cranioplasty. Neurosurgery. 1994;34(4):729-31.
23. Tabaddor K, LaMorgese J. Complication of a large cranial defect. Case report. J Neurosurg. 1976;44(4):506-8. PMID: 1255240
24. Yamaura A, Sato M, Meguro K, Nakamura T, Uemura K. Cranioplasty following decompressive craniectomy--analysis of 300 cases (author's transl). No Shinkei Geka. 1977;5(4):345-53.
25. Yadla S, Campbell PG, Chitale R, Maltenfort MG, Jabbour P, Sharan AD, et al. Effect of early surgery, material, and method of flap preservation on cranioplasty infections: a systematic review. Neurosurgery. 2011;68(4):1124-9.
26. Cheng YK, Weng HH, Yang JT, Lee MH, Wang TC, Chang CN. Factors affecting graft infection after cranioplasty. J Clin Neurosci. 2008;15(10):1115-9.
28. Gao LL, Rogers GF, Clune JE, Proctor MR, Meara JG, Mulliken JB, et al. Autologous cranial particulate bone grafting reduces the frequency of osseous defects after cranial expansion. J Craniofac Surg. 2010;21(2):318-22.
29. Sahoo N, Roy ID, Desai AP, Gupta V. Comparative evaluation of autogenous calvarial bone graft and alloplastic materials for secondary reconstruction of cranial defects. J Craniofac Surg. 2010;21(1):79-82.
30. Gosain AK; Plastic Surgery Eductional Foundation DATA Committee. Biomaterials for reconstruction of the cranial vault. Plast Reconstr Surg. 2005;116(2):663-6. PMID: 16079708
31. Zins JE, Langevin CJ, Nasir S. Controversies in skull reconstruction. J Craniofac Surg. 2010;21(6):1755-60. DOI: http://dx.doi.org/10.1097/SCS.0b013e3181c34675
32. Moreira-Gonzalez A, Papay FE, Zins JE. Calvarial thickness and its relation to cranial bone harvest. Plast Reconstr Surg. 2006;117(6):1964-71. PMID: 16651971 DOI: http://dx.doi.org/10.1097/01.prs.0000209933.78532.a7
33. Park HK, Dujovny M, Agner C, Diaz FG. Biomechanical properties of calvarium prosthesis. Neurol Res. 2001;23(2-3):267-76. DOI: http://dx.doi.org/10.1179/016164101101198424
34. Netscher DT, Stal S, Shenaq S. Management of residual cranial vault deformities. Clin Plast Surg. 1992;19(1):301-13. PMID: 1537225
35. Sweeney W, Gosain SA, Santoro TD, Song L, Amarante MT, Gosain AK. What makes the calvaria a privileged site for bone graft survival? Plast Reconstr Surg. 2010;126(Suppl 4S):2. DOI: http://dx.doi.org/10.1097/01.prs.0000388719.39193.c0
36. Stefini R, Esposito G, Zanotti B, Iaccarino C, Fontanella MM, Servadei F. Use of "custom made" porous hydroxyapatite implants for cranioplasty: postoperative analysis of complications in 1549 patients. Surg Neurol Int. 2013;4:12. DOI: http://dx.doi.org/10.4103/2152-7806.106290
37. Kon E, Muraglia A, Corsi A, Bianco P, Marcacci M, Martin I. Autologous bone marrow stromal cells loaded onto porous hydroxyapatite ceramic accelerate bone repair in critical-size defects of sheep long bones. J Biomed Mater Res. 2000;49(3):328-37. DOI: http://dx.doi.org/10.1002/(SICI)1097-4636(20000305)49:3<328::AID-JBM5>3.0.CO;2-Q
38. Messina G, Dones I, Nataloni A, Franzini A. Histologically demonstrated skull bone integration in a hydroxyapatite prosthesis in a human. Acta Neurochir (Wien). 2011;153(8):1717-8. DOI: http://dx.doi.org/10.1007/s00701-011-1014-5
39. Lee C, Antonyshyn OM, Forrest CR. Cranioplasty: indications, technique, and early results of autogenous split skull cranial vault reconstruction. J Craniomaxillofac Surg. 1995;23(3):133-42. DOI: http://dx.doi.org/10.1016/S1010-5182(05)80001-0
40. Eppley BL, Kilgo M, Coleman JJ 3rd. Cranial reconstruction with computer-generated hard-tissue replacement patient-matched implants: indications, surgical technique, and long-term follow-up. Plast Reconstr Surg. 2002;109(3):864-71. DOI: http://dx.doi.org/10.1097/00006534-200203000-00005
41. Manson PN, Crawley WA, Hoopes JE. Frontal cranioplasty: risk factors and choice of cranial vault reconstructive material. Plast Reconstr Surg. 1986;77(6):888-904. PMID: 3520618 DOI: http://dx.doi.org/10.1097/00006534-198606000-00003
42. Hammon WM, Kempe LG. Methyl methacrylate cranioplasty. 13 years experience with 417 patients. Acta Neurochir (Wien). 1971;25(1):69-77.
43. Rish BL, Dillon JD, Meirowsky AM, Caveness WF, Mohr JP, Kistler JP, et al. Cranioplasty: a review of 1030 cases of penetrating head injury. Neurosurgery. 1979;4(5):381-5. PMID: 111153 DOI: http://dx.doi.org/10.1227/00006123-197905000-00002
44. Kline RM Jr, Wolfe SA. Complications associated with the harvesting of cranial bone grafts. Plast Reconstr Surg. 1995;95(1):5-13. DOI: http://dx.doi.org/10.1097/00006534-199501000-00002
45. Reddy S, Khalifian S, Flores JM, Bellamy J, Manson PN, Rodriguez ED, et al. Clinical outcomes in cranioplasty: risk factors and choice of reconstructive material. Plast Reconstr Surg. 2014;133(4):864-73. PMID: 24675189 DOI: http://dx.doi.org/10.1097/PRS.0000000000000013
46. Tessier P, Kawamoto H, Posnick J, Raulo Y, Tulasne JF, Wolfe SA. Complications of harvesting autogenous bone grafts: a group experience of 20,000 cases. Plast Reconstr Surg. 2005;116(5 Suppl):72S-73S. PMID: 16217446 DOI: http://dx.doi.org/10.1097/01.prs.0000173841.59063.7e
1. Sociedade Brasileira de Cirurgia Plástica, São Paulo, SP, Brasil
2. Associação Brasileira de Cirurgia Crânio-Maxilo-Facial, São Paulo, SP, Brasil
3. Instituto Nacional de Traumatologia e Ortopedia, Rio de Janeiro, RJ, Brasil
4. Sociedade Brasileira de Neurocirurgia, São Paulo, SP, Brasil
5. Academia Nacional de Medicina, Rio de Janeiro, RJ, Brasil
Instituição: Instituto Nacional de Traumatologia e Ortopedia - RJ Clínica Privada.
Autor correspondente:
Pablo Maricevich
Av. Antônio de Góes, 275, Pina
Recife, PE, Brasil CEP 51110-000
E-mail: jpmaricevich@hotmail.com
Artigo submetido: 12/10/2014.
Artigo aceito: 21/4/2015.



 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter