

Original Article - Year 2016 - Volume 31 -
Segurança e viabilidade de um novo formato de retalho toracoepigástrico na reconstrução da parede torácica em câncer de mama localmente avançado: um estudo transversal
Safety and viability of a new format of thoracoepigastric flap for reconstruction of the chest wall in locally advanced breast cancer: a cross-sectional study
RESUMO
INTRODUÇÃO: Pacientes submetidas à mastectomia radical, com extensa perda tecidual, necessitam de procedimento cirúrgico de fechamento rápido e simples da lesão, com boa cobertura cutânea e mínima morbidade, para que possam receber precocemente tratamentos complementares. Estudamos a eficácia e a segurança de um novo formato do retalho toracoepigástrico com o posicionamento semissentado (Fowler) da paciente durante a cirurgia. A hipótese é de que o procedimento, além de obter adequado fechamento de grandes lesões, permita garantir a sobrevivência do retalho.
MÉTODOS: Foram analisadas todas as pacientes consecutivamente operadas com mastectomias radicais entre 2009 e 2014 submetidas a reconstruções torácicas. Os principais desfechos analisados foram a viabilidade do retalho e a eficácia no fechamento cirúrgico.
RESULTADOS: No período do estudo, foram operadas 29 pacientes com tumor localmente avançado (90%) ou recidivado (10%), uma operada bilateralmente (30 retalhos); vinte e três (79%) com estadiamento III e seis (21%), estadiamento IV. A extensão das áreas ressecadas variou de 20 x 15 cm a 13 x 9 cm (média 15,5 x 11,6 cm). Retalho toracoepigástrico foi utilizado com dimensões variando de 25 x 12 cm a 18 x 8 cm (média de 21,3 x 10,4 cm). Houve apenas duas deiscências (7%), que cicatrizaram sem necessidade de intervenção cirúrgica, e um hematoma, drenado cirurgicamente. Uma paciente faleceu no 11º dia pós-operatório.
CONCLUSÃO: O retalho toracoepigástrico foi eficaz e seguro, sem necessidade do uso de outros retalhos ou enxertos cutâneos, fechando a área doadora adequadamente em todos os casos. Todas as pacientes, excluindo o óbito, estavam aptas para o tratamento complementar após um mês.
Palavras-chave: Tórax; Parede torácica; Mastectomia; Procedimentos cirúrgicos reconstrutivos; Retalhos cirúrgicos.
ABSTRACT
INTRODUCTION: Patients who undergo radical mastectomy with extensive tissue loss require a surgical procedure for rapid and simple closure of the lesion, with good skin coverage and minimal morbidity, to make them eligible for early complementary treatments. We evaluated the efficacy and safety of a new format of thoracoepigastric flap with patients in the Semi-Fowler position during surgery. We hypothesized that this procedure would achieve proper closure of large lesions and ensure the survival of the flap.
METHODS: All consecutive patients who underwent radical mastectomy between 2009 and 2014 and had chest wall reconstruction were evaluated. The main outcomes evaluated were the viability of the flap and effectiveness of the surgical closure.
RESULTS: During the study period, we operated on 29 patients with locally advanced (90%) or recurrent tumor (10%), and one patient was operated on bilaterally (total of 30 flaps). Of the study sample, 23 patients (79%) were at stage III and 6 (21%), at stage IV. The dimensions of the resected areas varied from 20 x 15 cm to 13 x 9 cm (average 15.5 x 11.6 cm). The dimensions of the thoracoepigastric flaps varied from 25 x 12 to 18 x 8 cm (average 21.3 x 10.4 cm). There were only 2 cases of dehiscence (7%), which resolved without surgical intervention, and one case of hematoma, which was drained surgically. One patient died on the eleventh postoperative day.
CONCLUSION: Thoracoepigastric flaps were effective and safe, did not require the use of other flaps or skin grafting, and adequately closed the donor areas in all cases. All patients, except the patient who died, were eligible for complementary treatment one month after surgery.
Keywords: Chest; Chest wall; Mastectomy; Reconstructive surgical procedures; Surgical flaps.
Ainda nos deparamos com casos de tumores extensos, que decorrem do diagnóstico tardio da doença e das recidivas locais de tumores com comportamento agressivo1. Câncer de mama localmente avançado inclui os tumores T3 e T4 (estádios clínicos IIb, IIIa e IIIb) e o carcinoma inflamatório2,3. Compreende 10-25% de todos os cânceres de mama em países desenvolvidos e 40-50% nos países em desenvolvimento4,5.
Extirpação cirúrgica radical nesses pacientes produz extensa perda cutânea com grandes lesões torácicas que não podem ser reparadas com o fechamento primário6,7. Esses pacientes frequentemente apresentam mau prognóstico clínico e convivem com extensas feridas necrosantes que causam dor, sangramento e infecção7. Devido à alta morbidade e gravidade desses casos, deve ser realizado um fechamento rápido e simples com cobertura cutânea de boa qualidade, para que possam receber precocemente quimioterapia e radiação pós-operatória8.
A utilização de retalhos elaborados, como os retalhos miocutâneos, proporciona uma cobertura eficaz para grandes defeitos, porém, demanda um tempo cirúrgico maior, aumentando morbidades que retardariam o tratamento adicional9,10. Apesar da indicação precisa de retalhos miocutâneos para a reconstrução de tórax após mastectomia11-13, a importância dos retalhos fasciocutâneos locorregionais14,15, idealizados a partir do estudo da vascularização do território fascial da parede abdominal, já foi demonstrada16-18.
Estudo retrospectivo com 315 pacientes com tumores avançados ou recidivados comparou a utilização dos retalhos fasciocutâneos toracoabdominais com os miocutâneos em 40 pacientes, que necessitaram de cirurgia para fechamento da parede torácica. O trabalho demonstrou que os retalhos fasciocutâneos são de rápida execução, baixa morbidade e apresentam índices de necrose parcial semelhantes aos dos retalhos miocutâneos, apesar das restrições quanto à quantidade de pele a ser mobilizada e à radioterapia prévia. Representam, portanto, boa opção para o tratamento das lesões torácicas19.
Apesar de não ser utilizado no estudo de Deo et al.19, o retalho transverso abdominal toracoepigástrico se inclui nos critérios de baixa morbidade creditados aos retalhos fasciocutâneos para a reconstrução dos defeitos do tórax pós-mastectomias. Tem sido sugerido na literatura desde a década de 1970 como um útil método para o fechamento de grandes defeitos da parede torácica após mastectomia20. Foi descrito inicialmente por Tai e Hasegawa, como um retalho de transposição autonomizado em três casos e não autonomizado em dois, para o tratamento do câncer recidivado de mama20. Nos casos não autonomizados, o limite lateral do retalho considerado seguro foi a linha axilar posterior.
Sete anos depois, Davis et al.21, em série clínica e estudo anatômico, baseados nos conceitos de territórios vasculares do sistema de perfurantes da artéria epigástrica superior profunda - divulgado por Brown et al.22 e Bohmert23 -, definiram o pedículo do retalho toracoepigástrico como sendo axial e estabeleceram os seus limites anatômicos. De acordo com essa descrição21, a borda superior do retalho toracoepigástrico deve incluir a região do sulco mamário que contém um ramo lateral da artéria epigástrica superior, com calibre semelhante ao da artéria mamária interna23. A base do retalho fica posicionada medialmente, do apêndice xifoide até o ponto médio entre o umbigo e este último. A borda inferior do retalho é uma linha paralela à margem superior, posicionada conforme pinçamento bidigital (que pode chegar até 15 cm) da pele excedente da região tóraco-abdominal24.
O retalho toracoepigástrico é axial desde a borda lateral do músculo reto abdominal até linha axilar anterior, e, após esta, torna-se ao acaso (plexo subdérmico) e perde relativamente sua segurança vascular24, principalmente se ultrapassar a linha axilar posterior21. O retalho toracoepigástrico estendido, como tem um segmento ao acaso ligado a sua porção axial, requer um cuidado maior na sua dissecção, cujo limite deve ser a borda lateral do músculo reto abdominal.
Os retalhos descritos por Davis et al.21 em cinco pacientes não apresentaram complicações e podiam chegar até 35 cm de comprimento e 15 cm de largura, desde que a recomendação do estreitamento da extremidade do mesmo fosse respeitada para melhorar o suprimento subdérmico e facilitar o fechamento por aproximação da área doadora. O total de casos informados de reconstrução de tórax foi de 16, porém apenas cinco foram individualizados e descritos.
McCraw et al.25, em publicação sem descrição de casos, relataram que o retalho toracoepigástrico poderia se estender também até 5 cm após a linha axilar posterior e que na sua experiência a incidência de perda da extremidade distal (ao acaso) foi de 10%.
Woods et al.26 relatam dois casos do retalho toracoepigástrico "estendido" no comprimento, em uma série que incluía tanto retalhos fasciocutâneos como miocutâneos. A área doadora desses retalhos era enxertada e as suas complicações não foram individualizadas.
Leinster e Webster27, na década de 80, informam dez casos deste retalho junto a outros fasciocutâneos realizados. Neste estudo, a análise das complicações do retalho toracoepigástrico também não foram individualizadas26,27.
Na literatura, os relatos de série de casos utilizando retalhos toracoepigástricos em reconstrução de tórax como descritos por Tai20 e Davis21, limitam-se de dois a 16 casos20,21,26.
OBJETIVO
Em pacientes com câncer de mama localmente avançado, propomos um estudo da eficácia e segurança de um novo formato do retalho toracoepigástrico com o posicionamento semissentado (Fowler) da paciente durante a cirurgia. A hipótese é de que o procedimento, além de obter adequado fechamento de grandes lesões, permita garantir a sobrevivência do retalho.
MÉTODOS
Este é um estudo observacional, transversal, realizado no período de 2009 a 2014, no Núcleo de Cirurgia Plástica Reparadora do Hospital Pérola Byington, em São Paulo, SP. Foram incluídas pacientes do gênero feminino, de qualquer idade, com diagnóstico de câncer de mama localmente avançado incluindo os recidivados (estadiamento oncológico III e IV), submetidas à mastectomia radical com extensa ressecção cutânea, com reconstrução imediata de parede torácica com o retalho toracoepigástrico. Uma paciente foi submetida à reconstrução bilateralmente (Figura 1).
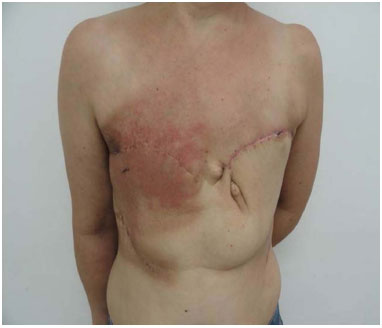
Figura 1. Toracoepigástrico bilateral.
Este estudo baseou-se em análise de prontuários médicos das pacientes. Foram pesquisados dados demográficos, comorbidades, tratamentos clínicos neoadjuvantes e cirúrgicos prévios, histologia, tamanho do tumor, dimensões e limites da lesão torácica e medidas do retalho utilizado para fechamento da parede torácica.
Os principais desfechos analisados foram: viabilidade vascular e eficácia do retalho, complicações pós-operatórias, considerando-se tempo cirúrgico, dias de internação e seguimento pós-cirúrgico.
O estudo foi aprovado pelo Comitê de Ética e Pesquisa do Centro de Referência da Saúde da Mulher do Hospital Pérola Byington, sob o número 32185614.0.0000.0069. Como estudo baseado em análise de prontuários médicos com pacientes mantidas sob anonimato, não foi necessário obter Termo de Consentimento Informado.
Técnica Cirúrgica
Sob anestesia geral após mastectomia radical estendida, com a paciente em decúbito dorsal horizontal, avaliam-se os limites do defeito torácico para marcação do retalho. A extensão anatômica das lesões (defeito) é medida após máxima aproximação da ferida para diferenciar o defeito aparente do defeito real. Seus limites para possibilitar a reconstrução com o retalho toracoepigástrico devem ser, conforme proposto por Davis et al.21: verticalmente, o sulco mamário e o segundo espaço intercostal. Horizontalmente, os limites do defeito foram estabelecidos, em nosso serviço, como sendo a linha axilar média e a linha médio esternal (Figura 2).
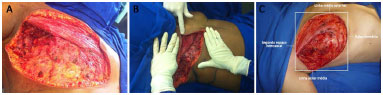
Figura 2. A: Lesão extensa após mastectomia radical. B: Medida da extensão da lesão após aproximação das bordas da ferida, na reconstrução torácica com retalho toracoepigástrico. C: Limites dos defeitos torácicos.
O retalho é desenhado transversalmente na região toracoabdominal ipsilateral à lesão torácica, paralelamente ao sulco mamário. A base do retalho fica posicionada medialmente, do apêndice xifoide até o ponto médio entre este e o umbigo. O limite lateral é a linha axilar posterior com a paciente deitada. A extremidade lateral do retalho deve ser arredondada para melhor aproveitamento da sobra de pele nessa região (Figura 3). Esse arredondamento distal associado à posição da paciente em decúbito dorsal, faz com que o limite lateral do retalho ultrapasse a linha axilar posterior com a paciente de pé.
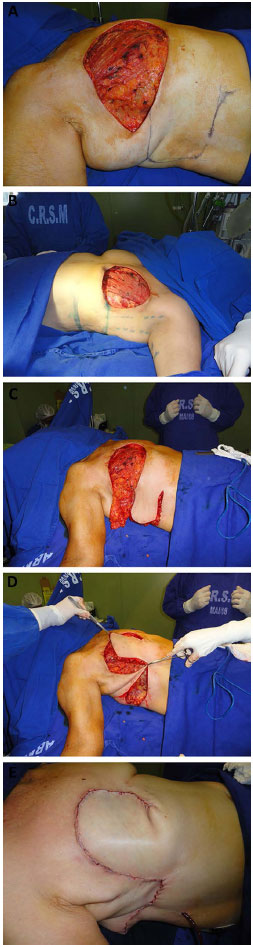
Figura 3. A: Marcação cutânea com o arredondamento da extremidade do retalho toracoepigástrico. B: Limite lateral na linha axilar posterior com a paciente deitada. C: Incisão inferior interrompida. D: Rotação do retalho após mudança do direcionamento da incisão inferior para região umbilical. E: Fechamento do tórax.
A margem superior do retalho é o sulco mamário e deve se estender medialmente até a borda lateral do músculo reto abdominal ipsilateral. A margem inferior do retalho será determinada por uma linha paralela à margem superior, posicionada conforme pinçamento bidigital da pele excedente da região toracoabdominal, com a paciente em posição semissentada de Fowler, definindo-se a largura do retalho.
A dissecção do retalho é realizada de sua porção lateral para medial com a paciente em posição semissentada de Fowler. A inclusão da fáscia profunda sob toda a extensão do retalho é essencial para a sua viabilidade. O limite medial do descolamento é a borda lateral do músculo reto abdominal ipsilateral, porém para aumentar a base vascular do retalho, evita-se chegar até a borda lateral do reto, desviando a incisão inferior do retalho ligeiramente em direção à região umbilical, próxima a porção medial do músculo oblíquo externo, bem antes de identificar a borda lateral do músculo reto abdominal (Figura 4). Essa tática vai ser usada conforme o tamanho do defeito, testando-se o fechamento da lesão torácica com a paciente na posição semissentada de Fowler. Quanto mais mediais as lesões, o descolamento deve chegar até a borda lateral do músculo reto abdominal, para promover um arco de rotação maior.
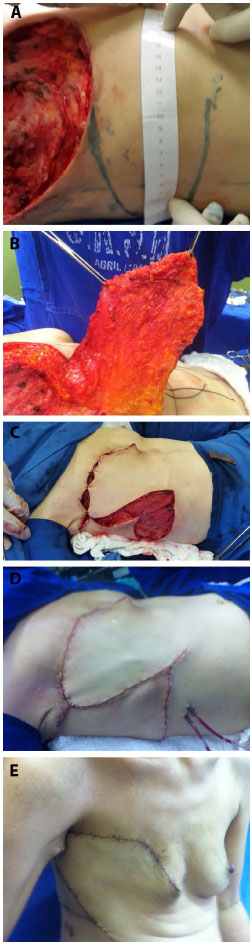
Figura 4. A: Marcação do retalho. B: Elevação do retalho. C: Rotação do retalho. D: Fechamento pós-operatório imediato. E: Pós-operatório tardio - visão lateral.
O ponto de rotação do retalho é definido pela incisão inferior, cujo limite medial também será a borda lateral do músculo reto abdominal ipsilateral. O retalho será mais ou menos descolado na dependência do tamanho da lesão torácica. O arco de rotação pode variar de 45 a 90 graus.
Para o fechamento da lesão da parede torácica, a paciente continua na posição semissentada de Fowler (Figura 5). O fechamento da área doadora é feito primariamente por meio do descolamento reverso do abdome. Drenos são utilizados na área receptora e doadora do retalho.
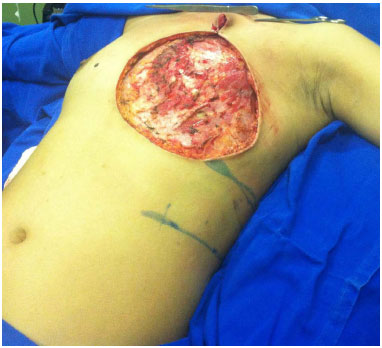
Figura 5. Posicionamento da paciente em mesa cirúrgica com elevação do tronco (posição de Fowler) para reconstrução torácica.
RESULTADOS
No período do estudo, 29 pacientes foram submetidas a mastectomias radicais, sendo que uma paciente foi submetida à reconstrução bilateralmente (30 retalhos). As pacientes foram operadas, seguindo o padrão oncológico, com as técnicas de Halsted em 12 (40%), Patey em 14 (46,6%) e Madden em quatro (13,4%) casos.
As pacientes tinham idade entre 26 e 85 anos. O período de seguimento pós-operatório variou entre 11 dias e 5 anos, a partir da data cirúrgica.
Sete pacientes (24%) não apresentavam comorbidades. Doze pacientes (41%) apresentavam uma única comorbidade e dez pacientes (35%) apresentavam duas ou mais comorbidades. As comorbidades estão descritas na Tabela 1.
O tipo de tumor mais prevalente foi o carcinoma ductal invasivo (93,4%). O carcinoma lobular invasivo representou 3,3% da casuística e o diagnóstico de carcinosarcoma (3,3%) foi encontrado em uma única paciente.
Das 29 pacientes estudadas, 26 (90%) tinham tumor de mama localmente avançado e três (10%) tumor de mama recidivado. Das 29 pacientes, 17 (59%) receberam o tratamento quimioterápico neoadjuvante. A radioterapia também fez parte do tratamento prévio, representando 10% da casuística (três pacientes) (Tabela 2).

O retalho toracoepigástrico foi usado no grupo de 29 pacientes, em que as lesões torácicas não fechavam primariamente. A medida dos defeitos torácicos variou de 20 x 15 cm a 13 x 9 cm (média 15,5 x 11,6 cm). Para o fechamento das lesões torácicas, o retalho toracoepigástrico foi utilizado com medida variando de 25 x 12 cm a 18 x 8 cm (média de 21,3 x 10,4 cm) (Tabela 3).
A média do tempo operatório total (mastectomia + reconstrução) foi de 3 horas e 52 minutos. A reconstrução da parede torácica teve em média 2 horas e 4 minutos de duração (Tabela 4). A média do tempo de internação foi de 3 dias (variando de 1 a 11 dias). Quatro pacientes (14%) necessitaram da unidade de terapia intensiva.

O retalho toracoepigástrico com marcação arredondada na sua extremidade, alargamento da base vascular e posicionamento semissentado (Fowler) da paciente durante a cirurgia mostrou-se eficiente para o fechamento dos defeitos pós-mastectomia nas 29 pacientes, não havendo necessidade do uso de outros retalhos ou enxertos cutâneos. A área doadora foi fechada adequadamente em todos os casos, por meio do descolamento reverso da parede abdominal. O dreno tubular foi usado em todo grupo, e sua permanência foi de sete a dez dias.
Todas as pacientes foram orientadas a manter a posição semissentada de Fowler para dormir e deambular encurvadas até o sétimo dia pós-operatório.
Na nossa casuística, apenas duas (7%) pacientes evoluíram com deiscência (Figura 6), que cicatrizaram sem necessidade de intervenção cirúrgica. Houve um caso de hematoma (3%) (Figura 7), que necessitou de drenagem cirúrgica, em uma paciente que apresentava pancitopenia (devido à metástase óssea). Esta paciente faleceu no 11º dia pós-operatório, e apesar das intercorrências o retalho manteve a viabilidade até a data do óbito. Após um mês, 28 (96,5%) das pacientes estavam aptas para o tratamento complementar.
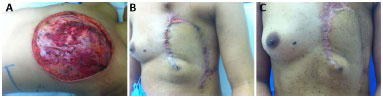
Figura 6. A: Aspecto intra-operatório da mastectomia radical extensa. B: Deiscência da ferida após reconstrução torácica. C: Resolução da deiscência sem necessidade do uso de outros retalhos ou enxertos cutâneos.
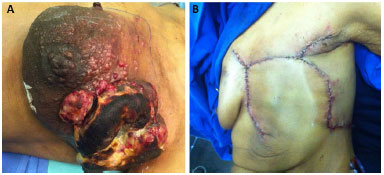
Figura 7. A: Pré-operatório do caso de hematoma. B: Retalho toracoepigástrico com viabilidade mantida apesar do hematoma.
Todas as pacientes retornaram para consulta cirúrgica um mês após a cirurgia, data em que a viabilidade do retalho foi verificada em todos os casos. Cinco pacientes (17,2%) perderam seguimento cirúrgico após um mês, porém permaneceram em atendimento no serviço com outras especialidades, não tendo sido relatados posteriormente nos prontuários complicações cirúrgicas.
O período de acompanhamento das pacientes foi de 5 anos. A doença de base pela sua gravidade foi responsável pela morte de 13 pacientes (44,8%) ao longo deste período.
DISCUSSÃO
O estágio localmente avançado do tumor primário, a qualidade do tecido adjacente à mama irradiada nas recidivas tumorais e as condições clínicas das pacientes são questões críticas para escolher o melhor método de reconstrução da parede torácica7,9,19,14. Retalhos fasciocutâneos representam uma boa opção para o tratamento dessas lesões7,19.
Relatos de série de casos utilizando o retalho fasciocutâneo transverso abdominal toracoepigástrico em reconstrução de tórax, limitam-se a um número de dois a 16 casos20,21,26,27. Estes relatos, apesar de descreverem bem a técnica, padrão vascular, limites anatômicos do retalho e das lesões torácicas fechadas por ele, não individualizam adequadamente suas complicações e o apresentam como um retalho delicado do ponto de vista vascular, por ter um segmento ao acaso ligado a sua porção axial. A linha axilar anterior define o final do padrão axial do retalho e, quanto mais ele se alonga em direção à linha axilar posterior, menos segura será a vascularização da sua extremidade, baseada apenas no plexo subdérmico. Essa extremidade deverá ter uma marcação mais estreita por conta disso21.
Davis et al.21, em quatro casos descritos, apesar de terem operado 16, realizaram retalho toracoepigástrico ultrapassando 5 cm da linha axilar posterior, com marcação estreita na extremidade distal para fechamento torácico, não relatando necrose nestes casos.
Woods et al.26 relatam dois casos do retalho toracoepigástrico com a área doadora enxertada entre os seus retalhos. Leinster e Webster27 informam 10 casos deste retalho junto com outros retalhos fasciocutâneos. Estes autores também ultrapassavam a linha axilar posterior e afilavam a extremidade dos seus retalhos. A análise das complicações do retalho toracoepigástrico nestes estudos não foram individualizadas, sendo incluídas no total das complicações de todos os retalhos fasciocutâneos realizados26,27.
Apesar da fragilidade vascular do retalho, nenhum dos autores descritos se preocupou em estabelecer manobras ou táticas cirúrgicas que minimizassem a taxa de perda da extremidade distal ao acaso do retalho toracoepigástrico, que é de 10%, segundo McCraw et al.25.
O presente estudo com 29 pacientes operadas, uma delas duas vezes, sendo que três tinham radioterapia prévia do local, é o primeiro relato com casuística superior a 16 casos que individualiza suas complicações. Nele propomos um novo formato para a extremidade distal ao acaso do retalho toracoepigástrico, que será arredondada, visando fechar defeitos mais largos na horizontal, aproveitando assim o tecido excedente da região lateral do tórax.
Prevendo a fragilidade vascular distal deste retalho, limitamos o seu descolamento em direção a borda lateral do músculo reto abdominal com a tática de posicionamento semissentado (Fowler) da paciente durante a cirurgia. Essa posição diminui a distância entre o retalho e o defeito, permitindo a cobertura de uma área até o segundo espaço intercostal com um retalho menor, de base cutânea vascular maior, tornando-se mais seguro.
A redução do comprimento da incisão inferior do retalho pode limitar o seu arco de rotação, que será prejudicial nos fechamentos de lesões mais altas e mediais e isso deve ser analisado no momento da elevação do retalho, testando-se o fechamento da lesão torácica com a paciente na posição semissentada de Fowler. Quando mais mediais as lesões, o descolamento deve chegar mais próximo à borda lateral do músculo reto abdominal, para promover um arco de rotação maior.
Visando ainda continuar mantendo a base mais alargada do retalho mesmo para fechamento de defeitos maiores (20 x 15 cm) da casuística, desviamos a incisão inferior do retalho ligeiramente em direção à região umbilical, próxima a porção medial do músculo oblíquo externo bem antes de identificar a borda lateral do músculo reto abdominal. Ao modificarmos o final da incisão inferior, conseguimos um arco de rotação cranial maior. Realizamos um retalho de 25 x 12 cm para fechar uma lesão torácica de 20 x 15 cm idêntica a maior descrita por Davis et al.21, que por descolar mais obteve um retalho de medida maior no comprimento com uma base menor (35 x 11 cm), expondo a paciente a mais riscos, apesar de não ter havido, segundo o autor, necrose neste caso.
Descolando menos o retalho, podemos arredondar com segurança a sua extremidade ao acaso (retalho redondo se encaixa melhor em um defeito circular) e com ajuda da posição semissentada de Fowler, fechar defeitos extensos sem risco de necrose distal, como demonstrado na análise de resultados deste estudo. De fato, não tivemos nenhum caso de necrose distal do retalho, embora tenhamos observado dois casos de deiscência em 30 retalhos, que resolveram-se sem cirurgia adicional.
Há que se avaliar, em estudos clínicos futuros, se um possível aumento no retalho poderia evitar a deiscência.
Observou-se que uma paciente da nossa casuística, devido ao aparecimento de tumor na mama contralateral, foi submetida a duas reconstruções com esse retalho em tempos diferentes, em função do retalho toracoepigástrico utilizar a circulação do reto abdominal ipsilateral à lesão torácica, liberando para futuros procedimentos, o aporte circulatório do músculo reto abdominal contralateral.
CONCLUSÃO
O retalho toracoepigástrico, com as modificações propostas neste estudo, evidenciou-se eficaz para cobertura de áreas extensas pós-mastectomias, sem a necessidade do uso de outros retalhos ou de enxerto cutâneo. O retalho também mostrou-se seguro, já que não houve qualquer necrose em nenhum dos casos, e os dois casos de deiscência resolveram-se sem cirurgia adicional.
REFERÊNCIAS
1. Buchanan CL, Dorn PL, Fey J, Giron G, Naik A, Mendez J, et al. Locoregional recurrence after mastectomy: incidence and outcomes. J Am Coll Surg. 2006;203(4):469-74. PMID: 17000389 DOI: http://dx.doi.org/10.1016/j.jamcollsurg.2006.06.015
2. Kuerer HM, Singletary SE, Buzdar AU, Ames FC, Valero V, Buchholz TA, et al. Surgical conservation planning after neoadjuvant chemotherapy for stage II and operable stage III breast carcinoma. Am J Surg. 2001;182(6):601-8. PMID: 11839324 DOI: http://dx.doi.org/10.1016/S0002-9610(01)00793-0
3. Amadori D, Pacini P, Giunchi DC, Maltoni R. Quadro clínico e tratamento do carcinoma de mama localmente avançado e do carcinoma inflamatório. In: Veronesi U. Mastologia oncológica. Rio de Janeiro: Medsi; 2002. p.449-63.
4. Julka PK, Prasad R, Mohanti BK, Shukla NK, Raina V, Lal P, et al. Cancer of the breast. In: Rath GK, Mohanti BK, eds. Textbook of radiation oncology, principles ans practice. New Delhi: Churchill Livingstone; 2000. p.239-83.
5. Rocha FBC, Formigoni MC, Lima BSS, Filassi JR, Baracat ER. Avaliação da incidência do câncer de mama localmente avançado no Instituto do Câncer do Estado de Sao Paulo. Revista Latinoamericana de Mastología. 2012;6(2) [acesso 2 Mar 2016]. Disponível em: http://www.flamastologia.org/rlamastologia/index.php/journal/article/view/27
6. Friedel G, Kuipers T, Dippon J, Al-Kammash F, Walles T, Kyriss T, et al. Full-thickness resection with myocutaneous flap reconstruction for locally recurrent breast cancer. Ann Thorac Surg. 2008;85(6):1894-900. PMID: 18498790 DOI: http://dx.doi.org/10.1016/j.athoracsur.2008.02.012
7. Martella S, Caliskan M, Brenelli FP, Rossetto F, Aparecida De Oliveira H, De Brito Lima LN, et al. Surgical closure of chest wall in noninflammatory locally advanced breast carcinoma with ulceration of the skin. Breast J. 2008;14(4):345-52. DOI: http://dx.doi.org/10.1111/j.1524-4741.2008.00596.x
8. Chin PL, Andersen JS, Somlo G, Chu DZ, Schwarz RE, Ellenhorn JD. Esthetic reconstruction after mastectomy for inflammatory breast cancer: is it worthwhile? J Am Coll Surg. 2000;190(3):304-9. PMID: 10703855
9. Losken A, Thourani VH, Carlson GW, Jones GE, Culbertson JH, Miller JI, et al. A reconstructive algorithm for plastic surgery following extensive chest wall resection. Br J Plast Surg. 2004;57(4):295-302. PMID: 15145731 DOI: http://dx.doi.org/10.1016/j.bjps.2004.02.004
10. Chang RR, Mehrara BJ, Hu QY, Disa JJ, Cordeiro PG. Reconstruction of complex oncologic chest wall defects: a 10-year experience. Ann Plast Surg. 2004;52(5):471-9. DOI: http://dx.doi.org/10.1097/01.sap.0000122653.09641.f8
11. Micali E, Carramaschi FR. Extended V-Y latissimus dorsi musculocutaneous flap for anterior chest wall reconstruction. Plast Reconstr Surg. 2001;107(6):1382-90. DOI: http://dx.doi.org/10.1097/00006534-200105000-00010
12. Deo SV, Nootan KS, Niranjan B, Dinesh K. Vertical rectus abdominis myocutaneous flap cover for lower abdomen, chest wall, groin and thigh defects following resection of malignant tumours. Indian J Cancer. 2001;38(1):33-7. PMID: 14758883
13. Howard MA, Polo K, Pusic AL, Cordeiro PG, Hidalgo DA, Mehrara B, et al. Breast cancer local recurrence after mastectomy and TRAM flap reconstruction: incidence and treatment options. Plast Reconstr Surg. 2006;117(5):1381-6. PMID: 16641702 DOI: http://dx.doi.org/10.1097/01.prs.0000208116.86765.4a
14. Baroudi R, Pinotti JA, Keppke EM. A transverse thoracoabdominal skin flap for closure after radical mastectomy. Plast Reconstr Surg. 1978;61(4):547-54. PMID: 345306 DOI: http://dx.doi.org/10.1097/00006534-197804000-00008
15. Tolhurst DE, Haeseker B, Zeeman RJ. The development of the fasciocutaneous flap and its clinical applications. Plast Reconstr Surg. 1983;71(5):597-606. PMID: 6836058 DOI: http://dx.doi.org/10.1097/00006534-198305000-00001
16. Cormack GC, Lamberty BG. A classification of fascio-cutaneous flaps according to their patterns of vascularisation. Br J Plast Surg. 1984;37(1):80-7. PMID: 6692066 DOI: http://dx.doi.org/10.1016/0007-1226(84)90049-3
17. Boyd JB, Taylor GI, Corlett R. The vascular territories of the superior epigastric and deep inferior epigastric systems. Plast Reconstr Surg. 1984;73(1):1-16. PMID: 6197716 DOI: http://dx.doi.org/10.1097/00006534-198401000-00001
18. Taylor GI. The angiosomes of the body and their supply to perforator flaps. Clin Plast Surg. 2003;30(3):331-42. DOI: http://dx.doi.org/10.1016/S0094-1298(03)00034-8
19. Deo SV, Purkayastha J, Shukla NK, Asthana S. Myocutaneous versus thoraco-abdominal flap cover for soft tissue defects following surgery for locally advanced and recurrent breast cancer. J Surg Oncol. 2003;83(1):31-5. PMID: 12722094 DOI: http://dx.doi.org/10.1002/jso.10236
20. Tai Y, Hasegawa H. A transverse abdominal flap for reconstruction after radical operations for recurrent breast cancer. Plast Reconstr Surg. 1974;53(1):52-4. PMID: 4272132 DOI: http://dx.doi.org/10.1097/00006534-197401000-00009
21. Davis WM, McCraw JB, Carraway JH. Use of a direct, transverse, thoracoabdominal flap to close difficult wounds of the thorax and upper extremity. Plast Reconstr Surg. 1977;60(4):526-33. PMID: 333484 DOI: http://dx.doi.org/10.1097/00006534-197710000-00005
22. Brown RG, Vasconez LO, Jurkiewicz MJ. A transverse abdominal flap and deep epigastric arcade. Plast Reconstr Surg. 1975;55(4):416-21. PMID: 123346
23. Bohmert H. Experience in breast reconstruction with thoraco-epigastric and advancement flaps. Acta Chir Belg. 1980;79(2):105-10. PMID: 7435090
24. Mathes SJ, Nahai F. Thoraco epigastric (Transverse Abdominal) Flap. In: Mathes SJ, Nahai F. Reconstructive surgery: principles, anatomy and technique. New York: Churchill Livingstone; 1997. p.1107-16. DOI: http://dx.doi.org/10.1055/s-2008-1080278
25. McCraw JB, Bostwick J 3rd, Horton CE. Methods of soft tissue coverage for the mastectomy defect. Clin Plast Surg. 1979;6(1):57-69.
26. Woods JE, Arnold PG, Masson JK, Irons GB, Payne WS. Management of radiation necrosis and advanced cancer of the chest wall in patients with breast malignancy. Plast Reconstr Surg. 1979;63(2):235-41. PMID: 419201 DOI: http://dx.doi.org/10.1097/00006534-197902000-00013
27. Leinster SJ, Webster JT. Thoraco-abdominal and thoracoepigastric flaps: alternatives to skin grafting after mastectomy. Clin Oncol. 1982;8(2):145-8.
1. Centro de Referência da Saúde da Mulher, Hospital Pérola Byington, São Paulo, SP, Brasil
2. Sociedade Brasileira de Cirurgia Plástica, São Paulo, SP, Brasil
Instituição: Centro de Referência da Saúde da Mulher - Hospital Pérola Byington.
Autor correspondente:
Ana Claudia Benjamim Burattini
Av. Brigadeiro Luís Antônio, 683 - Bela Vista
São Paulo, SP, Brasil CEP 01317-000
E-mail: acburattini@uol.com.br
Artigo submetido: 6/8/2014.
Artigo aceito: 29/2/2016.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter