

Original Article - Year 2015 - Volume 30 -
Protocolo de aplicação bilateral de toxina botulínica tipo A para evitar assimetria no tratamento de espasmo hemifacial
Protocol for bilateral application of botulinum toxin type A to avoid asymmetry during treatment of hemifacial spasms
RESUMO
INTRODUÇÃO: O espasmo hemifacial (EHF) caracteriza-se por movimento tônico-clônico involuntário da musculatura de uma hemiface. O tratamento tem sido realizado com aplicação de toxina botulínica (TxB). A aplicação unilateral classicamente descrita resulta em assimetria semelhante à paralisia facial. O objetivo desse trabalho foi normatizar o tratamento do EHF bilateralmente com TxB, a fim de prevenir a ocorrência de assimetria facial iatrogênica.
MÉTODO: Foram analisadas 66 aplicações em 15 pacientes, seguindo o protocolo do serviço para paralisia facial, acrescentado de pontos pré-tarsais no lado com EHF. Foi feita dose complementar na reavaliação após 15 dias nos pacientes que apresentavam algum grau residual de espasmo ou assimetria, buscando-se a dose necessária para alcançar controle satisfatório do espasmo sem causar assimetria facial.
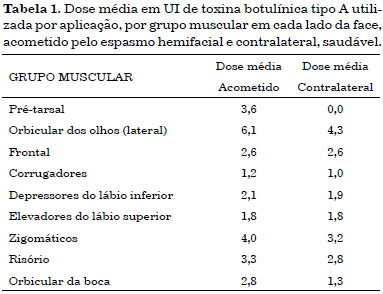
RESULTADOS: A dose média total foi 20,2 U do lado não acometido e 28,4 U do lado acometido, totalizando 48,6 U por aplicação. Houve diferença significante entre as hemifaces na dose para os músculos zigomático, orbicular da boca e orbicular dos olhos.
CONCLUSÕES: A técnica proposta de aplicação bilateral de TxB controlou adequadamente o EHF e evitou assimetria iatrogênica. Como regra geral, a aplicação deve ser feita na proporção de 1:1,5 U no orbicular dos olhos (porção lateral) e 1:2 U no orbicular da boca. Nos demais músculos, a dose nos dois lados deve ser a mesma, realizando-se dose de reforço em 15 dias caso permaneça algum grau de espasmo. O único local com pontos exclusivos do lado acometido é a região pré-tarsal do músculo orbicular do olho.
Palavras-chave: Toxina botulínica Tipo A; Paralisia facial; Assimetria facial/terapia; Espasmo hemifacial.
ABSTRACT
INTRODUCTION: Hemifacial spasm (HFS) is characterized by the involuntary tonic-clonic movement of the muscles of the hemiface. It is usually treated with botulinum toxin (BTX). The classically described unilateral application of BTX results in an asymmetry similar to facial paralysis. The aim of this study was to standardize the treatment of HFS by applying BTX bilaterally to prevent the occurrence of iatrogenic facial asymmetry.
METHODS: The outcomes of 66 applications in 15 patients were analyzed according to the protocol of the facial paralysis service, to which pretarsal sites were added on the HFS side. On reassessment 15 days later, a complementary dose was administered to patients who exhibited some residual degree of spasm or asymmetry with the aim of determining the dose required to achieve satisfactory spasm control without causing facial asymmetry.
RESULTS: The total mean dose was 20.2 U at the contralateral side and 28.4 U at the spasm side (a total dose of 48.6 U per application). There was a significant difference between the doses applied to the zygomaticus, orbicularis oris, and orbicular oculi muscles on each hemiface.
CONCLUSIONS: The proposed bilateral BTX application technique was effective in controlling HFS and prevented iatrogenic asymmetry. In general, application should be performed at a ratio of 1:1.5 U in the orbicularis oculi (lateral portion) and 1:2 U in the orbicularis oris. In the remaining muscles, the same dose should be administered on both sides and an additional dose can be applied 15 days later if some degree of spasm is present. The pretarsal region of the orbicularis oculi muscle is the only area for which BTX application on the healthy side is unnecessary.
Keywords: Botulinum toxin type A; Facial paralysis; Facial asymmetry/therapy; Hemifacial spasm
O espasmo hemifacial (EHF) é uma desordem caracterizada por movimento tônico-clônico involuntário da musculatura de uma hemiface, nos músculos da mímica inervados pelo nervo facial ipsilateral. O EHF pode ser primário ou secundário. O primeiro sem etiologia evidentemente identificada. Já o secundário pode ter como causa trauma, infecção ou ainda síndrome pós-paralisia facial1,2.
O tratamento por via oral do EHF com o uso de drogas (por exemplo: carbamazepina, gabapentina) não demonstrou resultados satisfatórios a longo prazo, assim como as cirurgias extracranianas (rizotomia, miotomia, anastomoses neurais), ou as cirurgias intracranianas, como a descompressão microvascular do nervo facial1. Atualmente, a primeira escolha terapêutica tem sido a aplicação de toxina botulínica tipo A diretamente nos músculos faciais3,4.
Desde 1985, quando Elston5 tratou pela primeira vez espasmo hemifacial com toxina botulínica, este tem sido consistentemente demonstrado como tratamento eficaz. Trabalhos demonstram sucesso de tratamento em 76-100% dos pacientes6-8.
Os trabalhos na literatura posteriormente se dividiram. Por um lado, aqueles baseados predominantemente em casos de blefaroespasmo e assimetria de terço superior, nos quais a aplicação unilateral da toxina foi o padrão utilizado9-12. Porém, quando a aplicação unilateral era estendida para terço inferior, produzia fraqueza exacerbada dos músculos da hemiface tratada, culminando em assimetria na dinâmica facial. Então, a partir de 1991, Borodic et al.13 iniciaram estudos aplicando doses bilaterais da toxina, tanto em terço superior quanto nos 2/3 inferiores da face, no intuito de amenizar a assimetria facial. Foi destacado pelo autor a complicação comum de assimetria facial unilateral iatrogênica quando aplicada toxina somente em uma hemiface, observada principalmente quando do tratamento dos terços médio e inferior da face.
Esta assimetria confere ao paciente aparência de sequela de paralisia facial, com desvio do sorriso para o lado não acometido, não tratado com toxina botulínica, causando grande desconforto social. Neste ponto de evolução acerca do tratamento do EHF com toxina botulínica tipo A5,10,14-19 surge a discussão se haveria padronização nos pontos de aplicação de toxina botulínica bilateralmente, desde a primeira aplicação9,18,20, com o objetivo de controlar o espasmo por meio da aplicação no lado acometido, e evitando assimetria iatrogênica, por meio da aplicação no lado contralateral.
OBJETIVO
O objetivo desse trabalho foi normatizar o tratamento do EHF desde a primeira aplicação já bilateralmente com a toxina botulínica tipo A, em pontos musculares da face padronizados, a fim de prevenir a ocorrência de assimetria facial iatrogênica.
MÉTODO
O estudo foi prospectivo a partir de seu planejamento, com início em maio de 2005 até termino da coleta de dados em junho de 2012, aprovado pelo Comitê de Ética da Instituição (nº 393/09). Os pacientes foram tratados no Grupo de Cirurgia Plástica Estética da Faculdade de Medicina da Universidade de São Paulo. A literatura foi revisada com a utilização dos descritores: toxina botulínica tipo A, paralisia facial, assimetria facial/terapia e espasmo facial na base de dados Pubmed.com, da US National Library of Medicine National Institute of Health.
Foram analisadas 66 aplicações de toxina botulínica em 15 pacientes tratados com intervalos de 5 a 7 meses entre as aplicações. Todos os pacientes assinaram Termo de Consentimento Esclarecido. Cada paciente era interrogado e investigado sobre a etiologia do EHF. Dentre os pacientes incluídos, a idade média etária foi de 63,2 anos, com 78,5% dos pacientes do sexo feminino e 21,5% do sexo masculino. O lado esquerdo foi acometido em 60% dos casos.
Todos os pacientes participantes no estudo foram submetidos a aplicação de toxina botulínica tipo A (Botox®; Allergan, Inc., Irvine, California, USA). Os pontos de aplicação seguiram o protocolo do serviço para paralisia facial, padronizados nos trabalhos de Salles21 e Salles et al.22, sendo acrescentados pontos de 0,5 ou 1 unidade pré-tarsais no lado com EHF para controle do espasmo do músculo orbicular dos olhos (Figura 1).
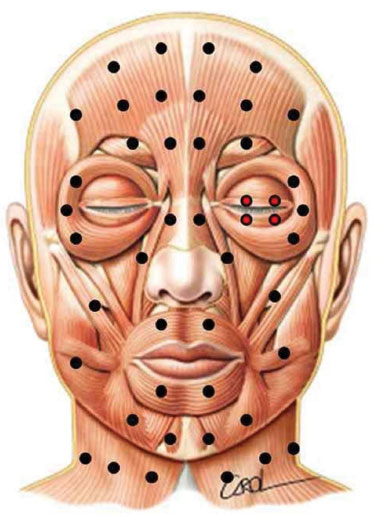
Figura 1. Pontos padronizados de aplicação de toxina botulínica para o tratamento do espasmo hemifacial evitando assimetria iatrogênica. Pontos diferenciais do protocolo original do qual foram retirados são os pré-tarsais, em vermelho.
Foram realizados pontos em todos os músculos nos quais se observou espasmo, com dose de 1 a 2 U, demarcando-se ponto simétrico contralateral nos músculos potencialmente causadores de assimetria em terço superior, médio e inferior da face.
Os músculos analisados quanto à aplicação da toxina foram: frontal (2-5 pontos), corrugador/prócero (1-3 pontos), orbicular do olho porção lateral (2-3 pontos), pré-tarsal (2-4 pontos), músculo nasal (1 ponto), elevadores do lábio superior (1 ponto), zigomáticos (1-3 pontos), risório (1-2 pontos), depressores do lábio inferior e do ângulo da boca (1-3 pontos), mentoniano (1-2 pontos) e orbicular da boca (1-2 pontos). Foi excluído desta análise o músculo platisma.
Todos os pacientes foram avaliados de maneira objetiva por meio de fotos padronizadas de frente, perfil e ¾, em repouso, sorrindo, contraindo o corrugador e o músculo nasal, fazendo protrusão labial ("bico") e depressão do lábio inferior, assim como filmados estática e dinamicamente movimentando os músculos da mímica. Foram avaliados de forma subjetiva também no início do tratamento e após cada aplicação com grau de satisfação e simetria avaliada sempre pela mesma profissional. A cada retorno, 15 dias após a aplicação, os pacientes eram fotografados para comparar os efeitos do tratamento ao longo do tempo e reavaliados pela primeira autora.
Somente foi feita dose complementar na reavaliação após 15 dias da aplicação de toxina botulínica tipo A nos pacientes que apresentavam qualquer grau residual de espasmo hemifacial ou assimetria estática ou dinâmica, reavaliando-se novamente o paciente após outros 15 dias para análise dos efeitos colaterais e resultado. Considerou-se como dose total a quantidade da dose necessária para alcançar controle satisfatório do espasmo sem causar assimetria facial.
RESULTADOS
A média do número de aplicações foi de 4,7 por paciente (variação de 4 a 16 aplicações) durante estes 6 anos de estudo. O intervalo entre as aplicações foi de 5 a 7 meses.
A causa do espasmo foi idiopática em 13 casos (86,6%), um caso pós-trauma e um caso pós-acidente vascular encefálico.
A dose média em UI de toxina botulínica tipo A utilizada por aplicação, por grupo muscular em cada lado da face estão discriminadas na Tabela 1.
A dose média total de toxina botulínica por aplicação foi 20,2 U do lado não acometido e 28,4 U do lado acometido, totalizando 48,6 U por aplicação em média considerando toda a face. A Figura 2 apresenta um exemplo de resultado da aplicação, estático e dinâmico, observando-se no lado com EHF os pontos pré-tarsais.
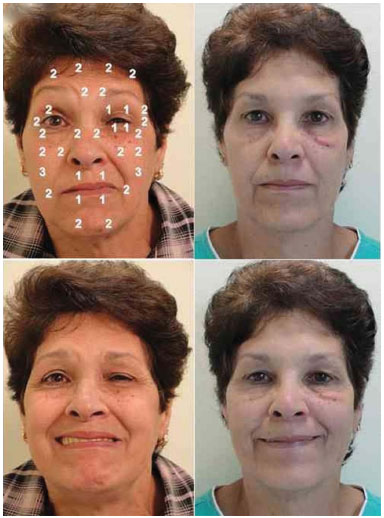
Figura 2. Paciente de 58 anos com espasmo hemifacial do lado esquerdo há 9 anos, pré e pós aplicação de toxina botulínica, demonstrando os pontos de aplicação e dose utilizada em cada ponto, em repouso (fotos superiores) e sorrindo (fotos inferiores). Notar após aplicação, em repouso, relaxamento do orbicular dos olhos e suavização do sulco nasogeniano esquerdo, além da melhor qualidade do sorriso após o tratamento.
As complicações observadas foram: piora leve da dicção (50%) e dificuldade leve para ingerir líquido (35,7%), olhos secos (14,2%), ectrópio discreto (6%), com duração máxima de 18 dias. Todos os pacientes consideraram a aplicação satisfatória, tanto em relação ao controle do espasmo quanto à simetria facial.
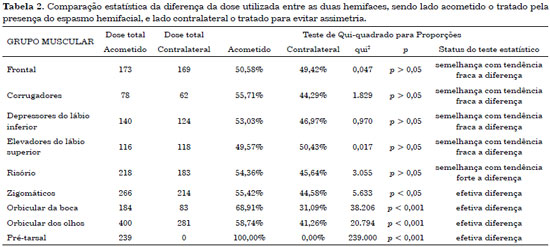
A Tabela 2 mostra a comparação estatística da diferença entre os lados. Os grupos musculares onde p > 0,05 não apresentaram diferença estatística, portanto a dose foi a mesma do lado acometido e do lado são.
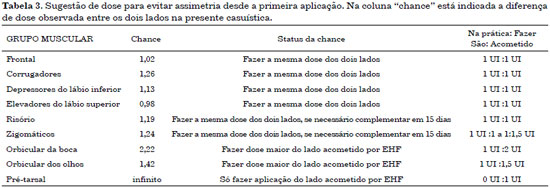
Na Tabela 3 observa-se o protocolo sugerido, baseado no estudo estatístico das doses utilizadas nesta casuística que foram necessárias para obter tratamento do espasmo sem causar assimetria iatrogênica.
DISCUSSÃO
A utilização da toxina botulínica no tratamento de diversas afecções já é consenso na literatura, com resultados satisfatórios5,9-12,14-19,21-27. A toxina é endocitada pelo neurônio pré-sináptico inibindo a liberação de acetilcolina na junção neuromuscular, levando à paralisia completa ou incompleta e temporária dos músculos da região injetada16,28.
Desde 1985, quando Elston5 tratou pela primeira vez espasmo hemifacial com toxina botulínica tipo A, trabalhos demonstram controle do espasmo facial variando de 76-100%6-8.
Porém, em relação ao método de aplicação, a literatura disponível atualmente apresenta casuísticas muito díspares envolvendo desde trabalhos com 6 casos13 até estudos mais extensos com 332 casos9. Outra questão envolve a região estudada, a maioria dos estudos contempla apenas o terço superior da face.
Observa-se ainda o uso unilateral da aplicação da toxina, utilizada pela maioria dos autores9-11,14,27, à exceção de Borodic et al.13 e Colakoglu et al.29, ambos com número reduzido de pacientes. Ou seja, não encontramos na literatura protocolo padronizando a aplicação bilateral de toxina botulínica em pacientes com espasmo hemifacial. Este estudo, portanto, é inédito, com análise de 66 aplicações bilaterais, incluindo tanto músculos dos terços superior, médio e inferior da face.
Em relação a complicações na literatura, a paralisia do músculo orbicular da boca com dificuldade de continência oral foi observada em 38,8% dos casos25, olhos secos em 19,8%10, ptose palpebral variando de 10,9% a 52,7%9,10,14,24,27, diplopia variando de 2% a 27,7%9,10,12,14,27. As complicações encontradas em nosso estudo foram semelhantes às descritas anteriormente, com ocorrência em proporções próximas: piora leve da dicção (50%), dificuldade leve para ingerir líquidos (35,7%), olhos secos (14,2%) e ectrópio discreto (6%), com duração máxima 18 dias.
O custo médio anual da medicação para o tratamento foi de 804,13 reais por paciente (considerando 8 reais a unidade), o que está abaixo do custo e acima em efetividade de tratamento em relação aos procedimentos cirúrgicos anteriormente realizados, como as rizotomias, miotomias e descompressões de nervo facial.
A dose média necessária para controle completo do espasmo hemifacial teve tendência a ir decaindo ao longo do tempo. O intervalo entre as aplicações para controle dos sintomas teve tendência a ir aumentando. Estas impressões subjetivas necessitam de confirmação posterior em número maior de pacientes ao longo do tempo.
O estudo realizado pelo nosso grupo observou que a região pré-tarsal deve ser tratada sempre apenas do lado acometido pelo espasmo. Houve diferença estatística nas doses necessárias para controle do espasmo sem causar assimetria iatrogênica em 3 grupos musculares: a dose para os músculos zigomáticos foi estabelecida em 1,24 vezes a dose do lado não acometido, nos músculos orbiculares da boca a dose necessária foi 2,22 vezes maior e nos músculos orbiculares do olho, 1,42 vezes.
Os outros grupos musculares estudados, frontal, corrugadores, depressor do lábio inferior, elevador do lábio e risório apresentaram também diferença nas doses, com tendência a necessidade maior no lado acometido pelo espasmo, porém, esta diferença não foi estatisticamente significativa (p > 0,05).
O médico deve iniciar a injeção determinando a dose necessária no lado com espasmo, em cada músculo apresentando distonia, utilizando pontos de 0,5 a 2 U. No lado contralateral, os pontos são demarcados conforme o ajuste de doses sugerido na Tabela 3. Após 15 dias, é permitido realizar dose complementar caso haja espasmo residual ou assimetria.
CONCLUSÃO
A técnica proposta de aplicação bilateral de toxina botulínica controlou adequadamente o espasmo hemifacial e evitou assimetria iatrogênica dos músculos da face, complicação observada em casos que utilizam a aplicação unilateral visando unicamente o tratamento da distonia.
A dose aplicada em cada lado da face mostrou diferença com significância estatística para os músculos zigomático, orbicular da boca e orbicular dos olhos. Cada caso deve ser analisado particularmente, mas como regra geral a aplicação deve ser feita na proporção de 1:1,5 U no músculo orbicular dos olhos (porção lateral), e 1:2 U no músculo orbicular da boca. Nos demais músculos (frontal, corrugador, depressor do lábio inferior, elevador do lábio e risório) a dose aplicada é a mesma dos dois lados. Os músculos zigomáticos podem receber dose semelhante, realizando-se retoque em 15 dias caso permaneça algum grau de espasmo, com a opção de já realizar dose assimétrica 1:1,5 U caso o espasmo seja muito intenso nesta área. O único local com pontos exclusivos do lado acometido, ou seja, não é necessário aplicar toxina botulínica no lado saudável, é a região pré-tarsal do músculo orbicular do olho.
Houve baixa incidência de complicações, que foram leves e autolimitadas. A dose média de 48,6 U por sessão apresenta custo aplicável, considerando que o custo médio anual da medicação para o tratamento de 1 paciente foi de 804,13 reais.
REFERÊNCIAS
1. Wilkins RH. Hemifacial spasm: a review. Surg Neurol. 1991;36(4):251-77. PMID: 1948626 DOI: http://dx.doi.org/10.1016/0090-3019(91)90087-P
2. Tan NC, Chan LL, Tan EK. Hemifacial spasm and involuntary facial movements. QJM. 2002;95(8):493-500. PMID: 12145388 DOI:http://dx.doi.org/10.1093/qjmed/95.8.493
3. Holds JB, Alderson K, Fogg SG, Anderson RL. Motor nerve sprouting in human orbicularis muscle after botulinum A injection. Invest Ophthalmol Vis Sci. 1990;31(5):964-7.
4. Horn AK, Porter JD, Evinger C. Botulinum toxin paralysis of the orbicularis oculi muscle. Types and time course of alterations in muscle structure, physiology and lid kinematics. Exp Brain Res. 1993;96(1):39-53. DOI: http://dx.doi.org/10.1007/BF00230437
5. Elston SJ. Botulinum toxin treatment of hemifacial spasm. J Neurol Neurosurg Psychiatry. 1986;49(7):827-9. DOI:http://dx.doi.org/10.1136/jnnp.49.7.827
6. Flanders M, Chin D, Boghen D. Botulinum toxin: preferred treatment for hemifacial spasm. Eur Neurol. 1993;33(4):316-9. PMID:8348919 DOI: http://dx.doi.org/10.1159/000116961
7. Bentivoglio AR, Fasano A, Ialongo T, Soleti F, Lo Fermo S, Albanese A. Outcome predictors, efficacy and safety of Botox and Dysport in the long-term treatment of hemifacial spasm. Eur J Neurol. 2009;16(3):392-8. DOI: http://dx.doi.org/10.1111/j.1468-1331.2008.02507.x
8. Kollewe K, Mohammadi B, Dengler R, Dressler D. Hemifacial spasm and reinnervation synkinesias: long-term treatment with either Botox or Dysport. J Neural Transm. 2010;117(6):759-63. PMID:20437061 DOI: http://dx.doi.org/10.1007/s00702-010-0409-4
9. Ortisi E, Henderson HW, Bunce C, Xing W, Collin JR. Blepharospasm and hemifacial spasm: a protocol for titration of botulinum toxin dose to the individual patient and for the management of refractory cases. Eye (Lond). 2006;20(8):916-22. DOI:http://dx.doi.org/10.1038/sj.eye.6702054
10. Park YC, Lim JK, Lee DK, Yi SD. Botulinum a toxin treatment of hemifacial spasm and blepharospasm. J Korean Med Sci. 1993;8(5):334-40. DOI: http://dx.doi.org/10.3346/jkms.1993.8.5.334
11. Clark RP, Berris CE. Botulinum toxin: a treatment for facial asymmetry caused by facial nerve paralysis. Plast Reconstr Surg. 1989;84(2):353-5. PMID: 2748749 DOI:http://dx.doi.org/10.1097/00006534-198908000-00027
12. Oyama H, Ikeda A, Inoue S, Nakashima Y, Shibuya M. Local injection of botulinum toxin type A for hemifacial spasm. Neurol Med Chir (Tokyo). 2002;42(6):245-8. DOI:http://dx.doi.org/10.2176/nmc.42.245
13. Borodic GE, Cheney M, McKenna M. Contralateral injections of botulinum A toxin for the treatment of hemifacial spasm to achieve increased facial symmetry. Plast Reconstr Surg. 1992;90(6):972-7. DOI: http://dx.doi.org/10.1097/00006534-199212000-00004
14. Defazio G, Abbruzzese G, Girlanda P, Vacca L, Currà A, De Salvia R, et al. Botulinum toxin A treatment for primary hemifacial spasm: a 10-year multicenter study. Arch Neurol. 2002;59(3):418-20. PMID:11890846 DOI: http://dx.doi.org/10.1001/archneur.59.3.418
15. Nigam PK, Nigam A. Botulinum toxin. Indian J Dermatol. 2010;55(1):8-14. PMID: 20418969 DOI: http://dx.doi.org/10.4103/0019-5154.60343
16. Dhaked RK, Singh MK, Singh P, Gupta P. Botulinum toxin: bioweapon & magic drug. Indian J Med Res. 2010;132:489-503. PMID:21149997
17. Kenney C, Jankovic J. Botulinum toxin in the treatment of blepharospasm and hemifacial spasm. J Neural Transm. 2008;115(4):585-91. PMID: 17558461 DOI:http://dx.doi.org/10.1007/s00702-007-0768-7
18. Frei K, Truong DD, Dressler D. Botulinum toxin therapy of hemifacial spasm: comparing different therapeutic preparations. Eur J Neurol. 2006;13 Suppl 1:30-5. DOI: http://dx.doi.org/10.1111/j.1468-1331.2006.01442.x
19. Singer C, Papapetropoulos S, Farronay O. Childhood-onset hemifacial spasm: successful treatment with botulinum toxin. Pediatr Neurol. 2005;33(3):220-2. PMID: 16139741 DOI:http://dx.doi.org/10.1016/j.pediatrneurol.2005.03.008
20. Eleopra R, Tugnoli V, Caniatti L, De Grandis D. Botulinum toxin treatment in the facial muscles of humans: evidence of an action in untreated near muscles by peripheral local diffusion. Neurology. 1996;46(4):1158-60. DOI: http://dx.doi.org/10.1212/WNL.46.4.1158
21. Salles AG. Avaliação do efeito da toxina botulínica no lado são em pacientes com paralisia facial de longa duração. [Tese de doutorado]. São Paulo: Universidade de São Paulo, Faculdade de Medicina, 2006. 94p.
22. Salles AG, Toledo PN, Ferreira MC. Botulinum toxin injection in long-standing facial paralysis patients: improvement of facial symmetry observed up to 6 months. Aesthetic Plast Surg. 2009;33(4):582-90. PMID: 19330369 DOI:http://dx.doi.org/10.1007/s00266-009-9337-9
23. Yang SS, Seet RC, Lim EC. Action-induced hemifacial spasm and its resolution with botulinum toxin. Mov Disord. 2009;24(1):147-8. DOI:http://dx.doi.org/10.1002/mds.22338
24. Barbosa ER, Takada LT, Gonçalves LR, Costa RM, Silveira-Moriyama L, Chien HF. Botulinum toxin type A in the treatment of hemifacial spasm: an 11-year experience. Arq Neuropsiquiatr. 2010;68(4):502-5. PMID: 20730300 DOI:http://dx.doi.org/10.1590/S0004-282X2010000400006
25. Wabbels B, Roggenkämper P. Botulinum toxin in hemifacial spasm: the challenge to assess the effect of treatment. J Neural Transm. 2012;119(8):963-80. PMID: 22231846 DOI:http://dx.doi.org/10.1007/s00702-011-0762-y
26. Rudzińska M, Wójcik M, Szczudlik A. Hemifacial spasm non-motor and motor-related symptoms and their response to botulinum toxin therapy. J Neural Transm. 2010;117(6):765-72. DOI:http://dx.doi.org/10.1007/s00702-010-0416-5
27. Vogt T, Lüssi F, Paul A, Urban P. Long-term therapy of focal dystonia and facial hemispasm with botulinum toxin A. Nervenarzt. 2008;79(8):912-7. PMID: 18551268 DOI:http://dx.doi.org/10.1007/s00115-008-2486-2
28. Meunier FA, Lisk G, Sesardic D, Dolly JO. Dynamics of motor nerve terminal remodeling unveiled using SNARE-cleaving botulinum toxins: the extent and duration are dictated by the sites of SNAP-25 truncation. Mol Cell Neurosci. 2003;22(4):454-66. DOI:http://dx.doi.org/10.1016/S1044-7431(02)00016-7
29. Colakoglu BD, Cakmur R, Uzunel F. Is it always necessary to apply botulinum toxin into the lower facial muscles in hemifacial spasm?: a randomized, single-blind, crossover trial. Eur Neurol. 2011;65(5):286-90. DOI: http://dx.doi.org/10.1159/000327534
Universidade de São Paulo, São Paulo, SP, Brasil
Instituição: Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brasil.
Autor correspondente:
Alessandra Grassi Salles
Rua Joaquim Floriano, 466, cj. 2102
São Paulo, SP, Brasil CEP 04534-002
E-mail: agsalles@uol.com.br
Artigo submetido: 20/7/2014.
Artigo aceito: 21/4/2015.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter