

Original Article - Year 2015 - Volume 30 -
Reconstrução mamária em dois estágios com expansores de tecido e implantes de silicone
Breast reconstruction in two stages with tissue expanders and silicone breast implants
RESUMO
INTRODUÇÃO: A reconstrução mamária imediata com expansor/implante permanece uma opção importante para mulheres submetidas à mastectomia. O objetivo desse estudo foi avaliar os resultados de reconstrução mamária imediata com emprego expansores e implantes em pacientes submetidas à radioterapia e não submetidas à radioterapia no pós-operatório.
MÉTODOS: Foi realizado estudo prospectivo consecutivo com 83 mulheres submetidas à reconstrução mamária imediata com expansores seguido de implantes no período de 2007 a 2012, totalizando 90 reconstruções. No primeiro tempo cirúrgico, o expansor foi colocado em uma bolsa submuscular sob os músculos peitoral maior e serrátil. No segundo tempo, o expansor foi substituído pela prótese. Dois grupos de pacientes foram comparados: (1) pacientes que receberam radioterapia no pós-operatório e (2) pacientes que não receberam radioterapia no pós-operatório. Os resultados foram avaliados em cada grupo nos dois tempos cirúrgicos.
RESULTADOS: Trinta e três pacientes receberam tratamento radioterápico (39,8%) no final da expansão. Observamos a ocorrência de 13,25% de complicações no primeiro tempo: deslocamento do expansor (4,8%), esvaziamento (2,4%), infecção (2,4%), deiscência de pele (2,4%) e extrusão (1,2%). No segundo tempo, as complicações foram 17,6%: contratura capsular (7%), extrusão (5,3%), e infecção (5,3%). Com relação aos grupos estudados no primeiro tempo, aqueles que fizeram radioterapia tiveram (18,18%) de complicações e o grupo não exposto à radioterapia apenas (10,0%). No segundo tempo, encontramos 7 (46,6%) complicações para radioterapia e apenas 3 (7,14%) para o grupo não irradiado.
CONCLUSÕES: Pacientes que receberam radioterapia posteriormente à reconstrução apresentaram maiores índices de complicações.
Palavras-chave: Câncer de mama; Mamoplastia; Expansores de Tecido; Implantes de Mama; Radioterapia.
ABSTRACT
INTRODUCTION: Immediate breast reconstruction with an expander/implant is a good option for women submitted to mastectomy. This study aimed to evaluate the results of immediate breast reconstruction with implants and expanders in patients who did or did not undergo postoperative radiotherapy.
METHODS: A consecutive prospective study that involved 83 women submitted to immediate breast reconstruction, was carried out by first performing breast reconstruction surgery with expanders and then with implants. The study was conducted between 2007 and 2012 and accounted for a total of 90 reconstructions. In the first surgery, an expander was placed in a submuscular bag under the pectoralis major and serratus muscles. In the second surgery, the expander was replaced by an implant. We compared the surgical outcomes of both types of surgeries (with implants and with expanders) in patients who underwent postoperative radiotherapy and those who did not.
RESULTS: After the first surgery, 33 patients (39.8%) received radiotherapy, and 13.25% experienced complications, including expander displacement (4.8%), emptying (2.4%), infection (2.4%), skin dehiscence (2.4%), and extrusion (1.2%). After the second surgery, 17.6% of the subjects experienced complications, including capsular contracture (7%), extrusion (5.3%), and infection (5.3%). With regard to the first surgery, 18.8% of the patients who underwent radiotherapy and 10.0% of those who did not, experienced complications. With regard to the second surgery, these prevalences were 46.6 % and 7.14%, respectively.
CONCLUSION: Patients who received radiotherapy after breast reconstruction surgery experienced more complications.
Keywords: Breast cancer; Mammoplasty; Tissue expanders; Breast implants; Radiotherapy.
O câncer de mama é o mais comum entre as mulheres e representa 22% dos casos novos a cada ano. No Brasil, as taxas de mortalidade são elevadas. Na população mundial, a sobrevida média após cinco anos é de 61%. Segundo a OMS, nas décadas de 60 e 70 registrou-se um aumento de 10 vezes nas taxas de incidência1.
As indicações para reconstrução mamária têm sido afetadas por mudanças na abordagem cirúrgica do câncer de mama. No final do século XX, os estudos prospectivos randomizados demostraram índices de sobrevida que não estavam relacionados com o tipo de cirurgia realizada, permitindo a consagração do tratamento conservador do câncer de mama nos estágios iniciais da doença2,3.
O benefício psicológico da reconstrução mamária imediata e a segurança oncológica são comprovados. Ela devolve o perfil corporal da mulher, recupera a sua alta estima, sem deixá-la passar pelo estigma da mutilação4.
A reconstrução mamária imediata com emprego de expansores e implantes tem se tornado procedimento frequente desde a introdução dos expansores de tecido em reconstruções de mama5.
Com o uso cada vez mais frequente de radioterapia como parte da abordagem multimodal no tratamento de câncer de mama, cirurgiões plásticos estão se deparando cada vez mais com pacientes que buscam a reconstrução da mama, mas tiveram uma história de radiação prévia ou que possam necessitar de tratamento radioterápico após a mastectomia.
Apesar da comprovada segurança oncológica da mastectomia associada à reconstrução imediata, questiona-se a interferência dos tratamentos adjuvantes, como radioterapia, sobre a mama reconstruída.
OBJETIVO
O objetivo desse estudo foi avaliar os resultados de reconstrução mamária imediata com emprego expansores e implantes em pacientes submetidas à radioterapia e pacientes não submetidas à radioterapia no pós-operatório.
MÉTODOS
Foi realizado um estudo prospectivo, consecutivo com 83 mulheres portadoras de câncer de mama que foram submetidas à reconstrução mamária imediata em dois tempos com emprego de expansor mamário seguido de implante de silicone, no período de maio de 2007 a dezembro de 2012. Das 83 pacientes, 7 tiveram mastectomia bilateral, totalizando 90 mamas reconstruídas. A idade das pacientes variou entre 22 a 70 anos, com média de 46,8 anos. Não foram incluídos no estudo pacientes com doenças sistêmicas descompensadas, com tumores avançados e inflamatórios e pacientes submetidas à radioterapia prévia na mama. As reconstruções mamárias foram realizadas pelo mesmo cirurgião e as pacientes foram provenientes de centro médico ambulatorial e clínica privada.
A escolha do volume dos expansores foi calculada considerando a largura do tórax, o volume da mama contralateral e o desejo da paciente. O volume do expansor variou entre 200 ml a 600 ml, com média de 407,65 ml.
A reconstrução com expansor foi realizada após a conclusão da mastectomia pelo mastologista, no mesmo tempo cirúrgico. O expansor foi inserido através da confecção de uma bolsa submuscular sob o músculo peitoral maior e músculo serrátil anterior, de modo que o expansor ficasse totalmente coberto pela musculatura (Figura 1).
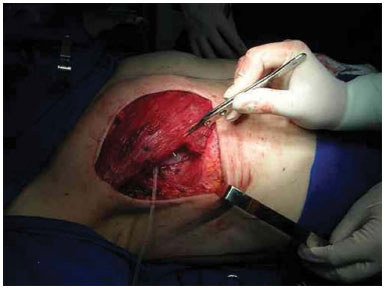
Figura 1. Expansor posicionado em bolsa submuscular.
As válvulas foram posicionadas na região torácica lateral através de um túnel subcutâneo6. Foi colocado dreno de sucção a vácuo em todas as pacientes. Todas pacientes receberam antibioticoterapia (Cefadroxil 500 mg/12/12h) por sete dias.
Foi realizada expansão intraoperatória com 10% volume do expansor em todas pacientes. A duração média da cirurgia foi de 55 minutos.
As sessões de expansão foram iniciadas na quarta semana de pós-operatório, até obtenção do volume total programado, de acordo com a mama contralateral e os anseios da paciente (Figura 2), obrigatoriamente antes do início da radioterapia. Semanalmente, foram expandidos 20% do volume do expansor. O tempo médio entre o 1º tempo e o 2º tempo cirúrgico foi de 1 ano e 3 meses (variando entre 7 meses a 4 anos). A segunda etapa da reconstrução consistiu na remoção do expansor de tecido, uma capsulotomia e capsulectomia se necessário, reposicionamento do sulco mamário seguido pela colocação de prótese permanente. Nesse tempo foi também realizada simetrização da mama oposta (Figuras 2, 3, 4, 5 e 6).
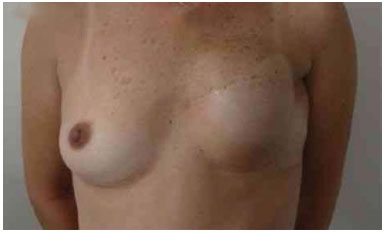
Figura 2. Pós-operatório de 6 meses após a reconstrução com expansor. Expansão completa com 380 ml.
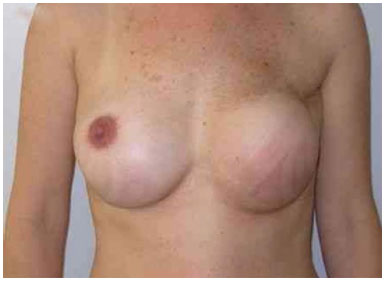
Figura 3. Pós-operatório de 1 ano após a troca do expansor pela prótese, reposicionamento do sulco mamário e simetrização da mama direita com prótese.
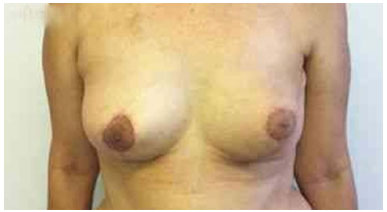
Figura 4. Pós-operatório de 90 dias após a troca do expansor pela prótese na mama esquerda e simetrização da mama direita.
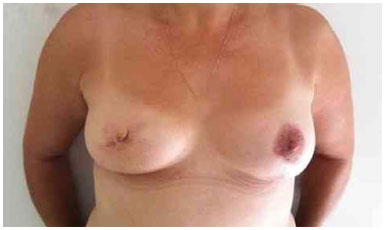
Figura 5. Pós-operatório de 1 ano após a troca do expansor pela prótese na mama direita e simetrização da mama esquerda.
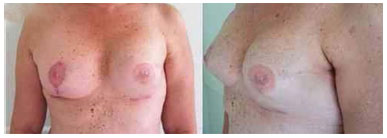
Figura 6. Pós-operatório de 4 meses após a troca do expansor pela prótese na mama esquerda e simetrização mama direita.
RESULTADOS
No total, foram avaliadas 83 pacientes submetidas a 90 procedimentos de reconstrução mamária imediata pósmastectomia no período de estudo (20 de março de 2007 a 12 de dezembro de 2012). Destas, 33 (39,8%) receberam radioterapia (RT) no pós-operatório e 50 (60,2%) não receberam. A média de idade foi de 46,8 anos, com desvio padrão (DP) de 10,5, sendo o mínimo de 22 e o máximo de 70 anos. No Gráfico 1, observamos a distribuição de idade entre os indivíduos que receberam e aqueles que não receberam radioterapia no pós-operatório da reconstrução mamária, sendo a média de idade 47,7 (DP = 9,8) para o grupo que não recebeu e, de 45,6 (DP = 1 1,4) para aqueles que receberam. No total, 91% da amostra tinha mais que 35 anos, sendo para aqueles em radioterapia 12,12% entre 20 e 35 anos, 57,58% entre 35 e 50 anos e 30,30% acima de 50 anos e, para aqueles sem radioterapia, 8% entre 20 e 35 anos, 48% entre 35 e 50 anos e 44% acima de 50 anos (Figura 7).
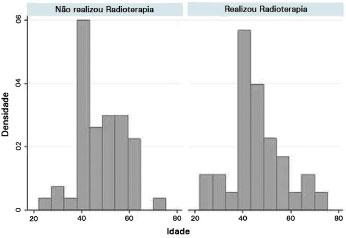
Figura 7. Histograma de idade entre os indivíduos submetidos à reconstrução mamária com e sem uso de radioterapia no pós-operatório.
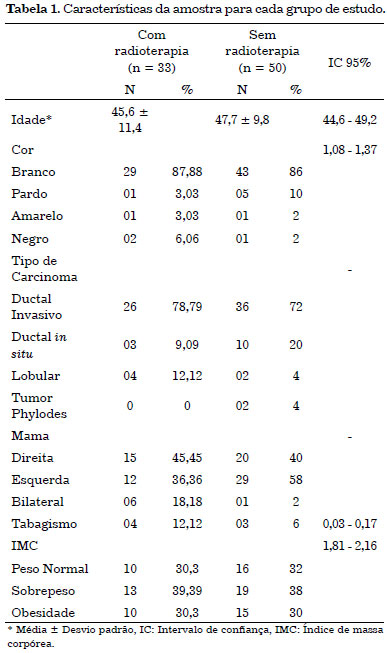
A cor predominante foi mulheres brancas em ambos os grupos, com uma distribuição semelhante. As características dos dois grupos estão expostas na Tabela 1. Apesar do número maior de indivíduos no grupo sem radioterapia (60% da amostra), os grupos foram semelhantes quanto à exposição (idade, tabagismo, sobrepeso, obesidade, volume de expansão e do expansor), sendo estas possíveis confundidoras no presente estudo.
Com relação ao tipo de carcinoma, o ductal invasivo ocorreu na grande maioria, representando 79% no grupo com uso de radioterapia e 72% no grupo sem radioterapia. Quanto à quimioterapia, 93,9% das pacientes a receberam como terapia adjuvante com a radioterapia (p = 0,000) e a ocorrência de casos foi predominantemente unilateral, com diferença estatística entre os grupos (p = 0,014).
Referente ao tabagismo, observou-se uma baixa proporção de mulheres em ambos os grupos e, sem diferença estatística entre eles pelo Teste Exato de Fisher (p = 0,428).
O IMC (índice de massa corporal), no geral, foi semelhante entre os grupos. No entanto, observamos uma alta proporção de mulheres com sobrepeso e obesidade (p = 0,870) e, conforme o gráfico de boxplot (Figura 8), observamos medianas próximas, porém, uma variabilidade maior para o grupo sem radioterapia.
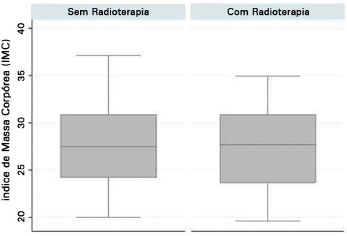
Figura 8. Boxplot do índice de massa corpórea entre as mulheres que realizaram e não realizaram radioterapia pós-mastectomia.
Todas as mulheres que realizaram radioterapia foram submetidas a biópsia do linfonodo sentinela (p = 0,213) e este procedimento foi realizado em 94% das que não realizaram radioterapia
Com relação ao esvaziamento axilar, os grupos foram diferentes estatisticamente (p = 0,000), sendo que 42% daquelas que foram submetidas à radioterapia tiveram o esvaziamento axilar enquanto apenas 6% do outro grupo foi submetido a este procedimento.
O volume do expansor de tecido (p = 0,932) e da expansão realizada (p = 0,992) também não foram diferentes entre os grupos, sendo para o grupo com radioterapia o expansor teve volume médio de 408,1 ml (DP = 74,9), que foram expandidos com média de 391,1 ml (DP = 101,1). No grupo com radioterapia, a média de volume do expansor foi 406,9 ml (DP = 87,4) e foram expandidos com 388,0 ml (DP = 125,2), em média (Figura 9).
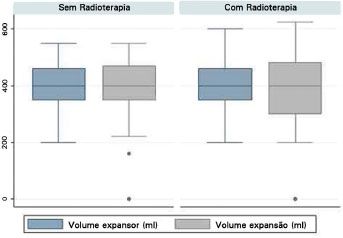
Figura 9. Boxplot do volume do expansor e de expansão entre os grupos.
Em média, o tempo para a segunda cirurgia (meses) foi de 10,8 (DP = 8,5) para o grupo sem radioterapia e 7,9 (DP = 9,7) para o grupo com radioterapia, porém, sem significância estatística (p = 0,159).
Considerando-se os dois grupos (n = 90), a maioria dos indivíduos avaliados não tiveram complicações. No entanto, observamos a ocorrência de deslocamento do expansor (4,8%), esvaziamento (2,4%), infecção (2,4%), deiscência de pele (2,4%) extrusão (1,2%) no primeiro tempo e, no segundo tempo, as complicações encontradas foram: contratura capsular (7%), extrusão (5,3%) e infecção (5,3%). Considerando-se o primeiro tempo cirúrgico, o grupo com radioterapia apresentou 18,18% complicações, enquanto o grupo sem radioterapia teve apenas 10,0%. A proporção de risco para ocorrência destas complicações foi maior para o grupo com radioterapia (p = 0,0001 e IC95% 1,68 - 5,4). No segundo tempo, verificou-se uma incidência de complicações de 46,6% no grupo com radioterapia. É importante salientar que apenas 68,7% dos indivíduos deste grupo foram submetidos à cirurgia de segundo tempo (Tabela 2).
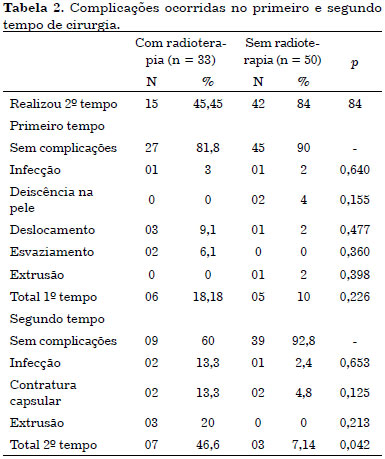
Ao verificar a ocorrência de complicação no segundo tempo e o uso de radioterapia, identificamos diferença entre os grupos pelo teste exato de Fisher (p = 0,042) e, a proporção de risco estimada no presente estudo para a ocorrência de complicações no segundo tempo foi 3,3 vezes maior para o grupo que realizou tratamento radioterápico (p = 0,000; IC 95% 1,85 - 5,9).
O uso de quimioterapia isolado não obteve diferença significativa quanto ao número de complicações no primeiro (p = 0,166) e no segundo tempo (p = 0,843). Dentre aqueles que realizaram esvaziamento axilar e quimioterapia, a proporção de risco para complicações no segundo tempo foi 2,28 vezes maior (p = 0,023 e IC 95% 1,17 - 4,46) e, quanto à radioterapia, a proporção de risco para complicações foi 2,8 vezes maior para o grupo em uso de RT (p = 0,0039 e IC 95% 1,39 - 5,7). Entretanto, a amostra obteve um número muito alto de indivíduos com esvaziamento axilar e uso de radioterapia; desta forma, estes dados devem ser estudados com amostras relevantes para conhecimento dos riscos e medidas de prevenção a este grupo de pacientes.
O uso concomitante de radioterapia e quimioterapia não apresentou significância quanto ao risco de complicações, pois dentre aqueles que realizaram quimioterapia a frequência de indivíduos que também realizaram RT foi de 93,9%. A proporção de risco para realizar ambos os tratamentos foi de 0,78 (p = 0,025 e IC 95% 0,65 - 0,95).
Com relação à idade, considera-se como um grupo de risco para complicações as mulheres com 45 anos ou mais, no entanto, não identificamos diferença na amostra estudada. Quando considerado apenas o grupo que apresentou complicações, 48,5% tinha acima de 45 anos no grupo com radioterapia e 52% no grupo sem radioterapia (p = 0,754).
Desta forma, a análise de risco sugeriu uma proporção maior dentre aqueles expostos à radioterapia e quimioterapia para a ocorrência de complicações no segundo tempo. As Figuras 10 a 21 ilustram alguns dos resultados obtidos com a reconstrução.
Figura 10. Pós-operatório de 8 meses após a reconstrução com expansor. Expansão completa com 400 ml.
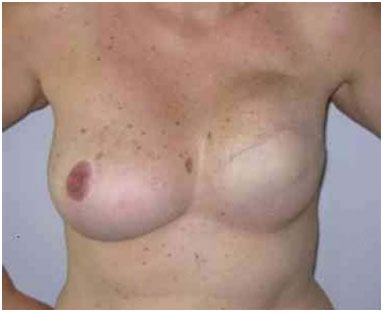
Figura 11. Pós-operatório de 1 ano após a troca do expansor pela prótese, reposicionamento do sulco e simetrização da mama direita.
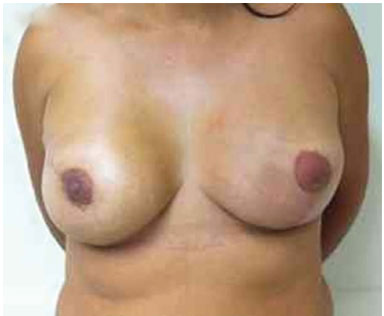
Figura 12. Pós-operatório de 2 anos após a troca do expansor pela prótese na mama direita e simetrização da mama esquerda.
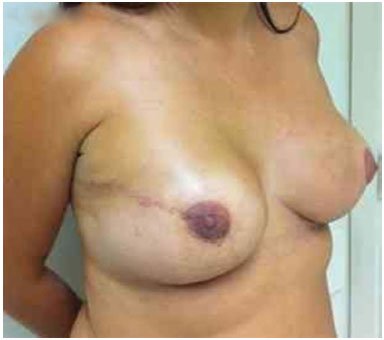
Figura 13. Pós-operatório de 1 ano - troca do expansor pela prótese mama direita e simetrização da mama esquerda.
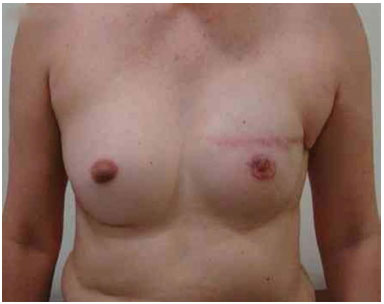
Figura 14. Pós-operatório de 1 ano após a troca do expansor pela prótese mama esquerda e simetrização mama direita com prótese.
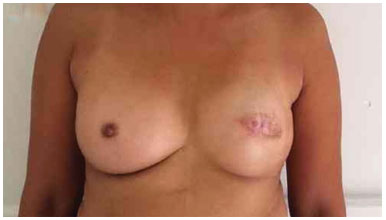
Figura 15. Pós-operatório 3 anos após a troca do expansor pela prótese mama esquerda e simetrização mama direita com prótese.
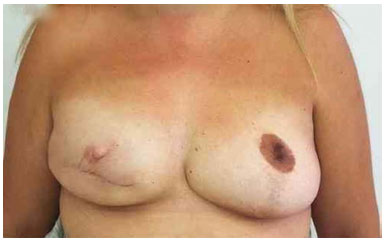
Figura 16. Pós-operatório de 5 anos após a troca do expansor pela prótese na mama direita e simetrização da mama esquerda.
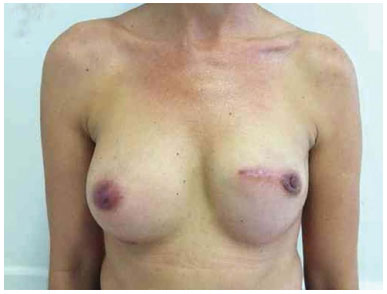
Figura 17. Pós-operatório de 8 meses após a troca do expansor pela prótese mama esquerda e simetrização mama direita com prótese.
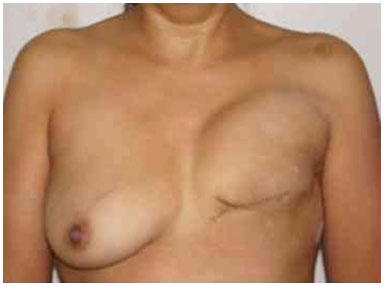
Figura 18. Pós-operatório de 6 meses após a reconstrução com expansor evoluindo com deslocamento superior.
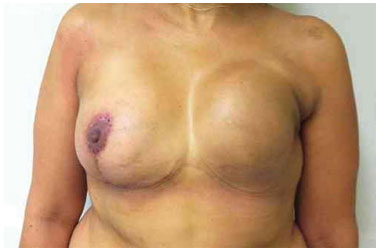
Figura 19. Pós-operatório de 3 meses após a troca do expansor pela prótese mama esquerda, reposicionamento do sulco e simetrização da mama.
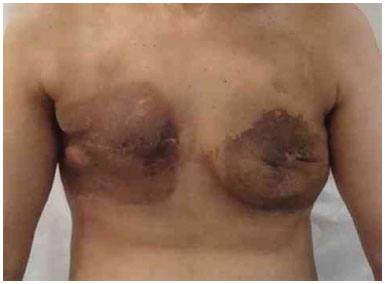
Figura 20. Pós-operatório de 6 meses após a reconstrução com expansor bilateral evoluindo com infecção secundária à radiodermite.
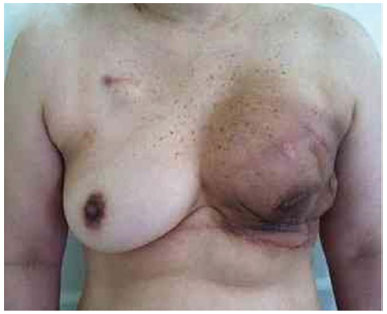
Figura 21. Pós-operatório de 4 meses após a reconstrução com o expansor esquerdo evoluindo com infecção em paciente submetida à radioterapia.
DISCUSSÃO
A escolha da técnica mais adequada para reconstrução mamária depende do tipo de mastectomia a ser realizada, dos tratamentos adjuvantes, da avaliação individual de cada paciente levando-se em consideração a área doadora, doenças sistêmicas concomitantes e a preferência da paciente. Na nossa avaliação inicial, todos os métodos de reconstrução da mama são apresentados, e um exame físico é realizado para determinar se as suas áreas doadoras são adequadas. Depois disso, uma decisão é tomada em conjunto com a paciente e o cirurgião.
As indicações para radioterapia pós-mastectomia continuam a se expandir. Um número crescente de mulheres submetidas à mastectomia receberá tratamento com radioterapia subsequente.
Até recentemente, radioterapia era geralmente recomendada apenas para pacientes com margens do tumor comprometidas, tumores T3, ou com quatro ou mais linfonodos positivos. No entanto, vários ensaios clínicos têm documentado uma vantagem de sobrevivência para pacientes com tumores em estágios II e menos de quatro linfonodos envolvidos que recebem a radioterapia adjuvante. Contudo, um número crescente de mulheres que se submetem à reconstrução mamária imediata com a colocação de um expansor de tecido recebem irradiação7.
Relatos na literatura questionam a interferência dos tratamentos adjuvantes, como a radioterapia sobre a mama reconstruída independentemente do tipo de reconstrução. Adicionalmente, a incidência de complicações após reconstrução autóloga e irradiação também é bastante considerável. No M. D. Anderson Cancer Center, de 32 pacientes irradiados com retalhos transverso do músculo reto abdominal, 87% desenvolveram complicações tardias e 28% precisaram de um retalho adicional para reparação do contorno8.
Nosso estudo não avaliou os resultados de pacientes que receberam irradiação antes de mastectomia, nem refletem a experiência com pacientes irradiadas durante a expansão. Realizamos a completa expansão do tecido antes de iniciar a radiação. A troca do expansor pela prótese foi realizada pelo menos 6 meses após a conclusão da terapia de radiação. Essa espera até a total recuperação dos efeitos da radioterapia pode reduzir pode reduzir significativamente falha da reconstrução9.
Nossos resultados são consistentes com aqueles que demonstram uma influência negativa da irradiação sobre as complicações da reconstrução do expansor. Observamos a ocorrência de 13,2% de complicações no primeiro tempo e no segundo tempo ocorreram 17,6% de complicações. Com relação aos grupos estudados, aqueles que fizeram radioterapia tiveram 6 (18,18%) complicações e o grupo não exposto à radioterapia apenas 5 (10,0%) no primeiro tempo. Mesmo com um número de indivíduos maior, a ocorrência de complicações no segundo grupo foi semelhante ao primeiro. No segundo tempo, o risco de complicações foi 3,3 vezes maior para o grupo que realizou tratamento radioterápico (p = 0,000; IC 95% 1,85 - 5,9). Temos que atentar que esta probabilidade de evento significativa pode estar associada ao tamanho da amostra insuficiente para generalização dos achados.
No segundo tempo, no grupo com RT, das 7 complicações, tivemos que fazer cirurgia de salvamento da reconstrução em 3 casos, 2 de infecção e 1 caso de extrusão (2 com músculo grande dorsal e 1 com retalho do músculo transverso abdominal) e, em 2 casos de extrusão, a prótese foi substituída por outra de volume menor. No grupo não irradiado, tivemos apenas 1 caso de infecção por descuido com dreno, com necessidade de retirada da prótese e substituição posterior por uma prótese expansora.
Dos 83 pacientes do primeiro tempo, 57 foram para o segundo tempo e 26 não finalizaram o procedimento pelas seguintes razões: 20 pacientes ainda estão em tratamento adjuvante, 3 perderam o convênio médico, 1 por óbito e 2 por complicações no primeiro tempo (infecção secundária radiodermite).
Nossos resultados são compatíveis com a literatura. Estudos têm demonstrado, quase uniformemente, um aumento na taxa de complicações entre pacientes com história de radiação, em comparação com pacientes não irradiados após a reconstrução com expansão do tecido mamário10-14.
Krueger et al.15, estudando 81 pacientes, relataram taxas de complicação de 68% entre pacientes irradiados, em comparação com 31% entre os que não foram irradiados. Cordeiro et al.16 relatam taxa de complicações 29,7% em grupo irradiado contra 15,5% em grupo não irradiado. Esses autores mostraram que, embora os pacientes irradiados apresentassem taxas mais elevadas de complicações, a satisfação geral do paciente permaneceu a mesma nos dois grupos (irradiados e não irradiados)15,17.
Para minimizar complicações, estudos demonstram que o uso de derme acelular é um adjuvante útil para a reconstrução imediata da mama, porém, em nosso meio não dispomos de materiais bioprotéticos devido ao elevado custo. Um estudo de Spear et al.18 relata uma taxa geral de complicações de 12% após expansor com colocação derme acelular, enquanto a taxa de complicações após a troca de implantes foi de 2,2%.
CONCLUSÃO
Pacientes que foram submetidas à radioterapia posteriormente à reconstrução apresentaram maiores índices de complicações. A proporção de risco estimada no presente estudo para a ocorrência de complicações no segundo tempo foi 3,3 vezes maior para o grupo que realizou tratamento radioterápico.
REFERÊNCIAS
1. Brasil. Instituto Nacional Câncer. Estimativa 2012, Rio de Janeiro [Acesso em: 22 Jul. 2013]. Disponível em: http://www2.inca.gov.br/wps/wcm/connect/tiposdecancer/site/home/mama
2. Veronesi U, Saccozzi R, Del Vecchio M, Banfi A, Clemente C, De Lena M, et al. Comparing radical mastectomy with quadrantectomy, axillary dissection, and radiotherapy in patients with small cancers of the breast. N Engl J Med. 1981;305(1):6-11. PMID: 7015141 DOI: http://dx.doi.org/10.1056/NEJM198107023050102
3. Fisher B, Anderson S. Conservative surgery for the management of invasive and noninvasive carcinoma of the breast: NSABP trials. National Surgical Adjuvant Breast and Bowel Project. World J Surg. 1994;18(1):63-9. DOI: http://dx.doi.org/10.1007/BF00348193
4. Al-Ghazal SK, Sully L, Fallowfield L, Blamey RW. The psychological impact of immediate rather than delayed breast reconstruction. Eur J Surg Oncol. 2000;26(1):17-9. DOI: http://dx.doi.org/10.1053/ejso.1999.0733
5. Radovan C. Breast reconstruction after mastectomy using the temporary expander. Plast Reconstr Surg. 1982;69(2):195-208. PMID: 7054790 DOI: http://dx.doi.org/10.1097/00006534-198202000-00001
6. Di Benedetto G, Aquinati A, Santoli M, Bertani A. Which is the best position for the remote injection dome using the adjustable expander/prosthesis in breast reconstruction? A comparative study. Plast Reconstr Surg. 2004;113(6):1629-33. PMID: 15114122 DOI: http://dx.doi.org/10.1097/01.PRS.0000117193.97440.CC
7. Frassica DA, Zellars R. Radiation oncology: the year in review. Curr Opin Oncol. 2002;14(6):594-9. DOI: http://dx.doi.org/10.1097/00001622-200211000-00002
8. Tran NV, Chang DW, Gupta A, Kroll SS, Robb GL. Comparison of immediate and delayed free TRAM flap breast reconstruction in patients receiving postmastectomy radiation therapy. Plast Reconstr Surg. 2001;108(1):78-82. PMID: 11420508 DOI: http://dx.doi.org/10.1097/00006534-200107000-00013
9. Peled AW, Foster RD, Esserman LJ, Park CC, Hwang ES, Fowble B. Increasing the time to expander-implant exchange after postmastectomy radiation therapy reduces expander-implant failure. Plast Reconstr Surg. 2012;130(3):503-9. PMID: 22929235 DOI: http://dx.doi.org/10.1097/PRS.0b013e31825dbf15
10. Benediktsson K, Perbeck L. Capsular contracture around saline-filled and textured subcutaneously-placed implants in irradiated and non-irradiated breast cancer patients: five years of monitoring of a prospective trial. J Plast Reconstr Aesthet Surg. 2006;59(1):27-34. DOI: http://dx.doi.org/10.1016/j.bjps.2005.08.005
11. Cordeiro PG, McCarthy CM. A single surgeon's 12-year experience with tissue expander/implant breast reconstruction: part I. A prospective analysis of early complications. Plast Reconstr Surg. 2006;118(4):825-31. DOI: http://dx.doi.org/10.1097/01.prs.0000232362.82402.e8
12. Spear SL, Onyewu C. Staged breast reconstruction with saline-filled implants in the irradiated breast: recent trends and therapeutic implications. Plast Reconstr Surg. 2000;105(3):930-42. PMID: 10724252 DOI: http://dx.doi.org/10.1097/00006534-200003000-00016
13. Spear SL, Newman MK, Bedford MS, Schwartz KA, Cohen M, Schwartz JS. A retrospective analysis of outcomes using three common methods for immediate breast reconstruction. Plast Reconstr Surg. 2008;122(2):340-7. PMID: 18626348 DOI: http://dx.doi.org/10.1097/PRS.0b013e31817d6009
14. Peled AW, Stover AC, Foster RD, McGrath MH, Hwang ES. Long-term reconstructive outcomes after expander-implant breast reconstruction with serious infectious or wound-healing complications. Ann Plast Surg. 2012;68(4):369-73. PMID: 22421481 DOI: http://dx.doi.org/10.1097/SAP.0b013e31823aee67
15. Krueger EA, Wilkins EG, Strawderman M, Cederna P, Goldfarb S, Vicini FA. Complications and patient satisfaction following expander/implant breast reconstruction with and without radiotherapy. Int J Radiat Oncol Biol Phys. 2001;49(3):713-21. PMID: 11172953 DOI: http://dx.doi.org/10.1016/S0360-3016(00)01402-4
16. Cordeiro PG, Snell L, Heerdt A, McCarthy C. Immediate tissue expander/implast breast reconstruction after salvage mastectomy for cancer recurrence following lumpectomy/irradiation. Plast Reconstr Surg. 2012;129(2):341-50. PMID: 22286416 DOI: http:// dx.doi.org/10.1097/PRS.0b013e318205f203
17. Cordeiro PG, Pusic AL, Disa JJ, McCormick B, VanZee K. Irradiation after immediate tissue expander/implant breast reconstruction: outcomes, complications, aesthetic results, and satisfaction among 156 patients. Plast Reconstr Surg. 2004;113(3):877-81. PMID: 15108879 DOI: http://dx.doi.org/10.1097/01.PRS.0000105689.84930.E5
18. Spear SL, Parikh PM, Reisin E, Menon NG. Acellular dermis-assisted breast reconstruction. Aesthetic Plast Surg. 2008;32(3):418-25. DOI: http://dx.doi.org/10.1007/s00266-008-9128-8
1. Universidade Federal de São Paulo, São Paulo, SP, Brasil
2. Universidade Estadual do Rio de Janeiro, Rio de Janeiro, RJ, Brasil
3. Sociedade Brasileira de Cirurgia Plática, São Paulo, SP, Brasil
4. Instituto Brasileiro de Cirurgias Plástica, São Paulo, SP, Brasil
Instituição: Instituto Brasileiro de Cirurgia Plastica, São Paulo, SP, Brasil.
Autor correspondente:
Andreia Bufoni Farah
Alameda dos Aicás, 1417, Moema
São Paulo, SP, Brasil CEP 04086003
E-mail: andreiafarah@gmail.com
Artigo submetido: 29/7/2013.
Artigo aceito: 26/5/2014.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter