

Original Article - Year 2015 - Volume 30 -
Reconstrução mamária imediata com retalho do músculo grande dorsal e implante de silicone
Immediate breast reconstruction with latissimus dorsi flap and silicone implant
RESUMO
INTRODUÇÃO: O primeiro tratamento eficaz para o câncer de mama foi descrito em 1894. A partir das décadas de 60 e 70, cirurgias menos agressivas foram desenvolvidas, sem prejuízos oncológicos. Com evolução histórica semelhante, o retalho do músculo grande dorsal (RMGD) foi introduzido em 1906. Contudo, apenas 70 anos após sua primeira descrição, ele ganhou popularidade como uma opção para as reconstruções mamárias.
MÉTODO: Estudo clínico retrospectivo realizado por meio da coleta de dados de 22 pacientes submetidas à reconstrução mamária imediata com emprego do RMGD associado a implante de silicone durante o período de fevereiro de 2012 a dezembro de 2013.
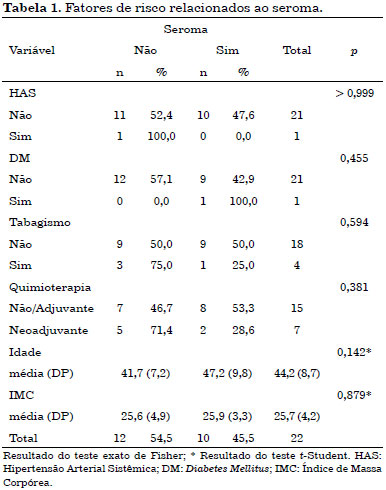
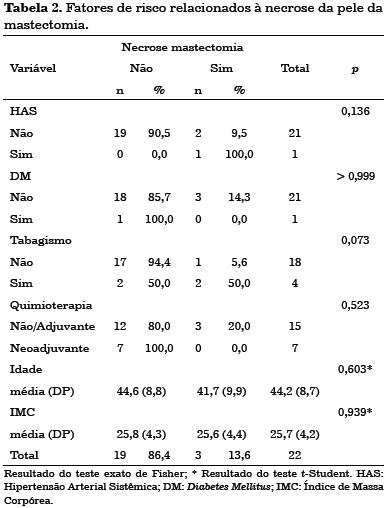
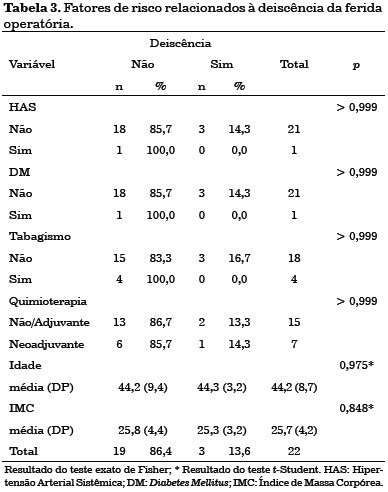
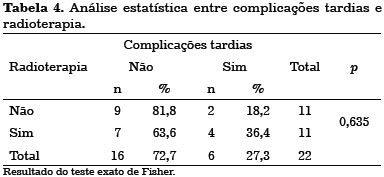
RESULTADOS: Não houve necrose do retalho de grande dorsal ou perda da reconstrução mamária nos casos estudados. Foram observados 10 casos (45%) de seroma em região dorsal, 3 casos (14%) de necrose parcial da pele da mastectomia e 3 casos (14%) de deiscência parcial da ferida operatória. Não foram evidenciados fatores de risco com significância estatística para as complicações apresentadas. Ocorreram 4 casos (18,18%) de alterações de cobertura do implante, com atrofia muscular e cutânea, e 2 casos (9,09%) de contratura capsular. Apenas um caso não foi associado à radioterapia. Contudo, não houve significância estatística em relação à radioterapia adjuvante e às complicações tardias apresentadas (p = 0,635).
CONCLUSÃO: O RMGD associado ao implante de silicone é uma opção segura e confiável para a reconstrução mamária imediata após mastectomias.
Palavras-chave: Mama/cirurgia; Neoplasias da mama; Retalhos cirúrgicos; Implante mamário.
ABSTRACT
INTRODUCTION: The first effective breast cancer treatment was described in 1894. Less aggressive surgeries were developed in the 1960s and 70s, without increased mortality due to cancer. With similar historical evolution, the latissimus dorsi muscle flap (LDMF) procedure was introduced in 1906. Seventy years after its first description, LDMF gained popularity as an option for breast reconstruction.
METHOD: A retrospective clinical study was conducted using data obtained from 22 patients undergoing immediate breast reconstruction with LDMF and silicone implants between February 2012 and December 2013.
RESULTS: No latissimus dorsi flap necrosis or breast reconstruction losses were observed in this study. Ten cases (45%) of seroma were detected in the dorsal region, three cases (14%) of partial necrosis of the mastectomized skin, and three cases (14%) of partial surgical wound dehiscence. Statistical significant risk factors for the complications observed have not been emphasized. There were four cases (18.18%) of muscle and skin atrophy associated with implants, and two cases (9.09%) of capsular contracture. Only one case was not associated with radiotherapy. However, there were no statistically significant differences in adjuvant radiotherapy and late complications (p = 0.635).
CONCLUSION: LDMF associated with silicone implants is a safe and reliable option for immediate breast reconstruction after mastectomies.
Keywords: Breast/surgery; Breast neoplasms; Surgical flaps; Breast implant.
O câncer de mama é a neoplasia mais comum entre as mulheres. Segundo dados do Instituto Nacional do Câncer (INCA), a estimativa de casos novos no Brasil é 57.120 para o ano de 2014. Estatísticas indicam um aumento na incidência da neoplasia tanto em países desenvolvidos quanto em países em desenvolvimento. No Brasil, as taxas de mortalidade continuam elevadas, pois a doença ainda é diagnosticada em estágios avançados1.
O primeiro tratamento eficaz para o câncer de mama foi a mastectomia radical clássica, descrita por Halsted em 18942. A partir das décadas de 60 e 70, novas técnicas cirúrgicas menos agressivas foram desenvolvidas com a finalidade de diminuir a morbidade cirúrgica, sem prejuízo dos resultados oncológicos3-6. Atualmente, a mastectomia preservadora de pele, e quando o caso permite, preservadora do complexo aréolo-papilar (CAP), tornaram-se opções de tratamento com resultados terapêuticos semelhantes7-9. Consequentemente, o espectro de opções de reparação das sequelas mamárias cada vez menores acompanhou esta evolução10.
Com evolução histórica semelhante, o retalho do músculo grande dorsal foi primeiramente descrito por Tansini em 190611. Contudo, apenas em 1976 Olivari descreveu seu uso para cobertura de lesões radioterápicas da parede torácica12. No ano seguinte, Schneider et al.13 introduziram o retalho miocutâneo em ilha do músculo grande dorsal (RMGD) para a reconstrução mamária e, em 1978, Bostwick et al.14 descreveram uma modificação do procedimento com utilização associada do músculo peitoral maior para cobertura do implante mamário.
Desde então, o RMGD ganhou popularidade por ser um procedimento relativamente simples e apresentar uma ilha de pele com vascularização consistente15.
OBJETIVO
Este estudo visa apresentar os resultados cirúrgicos das reconstruções mamárias imediatas com emprego do RMGD associado a implante de silicone.
MÉTODO
Trata-se de um estudo clínico retrospectivo observacional realizado por meio de revisão de prontuários médicos de pacientes operadas e acompanhadas ambulatorialmente. Foram coletados dados de 22 pacientes submetidas à reconstrução mamária imediata com emprego do RMGD associado a implante de silicone anatômico de gel coesivo durante o período de fevereiro de 2012 a dezembro de 2013.
Técnica cirúrgica
O planejamento cirúrgico da via de acesso para ressecção oncológica é realizado em conjunto com a equipe da mastologia. A ilha cutânea dorsal tem orientação horizontal e é dimensionada e posicionada de acordo com a necessidade específica do caso (Figuras 1 e 2).
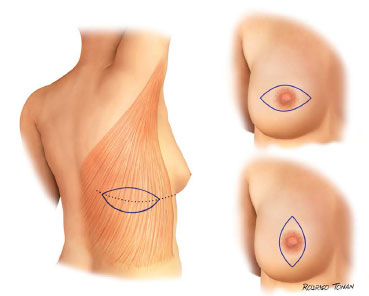
Figura 1. Programações cirúrgicas clássicas.
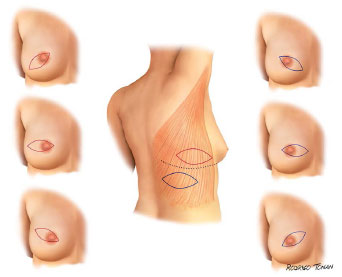
Figura 2. Variantes das programações cirúrgicas clássicas.
Após o término da cirurgia oncológica, a paciente é posicionada em decúbito lateral. O músculo é dissecado em sua totalidade, mantendo a camada areolar do tecido celular subcutâneo na sua face anterior (Figura 3).
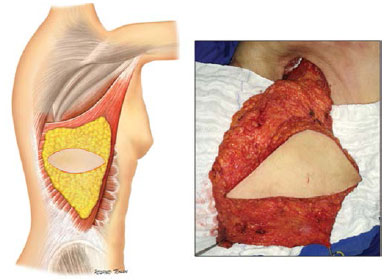
Figura 3. Anatomia cirúrgica do músculo grande dorsal.
A transposição do músculo para o hemitórax acometido é realizada através de tunelização no terço superior da área lateral do tórax, preservando o contorno inferolateral da mama.
O músculo é então fixado perifericamente abrangendo toda a área da mastectomia e, desta forma, delimitando a loja que irá conter o implante (Figura 4).
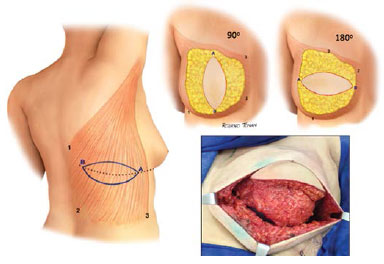
Figura 4. Variações no posicionamento do retalho na mama reconstruída.
A escolha do implante é multifatorial e baseada em critérios como o diâmetro da base da loja delimitada no hemitórax, peso da mama ressecada e a quantidade de tecido remanescente. Isto é realizado com a finalidade de cobrir o implante confortavelmente e sem restrição, visando máxima projeção e ptose para a mama reconstruída.
Se necessário, são realizados ajustes cutâneos da pele da mastectomia e da ilha cutânea do retalho visando otimizar a exposição e localização da mesma dentro da mama reconstruída.
São posicionados 2 drenos de aspiração por contra-abertura, um na região dorsal e o outro na mama, acima da loja muscular.
Realizado fechamento por planos com poliglactina 2.0, 3.0 e poliglecaprone 25 4.0. Não se usaram pontos de adesão na área de descolamento da região dorsal.
A paciente é mantida com enfaixamento torácico por 24 horas. O mesmo é substituído por sutiã cirúrgico, que é mantido por 30 dias. Além disso, prescreve-se cefadroxila 500 mg a cada 12 horas por 14 dias. O dreno da mama é retirado por volta de 7 dias e o dorsal por volta de 14 dias, com débito menor que 30 ml em 24 horas.
Todas as pacientes foram acompanhadas ambulatorialmente para controle pós-operatório e documentação fotográfica.
Os dados foram coletados e encaminhados para análise estatística.
RESULTADOS
A média de idade das pacientes estudadas foi de 44 anos e 2 meses e o desvio padrão foi de ± 8,72, variando de 30 a 71 anos. A mediana foi de 42 anos e 6 meses.
O Índice de Massa Corpórea (IMC) médio foi de 25,7 kg/m2, e o desvio padrão foi de ± 4,17 kg/m2, variando de 37,7 kg/m2 a 20,3 kg/m2. O IMC mediano foi de 25,2 kg/m2.
Entre as 22 pacientes analisadas, 1 (4,5%) apresentava hipertensão arterial sistêmica, 1 (4,5%) apresentava diabetes melitus e 4 (18,2%) eram tabagistas no momento da cirurgia.
A duração média da internação hospitalar foi de 2 dias e o desvio padrão foi de ± 0,4, variando de 1 a 3 dias. A mediana foi de 2 dias.
Com relação ao procedimento da equipe da mastologia, 11 pacientes (50%) foram submetidas à mastectomia radical modificada à Madden, 9 pacientes (41%) foram submetidas à mastectomia simples e biópsia do linfonodo sentinela (BLS), 1 (4,5%) paciente foi submetida à adenectomia e BLS e 1 (4,5%) foi submetida a apenas adenectomia.
Com relação ao diagnóstico anatomopatológico tumoral, 19 pacientes (86%) apresentaram carcinoma ductal invasivo (CDI), 2 pacientes (9,1%) apresentaram carcinoma lobular invasivo (CLI) e 1 paciente (4,5%) apresentou diagnóstico de carcinoma ductal in situ (CDIS). O diâmetro tumoral médio foi de 35 mm, variando de 10 a 140 mm. O desvio padrão foi de ± 28,4 mm e a mediana foi de 27 mm.
Entre as pacientes analisadas, 1 (4,5%) apresentou Estádio Zero, 6 (27,3%) apresentaram Estádio IA, 7 (31,8%) apresentaram Estádio IIA, 2 (9,1%) apresentaram Estádio IIB, 3 (13,6%) apresentaram Estádio IIIA, 1 (4,5%) apresentou Estádio IIIB e 2 (9,1%) apresentaram Estádio IIIC.
Em relação ao tratamento clínico, 12 pacientes (54,5%) foram submetidas à quimioterapia adjuvante, 7 pacientes (31,8%) foram submetidas à quimioterapia neoadjuvante e 3 pacientes (13,6%) não foram submetidas à quimioterapia. Já em relação à radioterapia adjuvante, ela foi realizada em 11 (50%) das 22 pacientes operadas.
A duração média do procedimento cirúrgico completo foi de 5 horas e 48 minutos, com desvio padrão foi de ± 1 hora e 6 minutos, variando de 3 horas e meia a 8 horas. A mediana foi de 5 horas e 45 minutos.
O peso médio da peça cirúrgica foi de 493 gramas, com desvio padrão de ± 241 gramas, variando de 90 a 918 gramas. A mediana foi de 518 gramas.
Todos os procedimentos foram realizados com implante de silicone de formato anatômico, com projeção máxima. O peso médio dos implantes foi de 373 gramas, com desvio padrão foi de ± 100 gramas, variando de 165 a 510 gramas. A mediana foi de 385 gramas.
O área média do defeito cutâneo da mama ressecada foi de 49 cm2, com desvio padrão foi de ± 27,5 cm2, variando de 0 a 117,8 cm2. A mediana foi de 43,6 cm2.
Foram consideradas complicações precoces aquelas que ocorreram em até 30 dias de pós-operatório. Dentre estas, foi observado 10 casos (45%) de seroma em região dorsal, 3 casos (14%) de necrose parcial da pele da mastectomia e 3 casos (14%) de deiscência parcial da ferida operatória. Não se observou necrose do retalho de grande dorsal nos casos estudados.
Não se observaram fatores de risco com significância estatística para as complicações precoces apresentadas (Tabelas 1, 2 e 3).
Todas as complicações recentes foram tratadas ambulatoriamente, sem a necessidade de nova internação.
Complicações tardias foram consideradas aquelas que ocorreram após 30 dias da cirurgia. Foram observados 4 casos (18,18%) de alterações de cobertura do implante, com atrofia muscular e cutânea, predominantemente em polo superior da mama. Apenas 1 caso não foi associado à radioterapia. Todos os casos foram tratados com lipoenxertia. Observou-se também 2 casos (9,09%) de contratura capsular. Ambos foram associados à radioterapia e necessitaram capsulotomia cirúrgica (Figura 5).
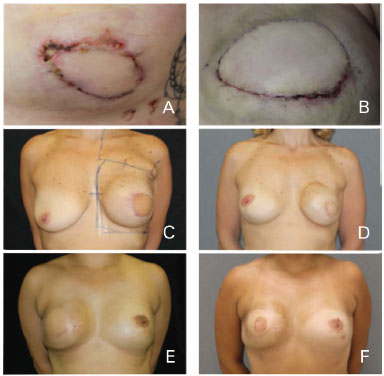
Figura 5. Complicações. (A, B) Necrose de pele da mastectomia. (C, D, E, F) Contratura capsular e atrofia após radioterapia.
Não se observou significância estatística em relação à radioterapia adjuvante e as complicações tardias apresentadas (Tabela 4).
Não foi observada a ocorrência de complicações clínicas nas pacientes avaliadas.
O seguimento médio das pacientes foi de 16 meses e 24 dias e o desvio padrão foi de ± 7 meses e 12 dias, variando de 27 meses e 27 dias a 5 meses e 27 dias. A mediana foi de 17 meses e 3 dias (Figuras 6, 7, 8, 9 e 10).
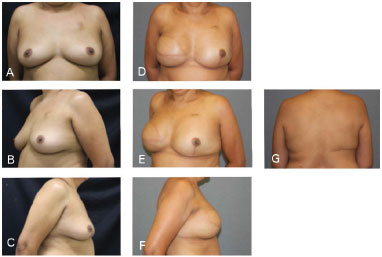
Figura 6. Caso clínico 1: Mastectomia clássica. Implante anatômico 435 g. Adenectomia esquerda (400 g). A, B e C - Pré-operatório; D, E, F e G - Pós-operatório 18 meses.
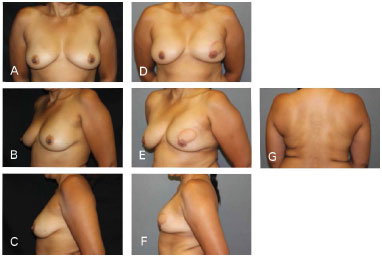
Figura 7. Caso clínico 2: Mastectomia preservadora de pele. Implante anatômico 335 g. Rec. CAP (inguinal e papila contralateral). A, B e C - Pré-operatório; D, E, F e G - Pós-operatório 18 meses.
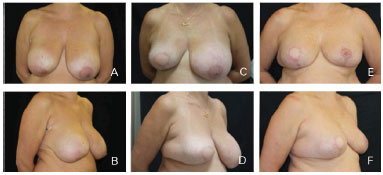
Figura 8. Caso clínico 3; Mastectomia à D. Reconstrução com ajustes em "T". Implante anatômico 550g. Simetrização com mamoplastia. A e B - Pré-operatório; C e D - Pós-operatório 6 meses; E e F - Pós-operatório 12 meses.
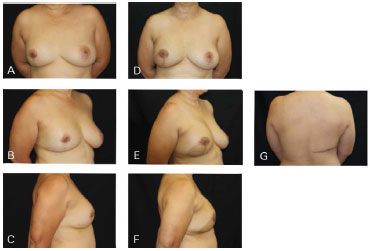
Figura 9. Caso clínico 4: Mastectomia com ressecção de pele supratumoral. Recidiva pós-QUART. Implante anatômico 310 g. Preservação do CAP. A, B e C - Pré-operatório; D, E, F e G - Pós-operatório 6 meses.
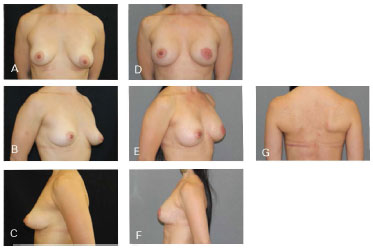
Figura 10. Caso clínico 5: Mastectomia periareolar. Implante anatômico 335 g. Enxerto do CAP. Simetrização (200 g). A, B e C - Pré-operatório; D, E, F e G - Pós-operatório 4 meses.
DISCUSSÃO
Nas últimas décadas, houve evolução importante na detecção e no entendimento do carcinoma mamário, com diagnósticos cada vez mais precoces. Estes fatores acarretaram aumento no número das mastectomias menos agressivas como poupadoras de pele e do CAP, capazes de proporcionar ptose e melhor formato do cone nas mamas reconstruídas. Além disto, ocorreu aumento das reconstruções mamária imediatas que proporcionam menores índices de fibrose, retração e atrofia teciduais. Neste mesmo período, uma geração aprimorada de implantes de silicone tornaram-se disponíveis no mercado, cuja alta coesividade do gel confere estabilidade ao formato mamário. Estes fatores associados ampliaram o leque de escolha reconstrutiva do cirurgião frente ao defeito mamário apresentado10,16.
Dentro deste panorama, observou-se aumento das indicações de reconstruções mamárias com retalhos locais, materiais aloplásticos e com o RMGD, em detrimento do retalho transverso do músculo reto abdominal (TRAM), que apresenta maior morbidade local e sistêmica17,18 (Figura 11).
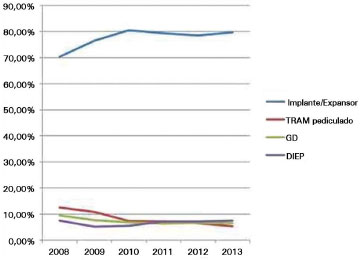
Figura 11. Números das reconstruções mamárias nos EUA. Fonte: America Society of Plastic Surgeons - www.plasticsurgery.org
As dimensões do músculo grande dorsal são de até 16,3 cm de largura por 29,2 cm de comprimento e toda a gordura sob a fáscia de Scarpa pode ser mobilizada junto ao músculo com intuito de melhorar a cobertura do implante e até mesmo agregar volume19.
Nas reconstruções mamárias realizadas, optouse pela a dissecção estendida do músculo grande dorsal associado à gordura sob a fáscia de Scarpa. Esta abordagem possibilitou a cobertura completa e sem restrição à projeção dos implantes mamários independente do volume utilizado. Isto conferiu segurança ao procedimento frente aos casos de deiscência da ferida operatória e necrose do retalho da mastectomia, não ocorrendo perdas de reconstrução mamária. Já a manutenção da gordura sobre o músculo proporcionou uma maior interface de cobertura entre o implante e a pele e menor aderência do músculo ao retalho da mastectomia. Isto proporcionou melhores resultados estéticos e maior substrato tecidual para uma posterior lipoenxertia mamária quando necessário.
No cenário do tratamento do câncer de mama, a radioterapia adjuvante à mastectomia é frequentemente realizada em mulheres com diagnóstico de câncer de mama em estádio II e III. Isto aumenta o controle local, a sobrevida livre de doença e a sobrevida global20-23.
Apesar da melhora dos resultados oncológicos, a radioterapia adjuvante em mulheres com câncer de mama pode piorar os resultados estéticos com atrofias teciduais e contraturas capsulares e aumentar o risco de perda da reconstrução mamária24.
Em uma série de 100 casos, Perdikis et al.25 observaram uma taxa de contratura capsular em pacientes submetidas a RMDG e implante de silicone de 6%. Em outra série com 53 casos, Venus & Prinsloo26 observaram 7,4% de contratura capsular que necessitou capsulotomia e 33% de contratura capsular que não necessitou cirurgia. Já em publicação da Emory University com 83 casos, Losken et al.27 observaram que a radioterapia foi o único fator de risco significante para complicações de RMGD (65 vs. 35%, p = 0,05) e não houve impacto nos resultados estéticos.
Nas pacientes estudadas nesta série, observouse 4 casos (18,18%) de alterações de cobertura do implante, com atrofia muscular e cutânea e 2 casos (9,09%) de contratura capsular. Apenas 1 caso não foi associado à radioterapia. Contudo, devido à baixa casuística do estudo, não houve significância estatística quando se comparou a radioterapia adjuvante com as complicações tardias (p = 0,635).
Portanto, apesar da radioterapia aumentar a incidência de complicações em reconstruções mamárias, ela é importante para o tratamento oncológico e o cirurgião plástico deve estar apto a lidar com as consequências deletérias da mesma.
Assim, mesmo com o potencial aumento no risco de complicações associado à radioterapia, a reconstrução mamária imediata seguida da mastectomia deve ser encorajada devido aos benefícios no bem-estar psicológico, social e sexual, independentemente da idade e das comorbidades28,29.
Seroma na área doadora do músculo grande dorsal é a complicação mais comum do procedimento. As taxas desta complicação publicadas na literatura variam de 16% a 79%16,27,30-36. No entanto, a significância do seroma como uma complicação maior, que necessite de nova intervenção cirúrgica, é baixa35,37.
No presente estudo, foi observada uma taxa de 44% de seroma. Este número relativamente alto provavelmente ocorreu devido ao descolamento extenso do músculo grande dorsal e a não realização de pontos de adesão na região dorsal. Todos os casos foram resolvidos de maneira eficaz com punção percutânea ambulatorial. Se considerarmos a alta incidência de seroma como uma intercorrência previsível e de fácil resolução, a mesma não deve ser supervalorizada em detrimento da indicação de um procedimento que agregará segurança e resultado estético satisfatório.
Gart et al.17, em artigo que incluiu 1079 pacientes submetidas a RMGD da base de dados American College of Surgeons National Surgical Improvement Program (ACS-NSQIP), observaram em relação às complicações precoces, 5,7% de reoperações, 3,3% de infecções cutâneas, 1,3% de necrose do retalho, 0,6% de deiscência da ferida operatória e 3,2% de complicações clínicas.
As complicações precoces observadas nesta série pessoal de casos foram 3 casos (14%) de necrose parcial da pele da mastectomia e 3 casos (14%) de deiscência parcial da ferida operatória. Estas intercorrências provavelmente ocorreram devido à necessidade de eficácia oncológica local, acarretando retalhos de mastectomia delgados e hipoperfundidos. Não se observou necrose do retalho de grande dorsal, infecções, complicações clínicas e reoperações nos casos estudados.
Mesmo com o foco recente da literatura científica e da prática cirúrgica em relação aos retalhos microcirúrgicos, o RMGD pediculado continua relevante para uma grande parcela das reconstruções mamárias e não deve ser considerado um retalho com indicação relegada ao segundo plano17.
Além de ser um retalho de grandes dimensões, com um território de pele conhecido e confiável e apresentar menos complicações do que todos os outros retalhos autólogos, o RMGD oferece várias vantagens adicionais, incluindo o tempo de recuperação rápido, as altas taxas de satisfação do paciente, e mínima morbidade da área doadora30,38-40.
CONCLUSÃO
O RMGD associado ao implante de silicone é uma opção segura e confiável para a reconstrução mamária imediata após mastectomias.
REFERÊNCIAS
1. Brasil. Ministério da Saúde. Estimativa 2014: incidência do câncer de mama no Brasil. Instituto Nacional José de Alencar Gomes da Silva [Acesso 19 de maio de 2014]. Disponível em: http://www.inca.gov.br
2. Halsted WS. I. The Results of Operations for the Cure of Cancer of the Breast Performed at the Johns Hopkins Hospital from June, 1889, to January, 1894. Ann Surg. 1894;20(5):497-555. DOI: http://dx.doi.org/10.1097/00000658-189407000-00075
3. Patey DH, Dyson WH. The prognosis of carcinoma of the breast in relation to the type of operation performed. Br J Cancer. 1948;2(1):7-13. DOI:http://dx.doi.org/10.1038/bjc.1948.2
4. Madden JL. Modified radical mastectomy. Surg Gynecol Obstet. 1965;121(6):1221-30. PMID: 5851617
5. Fisher B, Bauer M, Margolese R, Poisson R, Pilch Y, Redmond C, et al. Five-year results of a randomized clinical trial comparing total mastectomy and segmental mastectomy with or without radiation in the treatment of breast cancer. N Engl J Med. 1985;312(11):665-73. PMID: 3883167 DOI:http://dx.doi.org/10.1056/NEJM198503143121101
6. Veronesi U, Saccozzi R, Del Vecchio M, Banfi A, Clemente C, De Lena M, et al. Comparing radical mastectomy with quadrantectomy, axillary dissection, and radiotherapy in patients with small cancers of the breast. N Engl J Med. 1981;305(1):6-11. PMID: 7015141 DOI:http://dx.doi.org/10.1056/NEJM198107023050102
7. Lambert PA, Kolm P, Perry RR. Parameters that predict nipple involvement in breast cancer. J Am Coll Surg. 2000;191(4):354-9. PMID: 11030239
8. Laronga C, Kemp B, Johnston D, Robb GL, Singletary SE. The incidence of occult nipple-areola complex involvement in breast cancer patients receiving a skin-sparing mastectomy. Ann Surg Oncol. 1999;6(6):609-13. DOI: http://dx.doi.org/10.1007/s10434-999-0609-z
9. Toth BA, Lappert P. Modified skin incisions for mastectomy: the need for plastic surgical input in preoperative planning. Plast Reconstr Surg. 1991;87(6):1048-53. PMID: 1852020 DOI: http://dx.doi.org/10.1097/00006534-199106000-00006
10. Claro Jr. F, Costa DV, Pinheiro AS, Pinto-Neto AM. Complicações em reconstrução mamária total em pacientes mastectomizadas por câncer de mama: análise comparativa de longo prazo quanto a influência da técnica, tempo de cirurgia, momento da reconstrução e tratamento adjuvante. Rev Bras Cir Plást. 2013;28(1):85-91. DOI: http://dx.doi.org/10.1590/S1983-51752013000100015
11. Tansini I. Sopra il mio nuovo processor di amputazione della mammella. Gazz Mal Ital. 1906;57:141.
12. Olivari N. The Latissimus flap. Br J Plast Surg. 1976(2);29:126-8. PMID: 776304
13. Schneider WJ, Hill HL Jr, Brown RG. Latissimus dorsi myocutaneous flap for breast reconstruction. Br J Plast Surg. 1977;30(4):277-81.
14. Bostwick J 3rd, Vasconez LO, Jurkiewicz MJ. Breast reconstruction after a radical mastectomy. Plast Reconstr Surg. 1978;61(5):682-93. PMID:347475 DOI: http://dx.doi.org/10.1097/00006534-19780500-000004
15. Hammond DC. Latissimus dorsi flap breast reconstruction. Plast Reconstr Surg. 2009;124(4):1055-63. PMID: 19935289 DOI:http://dx.doi.org/10.1097/PRS.0b013e3181b6bf05
16. Di Lamartine J, Galdino Júnior J, Daher JC, Guimarães GS, Camara Filho JPP, Borgatto MS, et al. Reconstrução mamária com retalho do músculo grande dorsal e materiais aloplásticos: análise de resultados e proposta de nova tática para cobertura do implante. Rev Bras Cir Plást. 2012;27(1):58-66. DOI: http://dx.doi.org/10.1590/S1983-51752012000100010
17. Gart MS, Smetona JT, Hanwright PJ, Fine NA, Bethke KP, Khan SA, et al. Autologous options for postmastectomy breast reconstruction: a comparison of outcomes based on the American College of Surgeons National Surgical Quality Improvement Program. J Am Coll Surg. 2013;216(2):229-38. PMID: 23211118
18. Cammarota MC. Reconstrução de mama com retalho de grande dorsal: estudo das pacientes operadas no período de junho de 2003 a junho de 2005 [Tese para concurso de titular]. In: XLIII Congresso Brasileiro de Cirurgia Plástica; 2006 Nov 11-14; Recife, Brasil.
19. Hazan ASB, Nahas FX, Barbosa MVJ, Pineda E, Juliano Y, Ferreira LM. Análise anátomo-histológica das subunidades musculares do músculo grande dorsal. Rev Soc Bras Cir Plást. 2006;21(4):203-10.
20. Overgaard M, Hansen PS, Overgaard J, Rose C, Andersson M, Bach F, et al. Postoperative radiotherapy in high-risk premenopausal women with breast cancer who receive adjuvant chemotherapy. Danish Breast Cancer Cooperative Group 82b Trial. N Engl J Med. 1997;337(14):949-55. DOI:http://dx.doi.org/10.1056/NEJM199710023371401
21. Overgaard M, Jensen MB, Overgaard J, Hansen PS, Rose C, Andersson M, et al. Postoperative radiotherapy in high-risk postmenopausal breast-cancer patients given adjuvant tamoxifen: Danish Breast Cancer Cooperative Group DBCG 82c randomised trial. Lancet. 1999;353(9165):1641-8. PMID:10335782
22. Ragaz J, Jackson SM, Le N, Plenderleith IH, Spinelli JJ, Basco VE, et al. Adjuvant radiotherapy and chemotherapy in node-positive premenopausal women with breast cancer. N Engl J Med. 1997;337(14):956-62. PMID: 9309100 DOI: http://dx.doi.org/10.1056/NEJM199710023371402
23. Clarke M, Collins R, Darby S, Davies C, Elphinstone P, Evans E, et al.; Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials. Lancet. 2005;366(9503):2087-106.
24. Shah C, Kundu N, Arthur D, Vicini F. Radiation therapy following postmastectomy reconstruction: a systematic review. Ann Surg Oncol. 2013;20(4):1313-22. DOI: http://dx.doi.org/10.1245/s10434-012-2689-4
25. Perdikis G, Koonce S, Collis G, Eck D. Latissimus dorsi myocutaneous flap for breast reconstruction: bad rap or good flap? Eplasty. 2011;11:e39. PMID: 22031843
26. Venus MR, Prinsloo DJ. Immediate breast reconstruction with latissimus dorsi flap and implant: audit of outcomes and patient satisfaction survey. J Plast Reconstr Aesthet Surg. 2010;63(1):101-5. DOI: http://dx.doi.org/10.1016/j.bjps.2008.08.064
27. Losken A, Nicholas CS, Pineel XA, Carlson GW. Outcomes evaluation following bilateral breast reconstruction using latissimus dorsi myocutaneous flaps. Ann Plast Surg. 2010;65(1):17-22. DOI: http://dx.doi.org/10.1097/SAP.0b013e3181bda349
28. Atisha D, Alderman AK, Lowery JC, Kuhn LE, Davis J, Wilkins EG. Prospective analysis of long-term psychosocial outcomes in breast reconstruction: two-year postoperative results from the Michigan Breast Reconstruction Outcomes Study. Ann Surg. 2008;247(6):1019-28. PMID:18520230 DOI: http://dx.doi.org/10.1097/SLA.0b013e3181728a5c
29. Veronesi P, Ballardini B, De Lorenzi F, Magnoni F, Lissidini G, Caldarella P, et al. Immediate breast reconstruction after mastectomy. Breast. 2011;20 Suppl 3:S104-7. DOI: http://dx.doi.org/10.1016/S0960-9776(11)70305-8
30. Delay E, Gounot N, Bouillot A, Zlatoff P, Rivoire M. Autologous latissimus breast reconstruction: a 3-year clinical experience with 100 patients. Plast Reconstr Surg. 1998;102(5):1461-78. PMID: 9774000 DOI: http://dx.doi.org/10.1097/00006534-199810000-00020
31. Bonomi S, Settembrini F, Salval A, Gregorelli C, Musumarra G, Rapisarda V. Current indications for and comparative analysis of three different types of latissimus dorsi flaps. Aesth Surg J. 2012;32(3):294-302. DOI: http://dx.doi.org/10.1177/1090820X12437783
32. Chang DW, Youssef A, Cha S, Reece OR. Autologous breast reconstruction with the extended latissimus dorsi flap. Plast Reconstr Surg. 2002;110(3):751-9.
33. Munhoz AM, Montag E, Fels KW, Arruda EG, Sturtz GP, Aldrighi C, et al. Outcome analysis of breast-conservation surgery and immediate latissimus dorsi flap reconstruction in patients with T1 to T2 breast cancer. Plast Reconstr Surg. 2005;116(3):741-52. PMID: 16141810 DOI:http://dx.doi.org/10.1097/01.prs.0000176251.15140.36
34. Roy MK, Shrotia S, Holcombe C, Webster DJ, Hughes LE, Mansel RE. Complications of latissimus dorsi myocutaneous flap breast reconstruction. Eur J Surg Oncol. 1998;24(3):162-5. PMID: 9630851 DOI: http://dx.doi.org/10.1016/S0748-7983(98)92810-4
35. Sternberg EG, Perdikis G, McLaughlin SA, Terkonda SP, Waldorf JC. Latissimus dorsi flap remains an excellent choice for breast reconstruction. Ann Plast Surg. 2006;56(1):31-5. PMID: 16374092 DOI: http://dx.doi.org/10.1097/01.sap.0000186463.07617.6f
36. Rios JL, Pollock T, Adams WP Jr. Progressive tension sutures to prevent seroma formation after latissimus dorsi harvest. Plast Reconstr Surg. 2003;112(7):1779-83. PMID: 14663220 DOI: http://dx.doi.org/10.1097/01.PRS.0000090542.68560.69
37. Bailey SH, Oni G, Guevara R, Wong C, Saint-Cyr M. Latissimus dorsi donor-site morbidity: the combination of quilting and fibrin sealant reduce length of drain placement and seroma rate. Ann Plast Surg. 2012;68(6):555-8 PMID: 21629082 DOI: http://dx.doi.org/10.1097/SAP.0b013e318216b65c
38. Brumback RJ, McBride MS, Ortolani NC. Functional evaluation of the shoulder after transfer of the vascularized latissimus dorsi muscle. J Bone Joint Surg. 1992(3);74:377-82. PMID: 1548264 DOI: http://dx.doi.org/10.1097/00005131-199212000-00068
39. Russell RC, Pribaz J, Zook EG, Leighton WD, Eriksson E, Smith CJ. Functional evaluation of latissimus dorsi donor site. Plast Reconstr Surg. 1986;78(3):336-44. DOI: http://dx.doi.org/10.1097/00006534-198609000-00009
40. Dutra AK, Neto MS, Garcia EB, Veiga DF, Netto MM, Curado JH, et al. Patients' satisfaction with immediate breast reconstruction with a latissimus dorsi musculocutaneous flap. J Plast Surg Hand Surg. 2012;46(5):349-53. DOI: http://dx.doi.org/10.3109/2000656X.2012.704726
1. Sociedade Brasileira de Cirurgia Plástica, São Paulo, SP, Brasil
2. Instituto Brasileira de Controle do Câncer, São Paulo, SP, Brasil
3. Sociedade Brasileira de Mastologia, Rio de Janeiro, RJ, Brasil
Instituição: Instituto Brasileiro de Controle do Câncer, São Paulo, SP, Brasil.
Autor correspondente:
Gabriel Salum D'Alessandro
Rua Oscar Freire, 2250, conjunto 408, Pinheiros
São Paulo, SP, Brasil CEP 05409-011
E-mail: dr.gabriel.dalessandro@gmail.com
Artigo submetido: 5/12/2014.
Artigo aceito: 15/3/2015.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter