

Original Article - Year 2014 - Volume 29 -
Influência de dieta imunomoduladora na cicatrização cutânea em ratos
Influence of immunonutritional supplementation on skin wound healing in rats
RESUMO
INTRODUÇÃO: O processo de cicatrização é imediato e dinâmico, com o objetivo de restaurar a continuidade anatômica e funcional, e devem existir condições para esse processo, o que inclui um estado nutricional adequado. Dentre as fórmulas de suplementação existentes, as imunomoduladoras têm sido implicadas na melhora do processo cicatricial e das condições clínicas dos pacientes tratados. Foi avaliada a influência da dieta imunomoduladora (Impact®) sobre diferentes variáveis do processo de cicatrização cutânea.
MÉTODO: Ratos adultos e nutridos foram divididos aleatoriamente em quatro grupos, a serem suplementados com a dieta em estudo e com a dieta controle. Dois grupos receberam as respectivas dietas apenas pré-operatoriamente e os outros dois grupos as receberam no perioperatório. Os ratos foram submetidos a três tipos de lesões cutâneas. Foram avaliados os seguintes aspectos: evolução dos pesos, evolução das áreas cruentas, tensiometria das feridas incisionais, taxas de reepitelização e parâmetros histológicos.
RESULTADOS: Não houve diferença na evolução dos pesos. Houve melhores índices de fechamento de feridas excisionais nos grupos suplementados com Impact®, a partir do quinto dia de pós-operatório (p=0,02). Os grupos suplementados com a dieta em estudo obtiveram melhores resultados em tensiometria (p = 0,03), taxas de reepitelização (0,04), contagem diferencial de células (p<0,001) e quantidade de colágeno total (p<0,001).
CONCLUSÕES: A dieta em estudo (Impact®) promove melhores taxas de fechamento de feridas cruentas, reepitelização mais rápida, cicatrizes com maior resistência tênsil e maiores quantidades de colágeno total nas feridas. Não houve diferença em nenhum dos parâmetros analisados em comparação dos grupos suplementados com Impact® pré e perioperatoriamente.
Palavras-chave: Imunomodulação; Imunonutrição; Cicatrização de feridas; Dieta imunomoduladora.
ABSTRACT
INTRODUCTION: The wound healing process is immediate and dynamic in order to restore anatomical and functional continuity, and there must be conditions for this process, which include a normal nutritional state. Among the existing supplemental formulas, immuno-enhancing diets have been proposed to improve the wound healing process and patients' clinical conditions. The influence of an immunomodulating diet (Impact®) on different variables of the skin healing process was evaluated.
METHOD: Healthy adult rats were randomly divided into four groups of diet supplementation or control. Two groups received their diets only pre-operatively while the other two groups received theirs perioperatively. Rats were subjected to three types of skin lesions. We evaluated the following aspects: changes in weight, development of raw areas, tensiometry of incisional wounds, re-epithelialization rates, and histological parameters.
RESULTS: There was no difference in weight changes. There was better closing rates of excisional wounds in groups supplemented with Impact® beginning on the fifth day after surgery (p = 0.02). The groups receiving the dietary supplements obtained the best results in tensiometry (p = 0.03), re-epithelialization rates (p = 0.04), differential cell counts (p < 0.001), and total amount of collagen (p < 0.001).
CONCLUSIONS: The study diet (Impact®) promoted better closure rates of raw wounds, faster re-epithelialization, scars with a greater tensile strength, and greater amounts of total collagen in wounds. There was no difference in any of the parameters analyzed compared with the groups supplemented with Impact® pre- and perioperatively.
Keywords: Immunomodulation; Immunonutrition; Wound healing; Immunomodulatory diet.
A cicatrização cutânea é um processo dinâmico que envolve uma rede complexa de interações extracelulares, mediadores químicos e células locais e inflamatórias. Este processo tem como objetivos principais a restauração da integridade tissular e a manutenção da homeostasia1.
O processo de cicatrização envolve três fases sequenciais que se inter-relacionam, ocorrendo de forma dinâmica e sobrepostas: fase inflamatória, fase proliferativa e fase de remodelamento2.
Para que ocorra adequada cicatrização, deve existir um conjunto de condições, que incluem boa perfusão tecidual, ausência de debris, sistema imunológico e fibroblástico eficientes e, em pacientes cirúrgicos, adequada técnica cirúrgica3. Além disso, um estado nutricional adequado é fator importante para lograr processo de cicatrização ótimo, pois a dinâmica tecidual exige energia e substratos plásticos provenientes de proteínas e micronutrientes4. A deficiência de proteína, potencialmente presente nas condições de trauma, como queimaduras e cirurgias de grande porte, prejudica o processo de cicatrização, favorecendo maior risco de infecções1,5,6. Fisiologicamente, a depleção proteica no processo cicatricial prolonga a fase inflamatória e prejudica a fibroplasia. Ocorre diminuição da proliferação fibroblástica, da angiogênese e da produção de colágeno, e, consequentemente, ocorre menor reparo tecidual da ferida7.
Na prática clínica, a oferta de nutrientes pode ocorrer por via oral, enteral e parenteral. Nos últimos anos, houve importante desenvolvimento de formulações nutricionais especializadas para atender às necessidades particulares de órgãos e sistemas, disponíveis sob a forma de suplementos orais ou formulações para uso por sondas enterais8-11. Dentre estas, encontram-se fórmulas imunomoduladoras que são hiperproteicas, enriquecidas de arginina e nutrientes antioxidantes, como zinco, selênio, vitaminas C e E, desenhadas para atender às necessidades decorrentes do processo cicatricial e otimizar o seu desenvolvimento.
A utilização de imunonutrientes em fórmulas enterais tem sido objeto de estudos clínicos e experimentais. Atualmente, a terapia nutricional pretende, além de fornecer energia e substratos nutricionais, influenciar, de maneira farmacológica, funções orgânicas prejudicadas pelo estado patológico do paciente, particularmente quando imunossupressão e/ou estado inflamatório exacerbado estão presentes. Nessas condições, a oferta enteral ou parenteral de nutrientes com funções imunomoduladoras se associam a benefícios, como aumento da celularidade e promoção de funções imunológicas7,12-14. A melhora do sistema imunológico com a utilização de nutrientes, como ácidos graxos n-3, arginina e nucleotídeos, tem sido relacionada à diminuição da incidência de complicações infecciosas, especialmente em pacientes submetidos a cirurgias no trato digestivo por câncer e em pacientes vítimas de trauma6,15,16.
Considerando-se que o estado nutricional pode interferir no processo cicatricial e que nutrientes, como arginina e alguns minerais e vitaminas, com efeitos reconhecidamente antioxidantes, podem promover etapas desse processo, torna-se de especial interesse avaliar o real impacto desses nutrientes na cicatrização frente a diferentes condições nutricionais, bem como compreender alguns mecanismos celulares e moleculares envolvidos entre nutrição e cicatrização de feridas. Modelos experimentais são úteis para a pesquisa de cicatrização, pois, resguardando os aspectos éticos, permitem criar, em laboratório de investigação, condições que se assemelham às encontradas na prática clínica.
O campo da nutrição experimentou profundas transformações desde a sua concepção. O princípio inicial era fornecer energia, proteínas e micronutrientes essenciais para compensar perda de massa muscular e prevenir a depleção imune induzida por inanição. Mais recentemente, vários componentes alimentares têm sido utilizados numa tentativa de melhorar a função imunológica. Estes componentes incluem: aminoácidos específicos, tais como glutamina e arginina, ácidos graxos (ômega-3) e os ácidos nucleicos6. Entre estas substâncias, a suplementação com arginina apresenta o composto mais comumente investigado, tendo sido identificado como modulador do processo de cicatrização em vários estudos experimentais17. No entanto, há controvérsia na literatura e resultados conflitantes. Além disso, a maioria dos estudos tem investigado os efeitos de imunonutrição apenas no trato gastrointestinal18.
OBJETIVO
O objetivo deste estudo foi investigar o efeito da suplementação imunonutricional em diferentes aspectos da cicatrização de feridas cutâneas em ratos. O presente trabalho avalia a influência da dieta imunomoduladora em sua forma comercial (Impact®) sobre diferentes variáveis do processo de cicatrização cutânea, incluindo o fechamento de feridas excisionais, a resistência das cicatrizes em feridas incisionais, a reepitelização de feridas cruentas e as diferenciações celulares no tecido cicatricial e da matriz de colágeno neoformada.
MÉTODO
O projeto foi conduzido de acordo com as orientações normativas éticas estabelecidas pelo Colégio Brasileiro de Experimentação Animal (COBEA) e aprovado pelo Comitê de Ética em Pesquisa do Centro de Ciências da Saúde da Universidade Federal do Paraná (UFPR), Curitiba, Brasil. Os experimentos ocorreram no Laboratório do Programa de Pós-Graduação em Cirurgia da Universidade Federal do Paraná, sob temperatura controlada (22 ± 1º C) e 12 h escuro/ciclos de luz.
Um total de 52 ratos Wistar machos adultos (Rattus norvegicus albinus, Roentia Mammalia) (peso corporal 230,08 ± 5,76 g) foi distribuído em quatro grupos de suplementação da dieta (chamados PI, PC, PPI e PPC), de 13 animais cada. Os ratos foram enjaulados em grupos de 4 a 5 animais. Todos os grupos receberam ad libitum acesso à água da torneira e a mesma dieta padrão em sete dias antes do início do experimento e ao longo do estudo, independentemente da suplementação oral com qualquer fórmula imunonutricional (grupos PI e PPI) ou com dieta controle isocalórica e isoproteica (grupos PC e PPC), ambas administradas através de uma sonda orogástrica.
Os ratos foram randomizados para receber diariamente duas fórmulas enterais diferentes (Tabela 1). Nos grupos pré-operatórios (PI e PC), os ratos foram suplementados apenas por sete dias antes da operação, enquanto nos grupos pré e pós-operatórias (PPI e PPC), os ratos foram suplementados durante o período perioperatório (Figura 1), em um total de 14 dias.
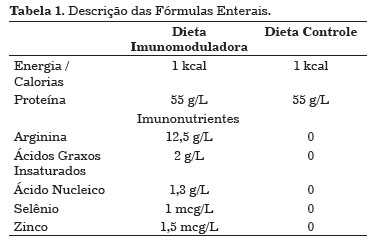

Figura 1. Descrição dos Grupos.
Após sete dias de suplementação com ração pré-operatória, os ratos foram anestesiados e submetidos a três feridas dorsais excisionais da pele de espessura total - uma delas medindo 2 × 2 cm, para avaliação da contração da ferida, e os outros dois de medição de 6 mm de diâmetro, para estudo de reepitelização - e uma ferida incisional ventral medindo 5 cm (Figura 2). Feridas dorsais foram deixadas abertas para cicatrizar espontaneamente. A ferida ventral foi fechada com pontos simples mono nylon 5-0. No oitavo dia pós-operatório, todos os ratos foram sacrificados e as lesões dorsais foram excisadas e armazenadas em solução fisiológica e em formalina 10%, para análise histológica e de resistência à tração, por meio de estudos com hematoxilina - eosina e densitometria do colágeno.
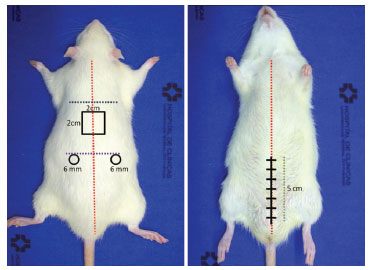
Figura 2. Modelo de Feridas incisionais e excisionais.
Feridas dorsais excisionais de 2 × 2 cm foram diariamente documentadas por fotografias digitais padronizadas, para posterior análise das taxas de contração da ferida com software específico (Figura 3). As áreas das feridas excisionais foram calculadas usando o ImageJ software (National Institutes of Health , EUA).
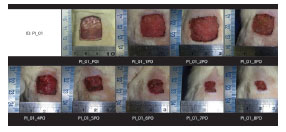
Figura 3. Evolução da Taxa de Contração de Feridas Dorsais Excisionais.
O método de densitometria do colágeno consistiu em identificar e quantificar o colágeno maduro (tipo 1) e imaturo (tipo 3), utilizando-se a colocação de Picrosirius Red, microscopia ótica sob luz polarizada e realizando-se análise de imagens em software (Image-Pro-Plus 4.5; Mídia cibernética, São Paulo, Brasil). A percentagem de componentes de colágeno apresentados em vermelho e laranja (colágeno tipo 1) e verde (colágeno tipo 3), em seguida, foi calculada.
Os espécimes da ferida abdominal tiveram ambas as extremidades ligadas a um tensiômetro (DL-500 MF; Emic, São José dos Pinhais, PR) e que os distenderam a uma velocidade constante (50 mm/min com uma carga de 10 kg, 0,5% de erro), de acordo com a técnica proposta por Knolmayer et al.19 Mudanças na resistência à tração foram continuamente registradas em um computador e analisadas por software específico (Instron, IX, 7.26.00). O alongamento foi mantido até que o espécime fosse completamente rompido, como refletido por uma queda acentuada na curva de tensão a zero (interrupção). O valor máximo representou a força de ruptura total (TRS) . Assim, duas variáveis relacionadas a tensões que refletem a força da anastomose foram obtidas para cada rato.
Os dados foram mostrados como média e desvio padrão (SD). Testes T Student e Anova foram utilizados para comparações intergrupais. A significância estatística foi definida como a probabilidade de um erro do tipo de < 5%%.
RESULTADOS
O peso corporal não se alterou de forma significativa nos grupos ao longo do estudo (Figura 4).

Figura 4. Evolução do peso durante o experimento (peso em gramas).
As áreas das feridas excisionais foram avaliadas em diferentes momentos pós-operatórios. A área da ferida criada pelo procedimento inicial foi semelhante nos grupos controle e estudo (PI = 4,52 cm2; PC = 4,30 cm2; PPI = 4,50 cm2; PPC = 4,25 cm2, p = 0,21). As avaliações das taxas de contração da ferida mostraram uma contração mais rápida nos grupos que receberam a fórmula imunomoduladora após o terceiro dia pós-operatório (Figura 5). A comparação entre os dois grupos que receberam o suplemento com a fórmula imunomoduladora não mostrou diferença significativa (p > 0,05)
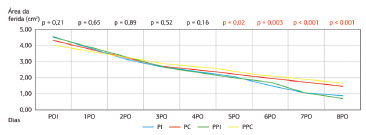
Figura 5. Taxa de contração da ferida.
A resistência à tração foi analisada e os grupos que receberam a fórmula imunomoduladora mostrou o aumento da força de tração máxima em comparação com os controles. Os dois grupos demonstraram uma resistência à tração semelhante (p > 0,05) (Figura 6).
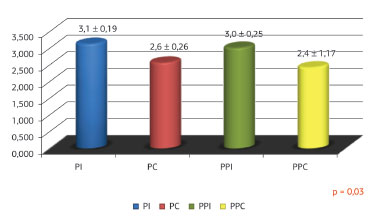
Figura 6. Taxas de Força Tênsil dos Tecidos.
A análise revelou que as taxas de reepitelização nos grupos suplementados demonstraram restauração completa da camada epitelial no sétimo dia pós-operatório, em um maior número de casos (p = 0,04), em comparação com ratos do grupo controle (Figura 7).
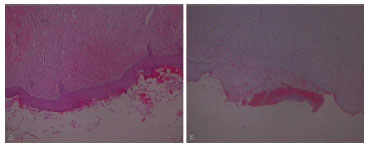
Figura 7. (A) Exemplos de completa reepitelização histológica e (B) reepitelização incompleta.
A análise da deposição de colágeno em feridas excisionais no oitavo dia de pós-operatório mostrou taxas semelhantes de maturação (proporção de colágeno maduro e imaturo) com p = 0,38 . No entanto, os grupos suplementados com fórmula imunomoduladora apresentaram uma maior quantidade de deposição de colágeno total (p = 0,001).
DISCUSSÃO
A cicatrização de feridas depende de uma complexa série de reações e interações de mediadores inflamatórios. Muitos fatores intrínsecos e extrínsecos afetam a cicatrização de feridas e há algumas opções comerciais que pretendem neutralizar interferências negativas no processo de cura2,19,20. A inter-relação entre a nutrição e o processo de cicatrização das feridas, especificamente agindo em conjunto com o sistema imunológico, tem sido o foco de atenção cada vez maior e um número crescente de aminoácidos e minerais foram identificados como tendo a função imunomoduladora21.
O sistema de defesa imunológico pode ser subdividido em três locais de ação, que são alvos potenciais para substratos nutricionais específicos: a função de barreira da mucosa, funções de defesa celular e inflamação local ou sistêmica . A barreira mucosa foi o primeiro local de defesa considerado para terapia imunomoduladora11. A segunda linha de defesa consiste de defesa celular (macrófagos, granulócitos, linfócitos) e que pode ser modulada por substratos nutritivos, ao influenciar a transdução de sinal. Os componentes essenciais da resposta imune inflamatória são representados pela ativação dos sistemas de cascata (como o coagulante e os sistemas complementares). Citocinas, eicosanoides, fatores de ativação de plaquetas e óxido nítrico , assim como aminas vasoativas, são alguns dos mediadores envolvidos22.
A resposta imune inflamatória pode ser regulada por substratos nutricionais e os seus precursores, os quais estão disponíveis na suplementação oral. As fórmulas imunomoduladoras utilizam estes diferentes sítios de ação do sistema imunológico para controlar a inflamação e aumentar a cicatrização de feridas23. Glutamina, arginina, nucleotídeos e ácidos graxos poli-insaturados (PUFA) são considerados de importância fundamental, entre todos os agentes farmacologicamente eficazes incluídos, assim como micronutrientes, como zinco e várias vitaminas (A, C, E, K).
A arginina é responsável pela modulação de várias funções biológicas, imunológicas e metabólicas diferentes. Depois de trauma, por exemplo, há um aumento do metabolismo deste aminoácido essencial12. O catabolismo não biodisponibiliza quantidades suficientes de arginina e óxido nítrico (NO), característica de pacientes traumatizados graves, o que consiste na principal razão para a suplementação de arginina em tais situações24. Estudos experimentais sugerem a participação de óxido nítrico no processo de remodelação de feridas13. A arginina atua como um substrato para a síntese da proteína, a proliferação celular, a neurotransmissão, a vasodilatação, a imunidade e a cicatrização de feridas. É também um precursor de óxido nítrico, ureia, ornitina, prolina e outras moléculas, e tem um papel importante na síntese de colágeno25. Em situações de estresse, há demanda metabólica dos aumentos de arginina e sua suplementação é considerada um adjuvante na cicatrização de feridas8.
Os ácidos graxos poli-insaturados (PUFA) alteraram a produção de citocinas pró-inflamatórias. Os ácidos graxos n-3 influenciam uma série de processos inflamatórios de transdução de sinal para a expressão da proteína de ácido eicosapentaenoico (EPA) e ácido docosahexanoico (DHA), e competem com quatro séries de leucotrienos (LTB4) na ocupação do receptor26. Numerosos estudos mostram a correlação entre o aumento dos níveis de ácidos graxos poli-insaturados ω - 3 e a produção diminuída de citocinas pró-inflamatórias no plasma, mas alguns estudos têm demonstrado aumento na produção de certas citocinas pró-inflamatórias em células, tais como fibroblastos e macrófagos peritoneais tratados com ácidos graxos poli-insaturados ω - 3.
As fórmulas imunomoduladoras foram identificadas como vantajosas na cicatrização de feridas em estudos clínicos5,15,16,18. No entanto, os mecanismos responsáveis por este efeito na reparação dos tecidos não são completamente conhecidos. O presente estudo mostrou melhores índices de contração da ferida e deposição de colágeno nos grupos que receberam a fórmula imunomoduladora a partir do segundo dia de suplementação em diante, provavelmente por causa do aumento da função fibroblástica. Embora os resultados deste estudo tenham demonstrado vários efeitos positivos da imunomodulação nutricional, a maioria dos mecanismos celulares permanece obscura e precisa ser elucidada para esclarecer a influência de fórmulas imunomoduladoras no processo de cicatrização de feridas.
CONCLUSÃO
O uso de fórmulas imunomoduladoras acelerara o processo de cicatrização com o aumento da deposição de colágeno e da força tênsil dos tecidos. A imunomodulação nutricional se mostrou benéfica em vários ensaios clínicos, previamente. No entanto, os mecanismos celulares para a melhoria dos processos de cicatrização de feridas permanecem obscuros e outros estudos experimentais com fórmulas imunomoduladoras são necessários.
REFERÊNCIAS
1. Nguyen TT, Gilpin DA, Meyer NA, Herndon DN. Current treatment of severely burned patients. Ann Surg. 1996;223(1):14-25. http://dx.doi.org/10.1097/00000658-199601000-00004. PMid:8554414
2. Gurtner GC, Werner S, Barrandon Y, Longaker MT. Wound repair and regeneration. Nature. 2008;453(7193):314-21. http://dx.doi.org/10.1038/nature07039. PMid:18480812
3. Broughton G, Janis JE, Attinger CE. Wound healing: an overview. Plast. Reconstr. Surg. [Internet]. 2006; 117(Supl 7):1e-S-32e-S [cited 2013 Nov 8]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/16801750.
4. Fürst P. Old and new substrates in clinical nutrition. J. Nutr. Am Soc Nutrition. 1998;128(5):789-96.
5. Gianotti L, Braga M, Nespoli L, Radaelli G, Beneduce A, Di Carlo V. A randomized controlled trial of preoperative oral supplementation with a specialized diet in patients with gastrointestinal cancer. Gastroenterology. 2002;122(7):1763-70. http://dx.doi.org/10.1053/gast.2002.33587. PMid:12055582
6. McCowen KC, Bistrian BR. Immunonutrition: problematic or problem solving? Am J Clin Nutr. 2003;77(4):764-70. PMid:12663270.
7. Suchner U, Kuhn KS, Fürst P. The scientific basis of immunonutrition. Proc Nutr Soc. 2000;59(4):553-63. http://dx.doi.org/10.1017/S0029665100000793. PMid:11115790
8. Campos ACL, Groth AK, Branco AB. Assessment and nutritional aspects of wound healing. Curr Opin Clin Nutr Metab Care. 2008;11(3):281-8. http://dx.doi.org/10.1097/MCO.0b013e3282fbd35a. PMid:18403925
9. da Costa MAR, Campos ACL, Coelho JCU, de Barros AM, Matsumoto HM. Oral glutamine and the healing of colonic anastomoses in rats. JPEN J Parenter Enteral Nutr. 2003;27(3):182-56. http://dx.doi.org/10.1177/0148607103027003182. PMid:12757111
10. Debats IBJG, Wolfs TGAM, Gotoh T, Cleutjens JPM, Peutz-Kootstra CJ, van der Hulst RRWJ, et al. Role of arginine in superficial wound healing in man. Nitric Oxide. Elsevier Inc. 2009;21(3-4):175-83. http://dx.doi.org/10.1016/j.niox.2009.07.006.
11. Gardiner KR, Kirk SJ, Rowlands BJ. Novel substrates to maintain gut integrity. Nutr Res Rev. 1995;8(1):43-66. http://dx.doi.org/10.1079/NRR19950006. PMid:19094279
12. Stechmiller JK, Childress B, Cowan L. Arginine supplementation and wound healing. Nutr Clin Pract. 2005;20(1):52-61. http://dx.doi.org/10.1177/011542650502000152. PMid:16207646
13. Agren MS, Franzén L. Influence of zinc deficiency on breaking strength of 3-week-old skin incisions in the rat. Acta Chir Scand. 1990;156(10):667-70. PMid:2264423.
14. Shi HP, Efron DT, Most D, Tantry US, Barbul A. Supplemental dietary arginine enhances wound healing in normal but not inducible nitric oxide synthase knockout mice. Surgery. 2000;128(2):374-8. http://dx.doi.org/10.1067/msy.2000.107372. PMid:10923019
15. Braga M, Gianotti L, Cestari A, Vignali A, Pellegatta F, Dolci A, et al. Gut function and immune and inflammatory responses in patients perioperatively fed with supplemented enteral formulas. Arch Surg. 1996;131(12):1257-65. http://dx.doi.org/10.1001/archsurg.1996.01430240011001. PMid:8956766
16. Braga M, Gianotti L, Vignali A, Schmid A, Nespoli L, Di Carlo V. Hospital resources consumed for surgical morbidity: effects of preoperative arginine and omega-3 fatty acid supplementation on costs. Nutrition. 2005;21(11-12):1078-86. http://dx.doi.org/10.1016/j.nut.2005.05.003. PMid:16308130
17. Debats IBJG, Booi DI, Wehrens KME, Cleutjens J, Deutz NEP, van de Hogen E, et al. Oral arginine supplementation and the effect on skin graft donor sites: a randomized clinical pilot study. J Burn Care Res. 2009;30(3):417-26. http://dx.doi.org/10.1097/BCR.0b013e3181a28c15. PMid:19349894
18. Wu GH, Zhang YW, Wu ZH. Modulation of postoperative immune and inflammatory response by immune-enhancing enteral diet in gastrointestinal cancer patients. World J Gastroenterol. 2001;7(3):357-62. PMid:11819790.
19. Knolmayer TJ, Cornell KM, Bowyer MW, McCullough JS, Koenig W. Imbrication versus excision for fascial healing. Am J Surg. 1996;172(5):506-11. http://dx.doi.org/10.1016/S0002-9610(96)00229-2. PMid:8942554
20. Coelho-Lemos ICM, Campos ACL, de Almeida M, Schüler SL, Gurmini J, Malafaia O, et al. In utero malnutrition influences wound healing of newborn rats as measured by tensile strength and collagen deposition. JPEN J Parenter Enteral Nutr. 2004;28(4):241-45. http://dx.doi.org/10.1177/0148607104028004241. PMid:15291405
21. Williams JZ, Abumrad N, Barbul A. Effect of a specialized amino acid mixture on human collagen deposition. Ann Surg. 2002;236(3):369-75. http://dx.doi.org/10.1097/00000658-200209000-00013. PMid:12192323
22. Calder PC. Glutamine and the immune system. Clin Nutr. 1994;13(1):2-8. http://dx.doi.org/10.1016/0261-5614(94)90003-5. PMid:16843345
23. Raman M, Ambalam P, Kondepudi KK, Pithva S, Kothari C, Patel AT, et al. Potential of probiotics, prebiotics and synbiotics for management of colorectal cancer. Gut Microbes. Am Soc Nutrition. 2000;4(3):181-92.
24. Shi HP, Fishel RS, Efron DT, Williams JZ, Fishel MH, Barbul A. Effect of supplemental ornithine on wound healing. J Surg Res. 2002;106(2):299-302. http://dx.doi.org/10.1006/jsre.2002.6471. PMid:12175982
25. Morlion BJ, Stehle P, Wachtler P, Siedhoff HP, Köller M, König W, et al. Total parenteral nutrition with glutamine dipeptide after major abdominal surgery: a randomized, double-blind, controlled study. Ann Surg. 1998;227(2):302-8. http://dx.doi.org/10.1097/00000658-199802000-00022. PMid:9488531
26. Grimm H, Mayer K, Mayser P, Eigenbrodt E. Regulatory potential of n-3 fatty acids in immunological and inflammatory processes. Br J Nutr. 2002;87(Supl 1):S59-67. http://dx.doi.org/10.1079/BJN2001457. PMid:11895155
1. Doutora em Clínica Cirúrgica pela Universidade Federal do Paraná (UFPR), Professora da Disciplina de Cirurgia Plástica e Reparadora da Universidade Federal do Paraná (UFPR), Curitiba, PR, Brasil
2. Chefe do Serviço de Cirurgia Plástica e Reparadora da Universidade Federal do Paraná (UFPR), Professor Associado I da Universidade Federal do Paraná (UFPR), Curitiba, PR, Brasil
3. Mestre em Clínica Cirúrgica pela Universidade Federal do Paraná (UFPR), Médico Cirurgião do Aparelho Digestivo, Curitiba, PR, Brasil
4. Doutora e Mestre em Clínica Cirúrgica pela Universidade Federal do Paraná (UFPR), Coordenadora Clínica na Equipe Multiprofissional de Terapia Nutricional (EMTN), Centro de Pesquisas Oncológicas de Florianópolis (CEPON), Curitiba, PR, Brasil
5. Mestranda em Clínica Cirúrgica pela Universidade Federal do Paraná (UFPR), Cirurgiã Geral pela Universidade Federal do Paraná (UFPR), Residente em Cirurgia Plástica e Reparadora no Hospital de Clínicas da Universidade Federal do Paraná (UFPR), Curitiba, PR, Brasil
6. Mestre e Doutor em Clínica Cirúrgica pela Universidade Federal do Paraná (UFPR), Professor Titular e Coordenador do Programa de Pós-Graduação em Clínica Cirúrgica da Universidade Federal do Paraná (UFPR), Professor Adjunto do Departamento de Nutrição da Universidade Federal do Paraná (UFPR), Curitiba, PR, Brasil
Instituição: Trabalho realizado como parte do Programa de Pós-Graduação em Clínica Cirúrgica da Universidade Federal do Paraná, Curitiba, PR, Brasil.
Autor correspondente:
Maria Cecília Closs Ono
Universidade Federal do Paraná, Serviço de Cirurgia Plástica e Reparadora Alto da Glória
Rua General Carneiro, 181, 9º andar, Setor de Cirurgia Plástica
Curitiba, PR, Brasil CEP 80060-900
Tel.: (41) 3360-7952
E-mail: mccono@gmail.com
Artigo submetido: 10/03/2014.
Artigo aceito: 03/08/2014.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter