

Original Article - Year 2014 - Volume 29 -
Abordagem terapêutica da síndrome de parry-romberg baseada em um sistema de classificação de gravidade
Therapeutic approTherapeutic Approach To The Parry-Romberg Syndrome Based On A Severity Grading System
RESUMO
INTRODUÇÃO: Síndrome de Parry-Romberg (SPR) é caracterizada pela atrofia hemifacial progressiva que, muitas vezes, resulta em graves distúrbios estéticos e funcionais. Embora existam escalas de gravidade, nenhuma delas é completamente ideal para auxiliar na abordagem terapêutica destes pacientes. O objetivo deste estudo foi delinear as estratégias cirúrgicas para o tratamento da SPR baseado em um novo sistema de classificação de gravidade da doença.
MÉTODO: Trata-se de uma análise retrospectiva dos pacientes com SPR operados em 2005-2011. As abordagens cirúrgicas foram individualizadas de acordo com a escala de gravidade clínica baseada na evolução da doença: tipos I (envolvimento da epiderme, derme e tecido subcutâneo); II (tipo I + envolvimento muscular); e III (tipo I + II + envolvimento ósseo). Quatro (28,57%) pacientes com SPR tipo I, 6 (42,85%) tipo II e 4 (28,57%) tipo III foram incluídos.
RESULTADO: Um total de 47 procedimentos foi realizado. Gordura livre foi enxertada em todos os pacientes. Todos os pacientes do tipo II e 1 (25%) do tipo III foram submetidos a enxertos dermogordurosos. Enxertos ósseos com retalhos de fáscia têmporo-parietal foram aplicados no tratamento de todos os pacientes do tipo III. Um (25%) paciente do tipo III foi submetido à cirurgia ortognática. Houve melhora global na aparência facial em todos os pacientes, sem complicações relacionadas aos procedimentos.
CONCLUSÃO: O sistema de classificação de gravidade proposto para a SPR pode facilitar a decisão terapêutica e resultados parcialmente satisfatórios podem ser alcançados com a combinação de técnicas cirúrgicas de acordo com a gravidade da doença.
Palavras-chave: Síndrome de Parry-Romberg; Atrofia facial progressiva; Tratamento cirúrgico; Sistema de classificação.
ABSTRACT
INTRODUCTION: The Parry-Romberg Syndrome (PRS) is characterized by progressive hemifacial atrophy that often leads to severe esthetic and functional difficulties. Although there are systems for grading disease severity, none have proven ideal in optimizing the therapeutic approach to these patients. This study aimed to establish the surgical strategies for the treatment of PRS based on a new system for severity grading of the disease.
METHODS: This retrospective study included PRS patients undergoing surgery between 2005 and 2011. The surgical strategies were adapted for each patient according to a clinical severity grading system based on disease progression: type I, affecting the epidermis, dermis, and subcutaneous tissue; type II, type I + muscle involvement; and type III, Types I+ II + bone involvement. The sample included four patients (28.57%) with PRS type I, six patients (42.85%) with PRS type II, and four patients (28.57%) with PRS type III.
RESULTS: Forty-seven procedures were performed. Free-fat grafts were used in all patients. Dermal fat grafts were used in all type II patients and one type III patient (25%). Bone grafts with temporoparietal fascia flaps were performed for the treatment of all type III patients. One type III patient (25%) underwent orthognathic surgery. All patients were improved in their overall facial appearance and there were no procedure-related complications.
CONCLUSION: Our proposed system for grading PRS severity can facilitate the choice of therapeutic approaches and with a combination of surgical techniques based on the severity of the disease partially satisfactory outcomes can be attained.
Keywords: Parry-Romberg syndrome; Progressive hemifacial atrophy; Surgical treatment; Grading system.
Síndrome de Parry-Romberg (SPR), também conhecida como atrofia hemifacial progressiva, é um raro distúrbio craniofacial de etiologia desconhecida caracterizado principalmente pela atrofia hemifacial progressiva, que afeta pele, tecido subcutâneo, músculos, nervos, cartilagem, e, menos frequentemente, o arcabouço ósseo1,2. Tais alterações, muitas vezes, resultam em faces tridimensionalmente assimétricas associadas com graves complicações funcionais e psicológicas1,2. De tal modo, as cirurgias craniofaciais com o intuito de restaurar a simetria facial tornam-se essenciais no contexto da reabilitação integral desses pacientes1,3. No entanto, mesmo existindo três escalas de gravidade da SPR, descritas até o momento4-6, não há consenso sobre qual tratamento cirúrgico deve ser empregado em cada grau de gravidade1,3-6.
Portanto, o objetivo do presente estudo foi delinear as estratégias cirúrgicas craniofaciais para a abordagem da SPR de acordo com um sistema de classificação de gravidade.
MÉTODO
Trata-se de um estudo retrospectivo de todos os pacientes com SPR tratados, cirurgicamente, no Hospital SOBRAPAR entre 2005 e 2011. Todos os aspectos relacionados às intervenções cirúrgicas foram verificados por meio da análise dos registros médicos, fotografias e entrevistas clínicas. Pacientes com atrofia de face com origem esclarecida (por exemplo, sequelas de trauma, queimadura ou tumores craniofaciais), registros médicos incompletos e/ou com perda do seguimento pós-operatório foram excluídos.
Quatorze pacientes, diagnosticados com SPR, preencheram os critérios de inclusão. Os pacientes tinham em média 19,4 anos de idade. Onze (78,57%) pacientes eram do sexo feminino e 3 (21,43%) do sexo masculino. Onze (78,57%) pacientes tinham acometimento do lado direito da face, 2 (14,29%) do lado esquerdo e 1 (7,14%) bilateral.
Intervenções cirúrgicas
Os quatro procedimentos cirúrgicos (enxerto de gordura livre7,8; enxerto dermogorduroso9; enxerto ósseo da calota craniana com retalho de fáscia têmporo-parietal - RFTP10,11; e cirurgia ortognática12) utilizados, para corrigir as deformidades craniofaciais dos pacientes com SPR, foram detalhados previamente.
Enxerto de gordura livre7,8: a obtenção, a preparação e a injeção do enxerto de gordura livre foram baseadas na técnica descrita por Coleman7. Uma cânula de 2-3 mm de diâmetro conectada a uma seringa de 10 ml com sucção manual (pressão negativa) foi utilizada para obter o tecido adiposo da parte inferior do abdome (primeira escolha) ou na região medial da coxa. O aspirado obtido foi centrifugado durante 2 minutos a 2000 rpm. Após a remoção do sobrenadante, a gordura foi transferida para seringas de 1 ml e então injetada nas regiões faciais afetadas. Múltiplos pontos de acesso, múltiplos túneis e múltiplas camadas foram usados para transferir pequenas alíquotas de gordura, em várias profundidades, das regiões faciais hipoplásicas. Aproximadamente 0,1 ml de gordura foram depositados em cada passagem da cânula.
Enxerto dermogorduroso9: demarcou-se a região abdominal inferior com maior eixo na posição horizontal. Essa área foi desepitelizada (com espessura total), sendo a aponeurose do músculo reto abdominal o limite inferior dessa dissecção. O enxerto dermogorduroso foi cortado em formato triangular e então introduzido na região facial comprometida, tomando-se o cuidado para que o descolamento facial fosse mínimo.
Enxerto ósseo da calota craniana com RFTP10,11: a artéria temporal superficial foi cuidadosamente demarcada em todo o seu trajeto. A incisão do couro cabeludo foi inicialmente realizada na porção mais distal em relação ao início da artéria temporal superficial. A elevação do couro cabeludo ocorreu no plano subcutâneo em direção à orelha. Após a completa elevação do retalho cutâneo de couro cabeludo, visualizou-se o pedículo axial do retalho. A fina fáscia temporal superficial foi então elevada em todo o trajeto. Em seguida, uma dissecção subgaleal foi completada. O retalho periosteal foi marcado e elevado para expor o osso frontal e o cone orbital. Uma craniotomia foi realizada na região parietal. O osso parietal de espessura total foi dividido. Uma incisão subciliar com exposição zigomático-maxilar permitiu a fixação adequada de tiras de enxertos ósseos com parafusos de 1,5mm à região receptora hipoplásica. O enxerto da tábua óssea externa foi devolvido à região parietal doadora. O RTPF foi então rodado para a área do defeito facial recobrindo os enxertos ósseos.
Escala de gravidade clínica
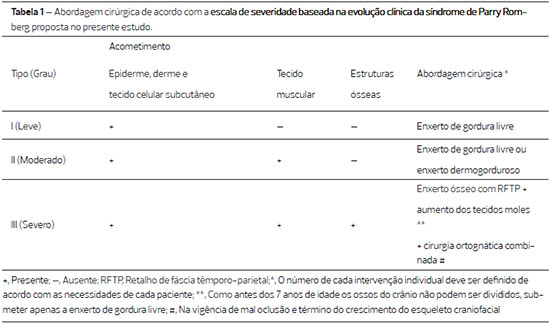
Todas as abordagens cirúrgicas foram individualizadas de acordo com a escala de gravidade clínica proposta por nosso grupo. A distinção, entre os três graus de gravidade da doença, foi baseada em fotografias, exames clínicos, radiográficos e tomográficos: leve (tipo I), definido como o envolvimento da epiderme, derme e tecido subcutâneo; moderado (tipo II), definido como o envolvimento da epiderme, derme e tecido subcutâneo, associado ao acometimento do tecido muscular; e grave (tipo III), definido como o envolvimento da epiderme, derme, tecidos subcutâneo e muscular e também do acometimento ósseo (Tabela 1). Baseado nessa escala de gravidade, 4 (28,57%) pacientes foram classificados como tipo I, 6 (42,85%) como tipo II e 4 (28,57%) como tipo III.
Avaliação dos resultados cirúrgicos craniofaciais
Os resultados cirúrgicos foram avaliados por um único cirurgião plástico que não teve contato prévio com os pacientes. Para isso, fotografias (vistas frontal, oblíqua e perfil) pré-operatórias (dias ou semanas antes do primeiro procedimento cirúrgico) e pós-operatórias (12-14 meses após o último procedimento cirúrgico reportado no presente estudo) das faces de todos os pacientes foram classificadas de acordo com uma escala sobre o grau de melhora da simetria facial previamente utilizada na SPR8; a) resultado satisfatório: face simétrica sem a necessidade de qualquer intervenção adicional; b) resultado parcialmente satisfatório: melhora global da aparência facial, entretanto a assimetria facial ainda pode ser detectada por meio de uma avaliação minuciosa; e c) resultado insatisfatório: ausência de melhora perceptível da simetria facial após as intervenções cirúrgicas.
RESULTADOS
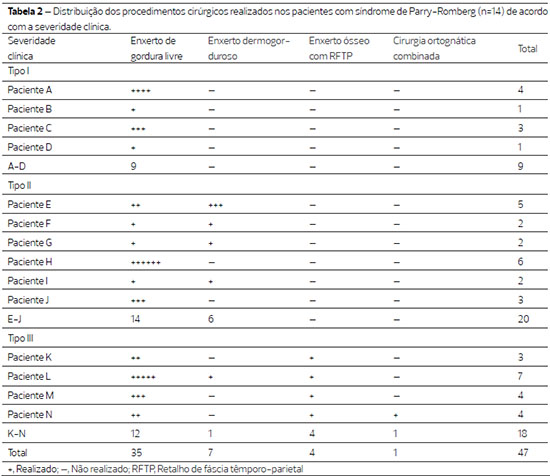
As indicações para os procedimentos cirúrgicos foram assimetria/deformidade facial (100%), hipoplasia dos tecidos moles (71,43%) e hipoplasia dos tecidos moles e ósseos (28,57%). Um total de 47 intervenções cirúrgicas, craniofaciais, foram realizadas de acordo com a gravidade clínica dos doentes e também com as alterações observadas nos tecidos moles nas avaliações realizadas nos períodos pós-operatórios. O número de cirurgias realizadas em cada paciente foi variável (1 a 6 procedimentos/paciente). A média de intervenções por paciente: nos pacientes com SPR do tipo I foi de 2,5 procedimentos/paciente, no tipo II foi de 3,33 procedimentos/paciente e no tipo III foi de 4,5 procedimentos/paciente. Todos os pacientes (tipo I: 1 a 4 procedimentos/paciente; tipo II: 1 a 6; e tipo III: 2 a 5) foram submetidos a enxertos de gordura livre em determinados momentos do acompanhamento. Cinco (35,71%) pacientes (tipo I: nenhum procedimento/paciente; tipo II: 1 a 3; e tipo III: 1) foram submetidos a enxertos dermogordurosos, quatro (28,57%) a enxertos ósseos com RFTP (tipos I e II: nenhum procedimento/paciente; e tipo III: 1) e um (7,14%) foi submetido à cirurgia ortognática (tipos I e II: nenhum procedimento/paciente; e tipo III: 0,25) (Tabela 2).
Com diferentes combinações entre as modalidades cirúrgicas, obteve-se uma melhora global da aparência facial (resultado parcialmente satisfatório) de todos os doentes (Figuras 1-5). Nesta série, não houve resultado satisfatório ou insatisfatório de acordo com a escala descrita por Xie et al8. Um grau variável de absorção de gordura foi encontrado após enxerto de gordura livre. Não houve infecção ou necrose em nenhum dos enxertos dermogordurosos ou enxertos ósseos com RTPF. Também não foram observadas complicações nas áreas doadoras.
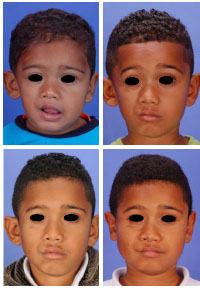
Figura 1 - (Acima, esquerda) Fotografia frontal pré-operatória de um paciente com síndrome de Parry-Romberg tipo I com 3 anos de idade e no início da manifestação da doença (Tabela 2, paciente D). (Acima, direita) Fotografia frontal do mesmo paciente, dois anos após, mostrando a lenta progressão da doença neste caso específico. (Abaixo, esquerda) Aos 7 anos de idade o paciente foi submetido a inclusão de gordura livre na hemiface e otoplastia para correção de orelhas proeminentes. (Abaixo, direita) Dois anos após a cirurgia o paciente apresentou resultado estético satisfatório com manutenção do volume da hemiface direita sem sinais de recidiva da deformidade das orelhas.
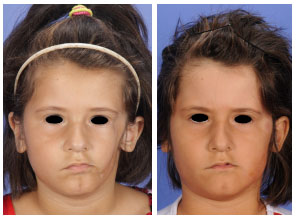
Figura 2 - (Esquerda) Fotografia frontal pré-operatória de uma paciente com síndrome de Parry-Romberg tipo II com 6 anos de idade (Tabela 2, paciente J). (Direita) Fotografia frontal pós-operatória, da mesma paciente, três anos após a primeira cirurgia de inclusão de gordura livre na hemiface esquerda.

Figura 3 - (Esquerda) Fotografia obliqua pré-operatória da mesma paciente da Figura 2. Nota-se uma mancha hipercrômica no terço médio da face da criança. (Direita) Fotografia obliqua pós-operatória da mesma paciente evidenciando melhora significativa da atrofia facial e da mancha hipercrômica que se estendia em todo terço médio da face da criança.
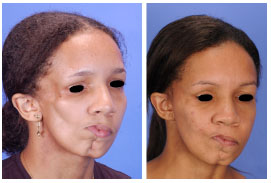
Figura 4 - (Esquerda) Fotografia frontal pré-operatória de uma paciente com síndrome de Parry-Romberg tipo III (Tabela 2, paciente N). (Direita) Fotografia frontal pós-operatória da mesma paciente após a seguinte sequencia de cirurgias: enxerto de gordura livre, enxertos ósseos da região parietal com rotação de retalho de fáscia temporal superficial sobre os enxertos ósseos, cirurgia ortognática combinada e enxerto de gordura livre.
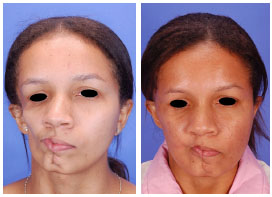
Figura 5 - (Esquerda) Fotografia obliqua pré-operatória da mesma paciente da Figura 4. Nota-se a atrofia facial severa. (Direita) Fotografia obliqua pós-operatória da mesma paciente evidenciando melhora significativa da atrofia facial.
DISCUSSÃO
A SPR é um distúrbio craniofacial de etiologia indefinida que atinge preferencialmente o sexo feminino, sendo que em 95% dos casos ocorre o acometimento unilateral da face.Seu início é geralmente na primeira ou segunda décadas de vida, existindo uma fase ativa com duração entre 2 e 10 anos, antes da estabilização clínica1,2.
Dois sistemas de classificação mexicanos4,5 e um chinês6 vêm sendo utilizados para estratificar a gravidade clínica da SPR. A classificação de Iñigo et al.4 se baseia no envolvimento dos tecidos na região do nervo trigêmeo (dermátomos), enquanto as classificações de Guerrerosantos et al.5 e Hu et al.6 são baseadas apenas no envolvimento tecidual. Aqui, propomos uma escala de gravidadebaseada na progressão clínica da doença, em associação com o envolvimento anatômico, independentemente do dermátomo afetado.
A SPR aparentemente começa com atrofia da epiderme, derme e tecido subcutâneo, subsequentemente progredindo para os músculos faciais, seguindo-se o envolvimento ósseo1,2. Até onde se sabe, não há relato de comprometimento ósseo sem doença dos tecidos moles sobrejacentes na literatura pertinente. Na verdade, vem sendo descrito que existe uma estreita correlação entre o envolvimento do arcabouço ósseo e a gravidade da atrofia facial e que a restrição imposta pelas partes moles anormais determina distúrbios do crescimento esquelético13. Desse modo, o tipo III representaria a progressão dos tipos I e II e o tipo II representaria a progressão do tipo I; esses graus de gravidade da doença coincidem com a própria evolução da doença e, portanto, tornam essa classificação lógica e funcional. Além disso, essa classificação pode orientar a abordagem terapêutica dos pacientes com SPR.
É importante destacar que o presente sistema de classificação foi baseado apenas na análise de 14 pacientes com SPR e possui suporte em estudos4-6 que incluíram um número limitado de doentes. Desse modo, a realização de estudos multicêntricos com a inclusão de um grande número de pacientes deve ser estimulada com o intuito de melhor caracterizar a evolução clínica da SPR e, portanto, ratificar ou não os nossos achados.
Como a SPR, geralmente, se apresenta com deformidades craniofaciais tridimensionais, a restauração da simetria facial completa, muitas vezes, é difícil de ser atingida3-6. Ademais, até o momento, não há unanimidade em relação ao tratamento cirúrgico ideal para o amplo espectro de hipoplasia dos tecidos moles e ósseos da SPR, embora várias opções terapêuticas (enxertos de gordura livre, dermogordurosos, cartilaginosos e ósseos, retalhos musculares e implantes aloplásticos) tenham sido descritas para aumentar o volume perdido com a atrofia facial progressiva1,3-6,14-19.
A fase clínica (ativa ou estabilização) é um aspecto relevante no tratamento cirúrgico da SPR. Na literatura, não existe consenso sobre a fase ideal para corrigir cirurgicamente esses doentes6,8,18. Tradicionalmente, os procedimentos cirúrgicos têm sido efetuados apenas após a estabilização da atrofia facial6,8,18. Entretanto, é importante salientar que o tempo para a estabilização da progressão da doença é variável e imprevisível14,16 e, portanto, as crianças portadoras de SPR podem ter dificuldades psicossociais principalmente no contato com seus pares (por exemplo, na escola) com impacto direto na qualidade de vida, enquanto aguardam a correção cirúrgica14. Nesse âmbito, nosso grupo e outros14,16 tem defendido a necessidade de intervenções cirúrgicas craniofaciais mais precoces, especialmente em crianças com deformidades craniofaciais que, sem correção, podem culminar em problemas psicossociais e dificuldades de aprendizagem e também afetar as diferentes esferas da qualidade de vida (por exemplo, capacidade física, nível de independência e relações sociais) durante um período crítico de desenvolvimento14.
Nos centros de cirurgia craniofacial, os protocolos de tratamento das hipoplasias craniofaciais são norteados principalmente pelo crescimento facial e necessidades funcionais do paciente20. Além disso, a abordagem terapêutica bem sucedida requer um tratamento individualizado com a realização de procedimentos reconstrutivos tanto da deficiência de tecidos moles quanto de tecidos ósseos com intervalos de tempo específicos20. Transferindo esses princípios para o âmbito da SPR, de um modo geral, a abordagem terapêutica vem sendo realizada com um procedimento cirúrgico único ou com procedimentos combinados1,2. Nesse contexto, nosso grupo e outros4-6,14,15,17 têm tratado os pacientes de acordo com a gravidade da atrofia dos tecidos4-6,14,16 e também sua idade14,15.
Recentemente, um algoritmo terapêutico para abordar a hipoplasia dos tecidos moles dos pacientes com SPR foi descrito; no entanto, não houve estratificação da abordagem terapêutica no que tange aos defeitos ósseos desses doentes15. Naqueles pacientes com gravidade tipo III, contudo, o aumento dos tecidos moles por si só não é suficiente18. Dessa maneira, temos utilizado uma estratégia que engloba a reconstrução de ambos os comprometimentos (tecidos moles e ósseos): enxerto de gordura livre para pacientes com SPR do tipo I, enxertos de gordura livre ou enxertos dermogordurosos para os pacientes do tipo II e enxertos ósseos com RFTP para aqueles com tipo III (Figura 6).
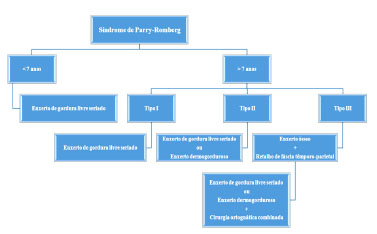
Figura 6. Algoritmo terapêutico para o tratamento cirúrgico da hipoplasia dos tecidos moles e do esqueleto craniofacial dos pacientes com Síndrome de Parry-Romberg baseado na gravidade clínica.
Em nosso Hospital, bem como na UCLA Craniofacial Clinic14-16,20, o enxerto de gordura livre seriado tem sido o principal método para a reconstrução de tecidos moles de diversas anormalidades craniofaciais, incluindo a SPR. Nós, e outros autores,8,14,15,20 preferimos o enxerto livre de gordura, em vez da injeção de materiais sintéticos, pois estes últimos apresentam maiores taxas de infecção, seroma, exposição e migração14,15,20. Sobre essa modalidade terapêutica (enxerto de gordura livre), é importante mencionar que dentre os diversos tecidos, o tecido adiposo é um dos que possui a maior capacidade angiogênica21.
Diferentes investigações22-25 têm revelado que o enxerto de gordura livre é acompanhado por neovascularização local e, portanto, tal intervenção pode contribuir para a melhora da vascularização no sítio receptor. Assim, como na SPR a vascularização comprometida na área afetada pode ser a causa da atrofia dos tecidos moles e consequentemente da estrutura esquelética subjacente18, acreditamos que a enxertia de gordura livre possa afetar o prognóstico dos pacientes com SPR do tipo I, pois pode diminuir a progressão da doença por meio da melhora da vascularização local. Embora outros18 também tenham reportado que a adoção de um retalho livre vascularizado tem o potencial de atuar como uma barreira contra a progressão da SPR, é importante que a angiogênese associada ao enxerto de gordura livre e o seu impacto na progressão da SPR sejam avaliados objetivamente (por exemplo, com o auxílio de um dispositivo doppler de varredura22 em pesquisas futuras com o intuito de confirmar nossa hipótese.
A taxa de sobrevivência variável do enxerto de gordura livre tem sido reportada como um dos problemas mais preocupante com essa abordagem terapêutica15,24. Nós e outros8 temos evidenciado subjetivamente que os pacientes com SPR apresentam certo grau de absorção da gordura livre enxertada. No entanto, não realizamos nenhuma investigação específica sobre a taxa de absorção de gordura livre e nem sobre os fatores que podem ter interferido com essa absorção. Portanto, limitações devem ser impostas na interpretação dessa informação (presença de absorção de gordura). Na literatura, estudo16 que investigou a taxa de retenção de enxerto de gordura livre no período pós-operatório (1 ano) revelou que pacientes com SPR apresentam significativamente menor "pega" do enxerto de gordura livre, quando comparados com pacientes saudáveis (sem SPR). Essa menor incorporação do enxerto de gordura livre pode ser secundária tanto a menor oferta sanguínea no leito receptor quanto à outra característica intrínseca ao tecido acometido pela SPR16.
Além disso, a idade dos pacientes com SPR pode interferir na sobrevivência dos enxertos de gordura livre16. Análises de bancada 26,27 têm demonstrado que os enxertos de gordura livre são mais efetivos em pacientes mais jovens. Na literatura, além da idade26-28, outros fatores (por exemplo, as diferentes velocidades de centrifugação, o estado nutricional dos receptores e o índice de massa corpórea)24,28 também tem sido descritos como fatores que potencialmente podem interferir isoladamente ou em conjunto na taxa de absorção dos enxertos de gordura livre. Entretanto, até o momento, não há unanimidade quanto o real impacto dessas inúmeras variáveis na absorção dos enxertos de gordura livre22-28. Desse modo, é necessário que investigações futuras definam o papel desses diferentes fatores sobre a taxa de incorporação do enxerto de gordura livre. Enquanto isso, a justificativa para a aplicação do enxerto de gordura livre especificamente em pacientes com SPR deve ser baseada em dados objetivos como, por exemplo, a análise fotogramétrica volumétrica tridimensional das faces de pacientes com SPR que revelou a melhora da simetria e do volume facial 1 ano após as injeções de gordura livre, comparado a simetria facial e volume facial antes da intervenção16. Somado a isso, o impacto das intervenções cirúrgicas nos âmbitos psicossociais e da qualidade de vida desses doentes também deve ser considerado nessa decisão14.
Sendo assim, assumindo que algum grau de absorção de gordura possa ocorrer durante o período pós-operatório8,15,16, nós e outros8,14,16,27 preferimos sobrecorrigir o defeito facial utilizando a transferência de tecido autógeno. Xie et al.8 têm sobre corrigido cerca de 20% a 30% do volume total injetado, pois foi reportado que, em geral, cerca de 70% a 80% da gordura livre pode sobreviver após enxertia em pacientes com SPR8. Nosso grupo e outros27 têm enxertado aproximadamente 10% a mais do volume necessário para simetrizar a face dos doentes com o intuito de atingir uma maior taxa de sobrevivência de gordura e diminuir a incidência de necrose de gordura e nódulos palpáveis27. Ademais, o enxerto de gordura livre pode ser utilizado repetidas vezes em pacientes com qualquer gravidade da doença, de acordo com a necessidade individual encontrada no seguimento pós-operatório8,14-16.
O mau suprimento sanguíneo da face atrófica, todavia, especificamente em pacientes do tipo III, pode diminuir a viabilidade do enxerto de gordura livre durante o período pós-operatório6. Assim sendo, para essa situação particular, preferimos o RFTP, pois este proporciona um fornecimento sanguíneo adicional para o enxerto ósseo, bem como para a enxertia de gordura nos procedimentos subsequentes. Nesta série, não observamos reabsorção clinicamente evidente de nenhum enxerto ósseo associado com o RFTP, o que difere de uns14, que têm utilizado enxertos ósseos sobrepostos sem aporte sanguíneo adicional, e se assemelha a outro grupo18 que conseguiu bons resultados associando enxerto ósseo de costela com retalho fasciocutâneo livre baseado na perfurante da artéria lateral intercostal.
Nós preferimos utilizar o RFTP, pois este retalho apresenta diversas características (contorno flexível, alta vascularização com amplo arco de rotação do pedículo, proximidade anatômica com as estruturas da face, mínima morbidade ao sítio doador, entre outras)11,29 que facilitam e auxiliam a reconstrução simétrica e harmoniosa da face e também garantem o aporte necessário para o enxerto de calota craniana associado, sem a desvantagem relativa dos procedimentos microcirúrgicos, que requerem um elevado nível de habilidade15.
Na literatura, existe controvérsia sobre a idade em que os pacientes com SPR devem ser operados. Muitos defendem que a correção da hipoplasia dos tecidos moles deve ser realizada somente após o tratamento do defeito esquelético14,16. Entretanto, nosso grupo, à semelhança de outros14,16, tem tratado esses doentes tão cedo quanto possível independentemente da gravidade clínica, pois a satisfação com os resultados cirúrgicos obtidos tem sido melhor nos pacientes com SPR mais jovens, mesmo na vigência de um maior número de intervenções ao longo do seguimento14. Sobre isso, é importante salientar que, como antes dos 7 anos de idade as regiões doadoras são escassas e o osso parietal não é espesso o suficiente para ser dividido30, indicamos apenas o enxerto de gordura livre seriado para todos os pacientes antes dessa idade.
A maturidade do esqueleto craniofacial, também, vem sendo relevante na tomada de decisões em outro algoritmo terapêutico15; entretanto, como salientado previamente, apenas a reconstrução dos defeitos de partes moles foi estratificada15. À medida que os tecidos ósseos dos pacientes com gravidade tipo III são acometidos, a mal oclusão pode aparecer ao término do crescimento do esqueleto craniofacial. Esses pacientes podem apresentar alteração do plano oclusal com mordida aberta do lado acometido consequente à atrofia progressiva unilateral da maxila. Portanto, o planejamento conjunto entre as equipes de cirurgia plástica e ortodontia é indispensável.
De acordo com a nossa experiência e a de outros6,14-16, tais pacientes são candidatos a cirurgias ortognáticas combinadas com ou sem distração osteogênica para diminuição da assimetria do esqueleto craniofacial, seguidas por aumento dos tecidos moles com enxertos de gordura livre seriados.
No presente estudo, à semelhança de outra análise8, os resultados das intervenções cirúrgicas craniofaciais foram avaliados subjetivamente com auxílio de uma escala previamente utilizada na SPR8. Em todos os pacientes houve uma melhora global da aparência facial. No entanto, uma avaliação cuidadosa revelou assimetria facial residual e, portanto, intervenções adicionais poderão ser necessárias, como exemplificado nas Figuras 4 e 5. Além disso, embora resultados parcialmente satisfatórios tenham sido atingidos com as diferentes abordagens cirúrgicas, o método de análise adotado8 possui limitações, pois foi baseado em uma caracterização estática (momento específico do período pós-operatório) e tanto a SPR (atrofia hemifacial progressiva de origem desconhecida) quanto às diferentes modalidades terapêuticas (por exemplo, absorção dos enxertos ou retalhos) possuem um caráter dinâmico e, por conseguinte, podem sofrer transformações ao longo do tempo. Dessa forma, todos pacientes com SPR reportados aqui continuam em seguimento em nosso Hospital e novas abordagens cirúrgicas poderão ser realizadas de acordo com as necessidades individuais. Investigações futuras com análises objetivas (por exemplo, quantificação volumétrica fotogramétrica ou tomográfica) devem averiguar os resultados reportados por nós.
CONCLUSÃO
Neste estudo retrospectivo, estratificou-se a abordagem terapêutica dos pacientes com SPR de acordo com a gravidade da deformidade craniofacial. A escala de gravidade proposta descreve os estágios clínicos da doença e pode auxiliar na abordagem terapêutica da SPR.
REFERÊNCIAS
1. Hunt JA, Hobar PC. Common craniofacial anomalies: conditions of craniofacial atrophy/hypoplasia and neoplasia. Plast Reconstr Surg. 2003;111(4):1497-508.
2. El-Kehdy J, Abbas O, Rubeiz N. A review of Parry-Romberg syndrome. J Am Acad Dermatol. 2012;67(4):769-84.
3. Wójcicki P, Zachara M. Surgical treatment of patients with Parry-Romberg syndrome. Ann Plast Surg. 2011;66(3):267-72.
4. Iñigo F, Rojo P, Ysunza A. Aesthetic treatment of Romberg's disease: experience with 35 cases. Br J Plast Surg. 1993;46(3):194-200.
5. Guerrerosantos J, Guerrerosantos F, Orozco J. Classification and treatment of facial tissue atrophy in Parry-Romberg disease. Aesthetic Plast Surg. 2007;31(5):424-34.
6. Hu J, Yin L, Tang X, Gui L, Zhang Z. Combined skeletal and soft tissue reconstruction for severe Parry-Romberg syndrome. J Craniofac Surg. 2011;22(3):937-41.
7. Pu LL, Coleman SR, Cui X, Ferguson RE Jr, Vasconez HC. Autologous fat grafts harvested and refined by the Coleman technique: a comparative study. Plast Reconstr Surg. 2008;122(3):932-7.
8. Xie Y, Li Q, Zheng D, Lei H, Pu LL. Correction of hemifacial atrophy with autologous fat transplantation. Ann Plast Surg. 2007;59(6):645-53.
9. Raposo do Amaral CE, Cetrulo CL Jr, Pereira CL, Guidi Mde C, Raposo do Amaral CM. Augmentation gluteoplasty with dermal-fat autografting from the lower abdomen. Aesthet Surg J. 2006;26(3):290-6.
10. Brent B, Byrd HS. Secondary ear reconstruction with cartilage grafts covered by axial, random, and free flaps of temporoparietal fascia. Plast Reconstr Surg. 1983;72(2):141-52.
11. Raposo-do-Amaral CE, Raposo-do-Amaral CA, Guidi M, Buzzo C. The role of temporoparietal fascia flap in craniofacial skeleton and secondary ear reconstruction. Rev Bras Cir Craniomaxilofac. 2010;13(1):1-6.
12. Thaller SR, Bradley JP, Garri JI. Craniofacial Surgery. New York: Informa Healthcare USA; 2007.
13. Moore MH, Wong KS, Proudman TW, David DJ. Progressive hemifacial atrophy (Romberg's disease): skeletal involvement and treatment. Br J Plast Surg. 1993;46(1):39-44.
14. Slack GC, Tabit CJ, Allam KA, Kawamoto HK, Bradley JP. Parry-Romberg reconstruction: optimal timing for hard and soft tissue procedures. J Craniofac Surg. 2012;23(7 Suppl 1):1969-73.
15. Tanna N, Broer PN, Roostaeian J, Bradley JP, Levine JP, Saadeh PB. Soft tissue correction of craniofacial microsomia and progressive hemifacial atrophy. J Craniofac Surg. 2012;23(7 Suppl 1):2024-7.
16. Slack GC, Tabit CJ, Allam KA, Kawamoto HK, Bradley JP. Parry-Romberg reconstruction: beneficial results despite poorer fat take. Ann Plast Surg. 2014;73(3):307-10.
17. Yu-Feng L, Lai G, Zhi-Yong Z. Combined treatments of facial contour deformities resulting from Parry-Romberg syndrome. J Reconstr Microsurg. 2008;24(5):333-42.
18. Myung Y, Lee YH, Chang H. Surgical correction of progressive hemifacial atrophy with onlay bone graft combined with soft tissue augmentation. J Craniofac Surg. 2012;23(6):1841-4.
19. Cardoso LA, Carvalho PM, Kohatsu EM, Cardoso KT, Alves KV, Souza TL. Uma nova opção cirúrgica para a Síndrome de Romberg. Acta Medica Misericordiae. 2000;3(1):32-5.
20. Lim AA, Fan K, Allam KA, Wan D, Tabit C, Liao E, et al. Autologous fat transplantation in the craniofacial patient: the UCLA experience. J Craniofac Surg. 2012;23(4):1061-6.
21. Lemoine AY, Ledoux S, Larger E. Adipose tissue angiogenesis in obesity. Thromb Haemost. 2013;110(4):661-9.
22. Sultan SM, Barr JS, Butala P, Davidson EH, Weinstein AL, Knobel D, et al. Fat grafting accelerates revascularisation and decreases fibrosis following thermal injury. J Plast Reconstr Aesthet Surg. 2012;65(2):219-27.
23. Hamed S, Ben-Nun O, Egozi D, Keren A, Malyarova N, Kruchevsky D, et al. Treating fat grafts with human endothelial progenitor cells promotes their vascularization and improves their survival in diabetes mellitus. Plast Reconstr Surg. 2012;130(4):801-11.
24. Tabit CJ, Slack GC, Fan K, Wan DC, Bradley JP. Fat grafting versus adipose-derived stem cell therapy: distinguishing indications, techniques, and outcomes. Aesthetic Plast Surg. 2012;36(3):704-13.
25. Yuan Y, Gao J, Liu L, Lu F. Role of adipose-derived stem cells in enhancing angiogenesis early after aspirated fattransplantation: induction or differentiation? Cell Biol Int. 2013;37(6):547-50.
26. Zhu M, Kohan E, Bradley J, Hedrick M, Benhaim P, Zuk P. The effect of age on osteogenic, adipogenic and proliferative potential of female adipose-derived stem cells. J Tissue Eng Regen Med. 2009;3(4):290-301.
27. Kanchwala SK, Bucky LP. Invited discussion: correction of hemifacial atrophy with autologous fat transplantation. Ann Plast Surg. 2007;59(6):654.
28. Mojallal A, Lequeux C, Shipkov C, Duclos A, Braye F, Rohrich R, et al. Influence of age and body mass index on the yield and proliferation capacity of adipose-derived stem cells. Aesthetic Plast Surg. 2011;35(6):1097-105.
29. Collar RM, Zopf D, Brown D, Fung K, Kim J. The versatility of the temporoparietal fascia flap in head and neck reconstruction. J Plast Reconstr Aesthet Surg. 2012;65(2):141-8.
30. Tessier P. Autogenous bone grafts taken from the calvarium for facial and cranial applications. Clin Plast Surg. 1982;9(4):531-8.
1-MD, Phd - Membro Titular da Sociedade Brasileira de Cirurgia Plástica (SBCP) e da Associação Brasileira de Cirurgia Crânio-Maxilo-Facial (ABCCMF), Doutorado pelo programa de Clínica Cirúrgica da Universidade De São Paulo (USP), Vice-Presidente do Instituto de Cirurgia Plástica Craniofacial do Hospital SOBRAPAR, Campinas, SP, Brasil
2-MD - Membro aspirante em treinamento da SBCP, residente do primeiro ano cirurgia plástica do Hospital SOBRAPAR, Campinas, SP, Brasil
3-MD, Msc - Membro Titular da SBCP e da ABCCMF, Mestre em Cirurgia pela Universidade Estadual de Campinas (UNICAMP), Regente do Serviço de Cirurgia Plástica "Prof. Dr. Cassio M. Raposo do Amaral" do Instituto de Cirurgia Plástica Craniofacial do Hospital SOBRAPAR, Campinas, SP, Brasil
4-MD - Membro Titular Da SBCP, Preceptor dos Residentes do Serviço de Cirurgia Plástica "Prof. Dr. Cassio M. Raposo do Amaral" do Instituto de Cirurgia Plástica Craniofacial do Hospital SOBRAPAR, Campinas, SP, Brasil
Instituição: Trabalho realizado no Instituto de Cirurgia Plástica Crânio Facial do Hospital SOBRAPAR, Campinas, SP, Brasil
Autor correspondente:
Cassio Eduardo Raposo-do-Amaral
Hospital de Crânio e Face SOBRAPAR
Av. Adolpho Lutz, 100 - Cidade Universitária
Campinas, SP, Brasil - CEP 13083-880; Caixa-postal 6028
E-mail: cassioraposo@hotmail.com
Artigo submetido: 19/08/2013
Artigo aceito: 30/10/2013


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter