

Original Article - Year 2013 - Volume 28 -
Influência do envelhecimento na qualidade da pele de mulheres brancas: o papel do colágeno, da densidade de material elástico e da vascularização
Influence of aging on the skin quality of white-skinned women: the role of collagen, elastic material density, and vascularization
RESUMO
INTRODUÇÃO: O objetivo deste estudo é avaliar a influência do envelhecimento na qualidade da pele de mulheres brancas, analisando o colágeno, as fibras elásticas e a vascularização.
MÉTODO: Foi realizada análise histológica e morfométrica de 218 retalhos pré-auriculares de mulheres brancas, que se submeteram a cirurgia estética facial. Foram utilizados o imunomarcador AntiCD 34, que evidencia os vasos sanguíneos, a coloração de Weigert, para visibilização das fibras elásticas, e a coloração de Picrosirius Ultrared, para analisar e quantificar os colágenos I, III e total. Os dados foram analisados de acordo com a faixa etárias das doadoras: < 40 anos, 40 anos a 49 anos, 50 anos a 59 anos, 60 anos a 69 anos, e > 70 anos.
RESULTADOS: Foi observada fragmentação e desorganização das fibras de colágeno, especialmente acima de 60 anos. Não houve diferenças significantes entre a idade e a espessura da derme e da epiderme, porém foi identificada relação com as porcentagens de colágeno I, III e total (P < 0,001). Houve aumento da densidade de fibras elásticas com a progressão da idade (P < 0,001). Comparando-se as peles das pacientes de faixas etárias vizinhas, com diferença de uma década entre elas, não houve diferença significativa na quantidade de material elástico dessas peles; porém, ao se comparar aquelas com diferença de 2 ou mais décadas nas faixas etárias, o aumento foi significante (P < 0,05). A diferença do número de vasos não foi significante (P = 0,112).
CONCLUSÕES: O envelhecimento promoveu redução do colágeno, degradação e fragmentação das fibras, e aumento da densidade de material elástico desorganizado, e não influenciou no número de vasos sanguíneos da derme.
Palavras-chave: Pele. Colágeno. Envelhecimento da pele. Vasos sanguíneos. Tecido elástico.
ABSTRACT
BACKGROUND: In the present study, we aimed to evaluate the influence of aging on the skin quality of white-skinned women by assessing collagen levels, elastic material density, and vascularization.
METHODS: Histological and morphometric analyses were performed on 218 preauricular skin fragments from white-skinned women who underwent facial cosmetic surgery. Anti-CD34 was used to identify the blood vessels, Weigert's staining was used to visualize elastic fibers, and Picro-sirius Ultra Red staining was employed for analyzing and quantifying the expression of type I, III, and total collagen. Data were analyzed according to the following donor age groups: < 40, 40-49, 50-59, 60-69, and > 70 years.
RESULTS: Fragmentation and disorganization of collagen fibers were observed in certain samples, particularly in samples from patients aged > 60 years. Significant differences between age and the thickness of the dermis and epidermis were not detected. However, a relationship was identified between age and the percentages of type I, III, and total collagen, and an increase of elastic fibers density was associated with age progression (P < 0.001). The comparison of the skin of patients with a decade difference in age did not reveal a significant difference in the elastic material quality; however, when the age difference was of 2 decades or more, there was a significant difference in elastic fibers (P < 0.05). The difference in the number of blood vessels between the groups was not significant (P = 0.112).
CONCLUSIONS: Aging promoted collagen reduction, fiber degradation and fragmentation, and increased disorganized elastic material density; however, it did not affect the number of dermal blood vessels.
Keywords: Skin. Collagen. Skin aging. Blood vessels. Elastic tissue.
A expectativa de vida média do brasileiro mudou de 69,3 anos para 72,7 anos em uma década (1997 a 2007), graças à melhoria do índice de desenvolvimento humano nacional1. Os resultados preliminares do Censo 2010 demonstraram que, no Brasil, a representatividade dos grupos etários até os 25 anos de idade acha-se reduzida em relação a 2000, em todas as faixas. Simultaneamente, houve um alargamento no topo da pirâmide, pois a população > 65 anos passou de 4,8%, em 1991, para 5,9%, em 2000, e 7,4%, em 2010. Esse aumento é ainda maior nas regiões Sul e Sudeste, atingindo a marca de 8,1%2.
O envelhecimento é um processo natural, sendo a pele um marcador ideal da idade cronológica3. Por ser um órgão exposto, a pele está sujeita aos danos ambientais, especialmente os causados pelas radiações ultravioletas (RUV). Por esse motivo, classifica-se o envelhecimento cutâneo em intrínseco ou cronológico e extrínseco ou fotoenvelhecimento4.
Com o objetivo de avaliar a influência da faixa etária na qualidade da pele de mulheres brancas, retalhos pré-auriculares de pacientes submetidas espontaneamente à cirurgia plástica estética facial foram estudados, analisando-se os seguintes parâmetros: colágeno, fibras elásticas e densidade de vasos sanguíneos.
MÉTODO
Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da Pontifícia Universidade Católica do Paraná (PUCPR), sob o nº 0153.0.084.000-11 no CONEP e nº 6119 no CEP, de acordo com o parecer nº 0005140/11, em reunião realizada no dia 29/6/2011.
As pacientes incluídas apresentavam-se em perfeitas condições de saúde física e mental e assinaram um termo de consentimento livre e informado.
Foram coletadas informações relativas a comorbidades, história mórbida pregressa e condições e hábitos de vida.
Foram excluídas do estudo as pacientes que apresentassem elementos que pudessem influenciar a qualidade da pele a ser avaliada, como tabagismo, bronzeamento artificial, tratamentos tópicos, aplicação de toxina botulínica, preenchimento cutâneo e cirurgias anteriores.
Foram obtidos fragmentos de pele pré-auricular, naturalmente descartados durante o procedimento de plástica facial, no período compreendido entre junho de 2009 e maio de 2011.
Esses fragmentos, estendidos em papel filtro e fixados em formalina a 10%, foram preparados no Laboratório de Anatomia Patológica Experimental da PUCPR, utilizando-se 1 cm2 da parte central da peça para processamento histológico. Foram preparados blocos e realizados cortes de 5 µm de espessura, que foram montados em lâminas.
As lâminas foram coradas com hematoxilina-eosina, para estudo geral e organizacional da pele e para as medidas das espessuras da epiderme e da derme.
Para avaliação da densidade e organização do colágeno foi empregada a coloração Picrosirius Ultrared, em 5 campos de cada corte histológico e, com base na média das leituras, foi determinada a densidade de colágeno em cada peça.
O imunomarcador AntiCD 34 foi usado para identificação e quantificação dos vasos sanguíneos. Foram analisados os campos válidos, que variaram de 5 a 10, conforme a área do corte histológico que permitiu o exame, e a coloração de Weigert possibilitou a identificação das fibras elásticas em 10 campos de cada corte de pele.
Foram capturadas imagens com câmera Sony® CCD101, que foram transmitidas a um monitor colorido Trinitron Sony®, congeladas e digitalizadas por uma placa Oculus® TCX. Finalmente, foi realizada a análise das imagens usando-se o aplicativo Image Plus® 4.5 para Windows da Media Cybernetics em microcomputador.
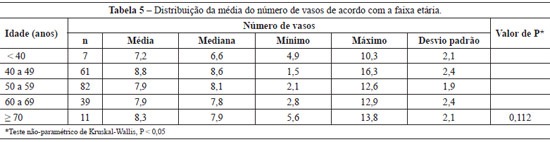
Os resultados do colágeno, da densidade de fibras elásticas e do número de vasos sanguíneos foram expressos por médias, medianas, valores mínimos, valores máximos e desvios padrão. Para avaliar a associação entre idade e porcentual de colágeno, foi estimado o coeficiente de correlação de Pearson. Para a comparação dos grupos definidos pela faixa etária, foi considerado o modelo de análise de variância com um fator. Os dados foram organizados em planilha Excel e analisados com o programa computacional Statistica v.8.0. Os dados receberam análise estatística utilizando-se testes paramétricos conforme a necessidade dos resultados obtidos, além da metodologia ANOVA, para avaliar densidade e organização do colágeno e para a comparação entre as faixas etárias em relação ao porcentual de fibras, e o teste least significant difference (LSD), para as comparações múltiplas. Para a análise do número de vasos, as faixas etárias foram comparadas usando-se o teste não-paramétrico de Kruskal-Wallis.
Para todos os testes foi utilizado, como nível para rejeição da hipótese de nulidade, P < 0,05 ou 5%.
RESULTADOS
De um universo de 250 mulheres operadas no período de estudo, foi possível selecionar 218 pacientes, que constituíram a amostra. No grupo excluído, 6 pacientes eram tabagistas, 9 ex-tabagistas e 17 apresentavam outro fator de confusão. Dessas 218 restantes, 204 foram utilizadas para estudo do colágeno, 203 para análise das fibras elásticas e 200 para a contagem dos vasos sanguíneos. A diferença entre esses números foi decorrente da necessidade de exclusão de alguns casos pela existência de artefatos de técnica.
A idade das pacientes variou entre 3 3 anos e 77 anos, com média de 54,9 ± 8,68 anos (Tabela 1). A análise microscópica dos cortes histológicos corados pela hematoxilina-eosina não demonstrou alterações significantes entre as faixas etárias avaliadas. A espessura da epiderme e da derme, medidas em micrômetros (µm), não apresentou diferença significativa entre as faixas etárias (P = 0,152 e P = 0,506, respectivamente).
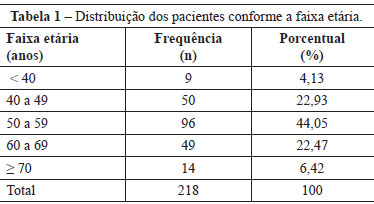
Na análise do colágeno, evidenciou-se desorganização e fragmentação discretas das fibras colágenas até a 6ª década, que se tornaram mais evidentes a partir dessa faixa etária.
Os cortes histológicos de pele de mulheres do grupo da faixa etária abaixo dos 50 anos demonstraram grande quantidade de fibras colágenas tipo I, dispostas ordenadamente. Em contrapartida, as amostras de pele de mulheres da faixa etária dos 50 anos aos 59 anos já evidenciavam fragmentação do colágeno, ainda que discreta (Figura 1). Na amostra de pele de mulheres entre 60 anos e 69 anos, havia acentuada diminuição das fibras colágenas do tipo I e presença de colágeno tipo III. Nos cortes histológicos de pele de mulheres entre 70 anos e 79 anos, havia desorganização e fragmentação acentuada das fibras colágenas do tipo I; além disso, a presença de colágeno do tipo III era evidente (Figura 1).
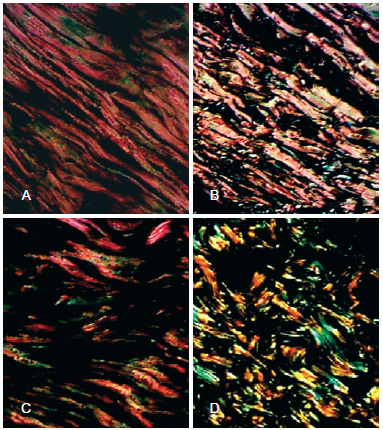
Figura 1 - Cortes histológicos de pele, demonstrando a desorganização progressiva do colágeno (Picrosirius Ultrared - 400 X). Em A, < 50 anos. Em B, 50 anos a 59 anos. Em C, 60 anos a 69 anos. Em D, 70 anos a 79 anos. Vermelho = colágeno tipo I; Verde = colágeno tipo III.
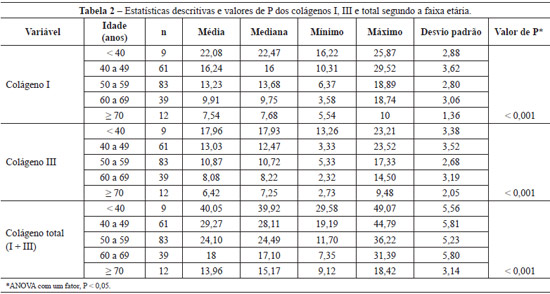
Encontrou-se diminuição da densidade de colágeno total à medida que a faixa etária avançava (P < 0,001), bem como das frações dos tipos I e III (P < 0,001) (Tabela 2).
Na comparação entre as faixas etárias, 2 a 2, em relação à quantidade de colágenos I, III e total, foram encontradas diferenças significativas (P < 0,001) para todas as comparações, à exceção daquela entre 60 anos a 69 anos x > 70 anos, com valores de P = 0,007 para colágeno I, 0,076 para colágeno III e 0,012 para colágeno total.
A análise qualitativa das fibras elásticas permitiu verificar que:
abaixo dos 50 anos, na derme papilar, existiam fibras finas normais ou levemente espessadas (Figura 2A);
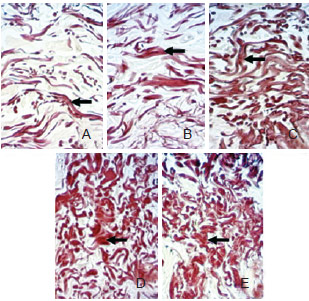
Figura 2 - Fotomicrografias de cortes histológicos de pele, evidenciando modificações elásticas, nas diferentes faixas etárias (hematoxilina de Weigert, 400X). Em A, < 40 anos. Em B, 40 anos a 49 anos. Em C, 50 anos a 59 anos. Em D, 60 anos a 69 anos. Em E, > 70 anos. Setas indicando fibras elásticas.
entre 41 anos e 50 anos, foram encontradas lise e alterações das fibras, que começaram a se tornar focalmente espessadas (Figura 2B); entre 51 anos e 60 anos, as fibras apresentavam-se emaranhadas e, frequentemente, fragmentadas (Figura 2C); entre 61 anos e 69 anos, as mudanças se tornaram mais evidentes, com perda do modelo fibrilar normal, e as fibras se tornaram emaranhadas e formaram massas espessadas irregulares (Figura 2D); após os 70 anos, essas fibras se mostraram degeneradas, com destruição da rede de elastina, resultando num aglomerado de material amorfo e elastótico em toda a derme, com a aparência de desintegração e decomposição (Figura 2E).
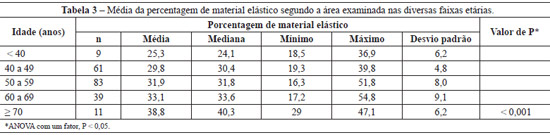
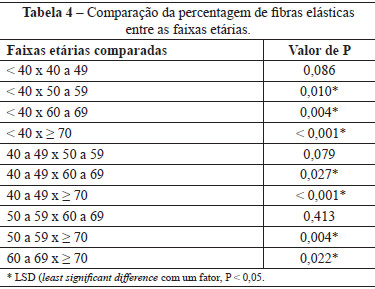
A média do percentual da área examinada nos cortes histológicos permitiu verificar que houve aumento progressivo do material elástico à medida que a idade avançou (P < 0,001) (Tabela 3). A diferença significativa entre as faixas etárias exigiu a comparação 2 a 2 (Tabela 4).
A média do número de vasos na derme, nas diferentes faixas etárias, foi semelhante (P = 0,112) (Tabela 5); entretanto, eram mais irregulares e dilatados a partir dos 61 anos de idade (Figura 3).
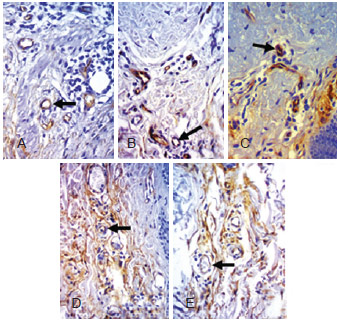
Figura 3 - Fotomicrografias de cortes histológicos de pele, evidenciando a densidade de vasos na derme, nas diferentes faixas etárias (anti CD 34, 400X). Em A, < 40 anos. Em B, 40 anos a 49 anos. Em C, 50 anos a 59 anos. Em D, 60 anos a 69 anos. Em E, > 70 anos. Setas indicando vasos sanguíneos.
DISCUSSÃO
O alargamento do topo da pirâmide de idade das populações, inclusive da brasileira, faz com que o interesse pelas alterações da pele com o envelhecimento se torne motivo de interesse.
A busca pelo rejuvenescimento facial tem aumentado e cada vez mais precocemente. No presente estudo, embora a maioria das 218 pacientes estivesse entre 50 anos e 69 anos, os extremos encontrados foram 33 anos e 77 anos para o mesmo procedimento de rejuvenescimento facial.
O envelhecimento é um processo natural e imutável de todos os órgãos5,6. A pele, por ser um órgão exposto, está sujeita aos danos ambientais, como os causados pelas RUV, que desempenham relevante papel no envelhecimento extrínseco ou fotoenvelhecimento7-13.
A idade, a cor da pele, a exposição solar e o tabagismo são considerados fatores independentes para o envelhecimento cutâneo3. No grupo inicialmente avaliado, 6% das pacientes eram tabagistas ou ex-tabagistas há mais de 5 anos, de acordo com os critérios da Organização Mundial da Saúde14, e foram excluídas da análise.
De acordo com Landau15, o aspecto mais importante do envelhecimento intrínseco seria o achatamento da junção dermoepidérmica, com diminuição da superfície de contato entre a derme e a epiderme; entretanto, a espessura da epiderme permaneceria constante com o passar dos anos e a espessura da derme reduziria a partir da 8ª década. O adelgaçamento da epiderme e o achatamento das junções dermoepidérmicas explicariam a atrofia cutânea6,9. Em nossa amostra, não houve diferença significante na espessura da epiderme e da derme entre as faixas etárias avaliadas, contrapondo-se às observações dessa autora. Alterações estruturais e funcionais das junções dermoepidérmicas foram citadas por Le Varlet et al.16.
Oriá et al.17 verificaram redução significativa da espessura da epiderme e da derme em indivíduos após os 60 anos de idade e progressiva redução da superfície de contato dermoepidérmica.
As pacientes que constituíram o presente estudo se achavam em perfeitas condições de saúde, o que poderia ter contribuído para melhor qualidade da pele, especialmente entre as faixas mais jovens.
As principais alterações visibilizadas na pele envelhecida, sem dúvida, ocorrem no colágeno dérmico, levando a modificações de suas propriedades biomecânicas5.
Um mecanismo citado como responsável pelo envelhecimento é a diminuição das proteosomas, enzimas multicatalíticas responsáveis pela degradação de proteínas oxidadas e deformadas, que interfeririam na atividade dos fibroblastos, levando à diminuição da síntese proteica e aumento da proteólise18.
Danos actínicos à pele fotoenvelhecida seriam evidenciados histologicamente por infiltrado inflamatório na derme e aumento de fibroblastos, alongados e achatados, porém capazes de produzir colágeno, indicando que alterações na síntese de colágeno não pareciam ser a causa da diminuição dos colágenos I e III19. Outras alterações descritas são: perda de volume, redução de fibroblastos, mastócitos e dos vasos sanguíneos, encurtamento das alças capilares e anormalidade das terminações nervosas20. Essas alterações levariam à diminuição da síntese dos colágenos I e III, especialmente na pele fotoenvelhecida, reduzindo a adesão entre células e fibras dérmicas com menor nível de estimulação mecânica21. Alterações direcionais e funcionais do colágeno dérmico seriam mais acentuadas a partir da 7ª década22.
Fisher et al.23 demonstraram, in vitro, que os fibroblastos velhos mantêm a capacidade de produzir colágeno. Isso ficou evidente no presente estudo, ao se comparar as quantidades de colágenos I, III e total entre as faixas etárias. A quantidade dos colágenos diminuiu com o avanço da idade. Como a exposição solar é cumulativa, quanto maior o tempo de exposição solar, maiores serão os danos ao colágeno, bem como maiores serão as alterações das propriedades mecânicas da pele23.
Na análise dos cortes histológicos pela coloração de Picrosirius Ultrared, percebeu-se que as fibras colágenas do tipo I (fortemente birrefringentes e com coloração amarelada a avermelhada) eram dominantes e muito bem organizadas nas pacientes mais jovens, sofrendo uma transformação gradual em pacientes de faixas etárias mais avançadas, apresentando-se de maneira desorganizada naquelas com idade > 70 anos, nas quais o colágeno III (fibras fracamente birrefringentes e esverdeadas) era mais evidente.
Ao contrário do observado por Faria et al.6, que relataram que a quantidade de colágeno permaneceria igual, e que haveria apenas alterações da organização das fibras, no presente estudo a diminuição do porcentual de colágenos I, III e total foi linear e as alterações estruturais na direção e organização das fibras foram mais acentuadas nas faixas de 60 anos a 69 anos e > 70 anos, quando as fibras passaram a se apresentar fragmentadas. A diminuição do colágeno, de sua organização e mesmo a fragmentação das fibras poderia explicar em parte a fragilidade da pele, em idosos.
No estudo de El-Domyati et al.24, que avaliou amostras de pele expostas e não-expostas à radiação solar de 38 doadores, as alterações começaram a partir da 5ª década, mas só foram significativas nas 8ª e 9ª décadas, quando apenas traços de colágeno eram notados. Talvez o número de casos (n = 218) em nossa amostra tenha contribuído para a diferença nos resultados. A diminuição da densidade do colágeno, a desorganização e a fragmentação são citadas como causa do aparecimento de rugas6,9.
Demonstrou-se, no presente estudo, que o avançar da idade é acompanhado pela diminuição da densidade de colágeno, cujas causas não estão, ainda, totalmente esclarecidas. O envelhecimento pode variar de pessoa para pessoa, de acordo com hábitos de vida, história mórbida atual e pregressa, carga genética e influências ambientais.
No idoso, a diminuição da rede vascular poderia levar à diminuição da oxigenação celular, com surgimento de substâncias reativas do oxigênio, as quais causariam danos moleculares facilitadores da apoptose e da morte celular3,16. Essa situação poderia ser influenciada por fatores ambientais, como o tabagismo e as RUV.
Se considerarmos que fibroblastos de idosos continuam a produzir colágeno, poder-se-ia sugerir que a diminuição de colágeno estaria sujeita, entre outros fatores, ao aumento da degradação, uma vez que com a idade ocorre aumento das metaloproteinases matriciais (MMPs), enzimas responsáveis pela degradação do colágeno, sem aumento equivalente de seus inibidores. O efeito benéfico da tretinoína na pele envelhecida, em decorrência do efeito inibitório nas MMPs, pode ser um indicador desse fenômeno5.
As fibras elásticas da derme são responsáveis pela elasticidade fisiológica e resiliência da pele25. A degeneração dessas fibras e do colágeno promove a diminuição da elasticidade da pele e a formação de rugas26. A densidade da rede de elastina aumenta desde o nascimento até atingir seu volume final, por volta dos 20 anos nas mulheres e dos 40 anos nos homens27.
Para Bouissou et al.28, o envelhecimento cronológico das fibras elásticas e a elastose actínica seriam 2 processos distintos. Bioquimicamente, o material elastótico assemelha-se à elastina, embora desorganizado e anormal na proporção de vários constituintes29. Nas áreas expostas à radiação solar, verifica-se a destruição progressiva de toda a rede de elastina da derme. As fibras elásticas tornam-se espessadas, emaranhadas, degradadas e disfuncionais28-30.
No presente estudo, em que foram analisadas amostras de pele da região pré-auricular, local que sofre fotoexposição intensa, observou-se aumento da densidade do material elástico com a progressão da faixa etária das pacientes, acompanhado de alteração da qualidade das fibras elásticas. Após os 70 anos, as fibras elásticas apresentavam-se degeneradas, espessadas, emaranhadas e, frequentemente, fragmentadas, resultando num aglomerado de material amorfo e elastótico em toda a derme, com a aparência de desintegração e decomposição.
As consequências das alterações da organização e da qualidade das fibras elásticas, apesar de um aparente aumento da quantidade, são mudanças mecânicas na superfície cutânea, como a flacidez e o enrugamento, especialmente na face e no pescoço29. Na derme do idoso, ocorre aumento da densidade da elastina27. Segundo Braverman & Fonferko30, esse fato é decorrente da intensa perda de colágeno e do espessamento das fibras elásticas, fazendo com que o componente elástico possa parecer aumentado no idoso, em relação ao jovem.
Alterações da microcirculação resultam na diminuição do fluxo sanguíneo, com troca reduzida de nutrientes e palidez. Relata-se, em idosos, redução das alças capilares na pele, tanto nas áreas fotoexpostas como nas fotoprotegidas31-33.
Segundo Smith34, no idoso, há menor número de vasos de todas as dimensões, inclusive das alças capilares, além do adelgaçamento da parede e alterações na membrana basal.
Neste estudo, as amostras de pele analisadas eram provenientes de uma região que sofre intensa fotoexposição. Não se observou diminuição significante do número de vasos, apenas ectasias. Talvez o número de amostras nas faixas mais avançadas deva ser aumentado, para melhor avaliação, pois, segundo Braverman & Yen35, as anormalidades vasculares associadas ao envelhecimento cronológico são encontradas, em geral, apenas em pessoas com mais de 70 anos de idade.
Ainda são muitas as dúvidas e, com certeza, muitos estudos estão sendo feitos para esclarecê-las, pois só com o perfeito entendimento do processo de envelhecimento cutâneo poder-se-á estabelecer métodos eficazes de prevenção e tratamento, que poderão ser estendidos para todos os outros órgãos.
CONCLUSÕES
Em mulheres brancas, o envelhecimento da pele levou a alterações qualitativas e degenerativas na derme, com diminuição do colágeno total e de suas frações I e III; fragmentação e desorganização das fibras colágenas, especialmente acima dos 60 anos de idade; aumento da densidade do material elástico, com modificação da qualidade e da organização das fibras elásticas, resultando num aglomerado de material amorfo; e não influenciou, de forma significativa, no número de vasos sanguíneos.
REFERÊNCIAS
1. Instituto Brasileiro de Geografia e Estatística. Tábuas completas de mortalidade. Disponível: http://www.ibge.gov.br. Acesso em: 1/12/2009.
2. Instituto Brasileiro de Geografia e Estatística. Disponível em: www.ibge.gov.br/censo2010. Acesso em: 20/S/2010.
3. Suehara LY, Simone K, Maia M. Avaliação do envelhecimento facial relacionado ao tabagismo. An Bras Dermatol. 2006;S1(1):34-9.
4. Mine S, Fortunel NO, Pageon H, Asselineau D. Aging alters functionally human dermal papillary fibroblasts but not reticular fibroblasts: a new view of skin morphogenesis and aging. PloS One. 200S;3(12):e4066.
5. Moi RC. Envelhecimento do sistema tegumentar: revisão sistemática da literatura [dissertação de mestrado]. Ribeirão Preto: Universidade de São Paulo; 2004.
6. Faria JCM, Tuma Junior P, Costa MP, Quagliano AP, Ferreira MC. Envelhecimento da pele e colágeno. Rev Hosp Clin Fac Med S Paulo. 1995;50(Supl.):39-43.
7. Universidade do Rio de Janeiro. Índice ultravioleta/LEPA/UFRJ. Disponível: http://www.indiceuv.ufrj.br. Acesso em: 20/S/2010.
S. Vicedo Ortega Y, Vicedo Tomey A. Metaloproteinasas de la matriz y envejecimiento cutâneo. Rev Habanera Cienc. Med. 2003;2(5). Disponível em: http://www.ucmb.sld.cu/rhab/index.html. Acesso em: 12/9/2010.
9. Fisher GJ, Kang S, Varani J, Bata-Csorgo, Wan Y, Datta S, et al. Mechanisms of photoaging and chronological skin aging. Arch Dermatol. 2002;13S(11):1462-70.
10. Pagani EA, Jesus AMP, Pereira GC, Neves RG, Nascimento LV. Envelhecimento cutâneo: estudo comparativo clínico, histopatológico e histoquímico de áreas expostas e não expostas à luz solar. An Bras Dermatol. 199S;73(6):523-32.
11. Grönniger E, Weber B, Heil O, Peters N, Stäb F, Wenck H, et al. Aging and chronic sun exposure cause distinct epigenetic changes in human skin. PLoS Genet. 2010;6(5):e1000971.
12. Yaar M, Gilchrest BA. Skin aging: postulated mechanisms and consequent changes in structure and function. Clin Geriatr Med. 2001;17(4):617-30.
13. Röck K, Grandoch M, Majora M, Krutmann J, Fischer JW. Collagen fragments inhibit hyaluronan synthesis in skin fibroblasts in response to ultraviolet B (UVB): new insights into mechanisms of matrix remodeling. J Biol Chem. 2011;2S6(20):1S26S-76.
14. World Health Organization. Tobacco country profiles. 2nd ed. Proceedings of the 12th World Conference on Tobacco or Health. Helsinki: WHO; 2003.
15. Landau M. Exogenous factors in skin aging. Curr Probl Dermatol. 2007;35:1-13.
16. Le Varlet B, Chaudagne C, Saunois A, Barré P, Sauvage C, Berthou-loux B, et al. Age-related functional and structural changes in human dermo-epidermal junction components. J Investig Dermatol Symp Proc. 199S;3(2):172-9.
17. Oriá RB, Ferreira FVA, Santana EN, Fernandes MR, Brito GAC. Estudo das alterações relacionadas com a idade na pele humana utilizando métodos de histo-morfometria e autofluorescência. An Bras Dermatol. 2003;7S(4):425-34.
18. Widmer R, Ziaja I, Grune T. Protein oxidation and degradation during aging: role in skin aging and neurodegeneration. Free Radic Res. 2006;40(12):1259-68.
19. Rabe JH, Mamelak AJ, McElgunn PJ, Morison WL, Sauder DN. Photoa-ging: mechanisms and repair. J Am Acad Dermatol. 2006;55(1):1-19.
20. Yaar M, Gilchrest BA. Photoageing: mechanism, prevention and therapy. Br J Dermatol. 2007;157(5):874-87.
21. Varani J, Dame MK, Rittie L, Fligiel SE, Kang S, Fisher GJ, et al. Decreased collagen production in chronologically aged skin: roles of age-dependent alteration in fibroblasts function and defective mechanical stimulation. Am J Pathol. 2006;168(6):1861-8.
22. Moragas A, García-Bonafé M, Sans M, Torán N, Huguet P, Martín-Plata C. Image analysis of dermal collagen changes during skin aging. Anal Quant Cytol Histol. 1998;20(6):493-9.
23. Fisher GJ, Wang ZQ, Datta SC, Varani J, Kang S, Voorhees JJ. Pathophysiology of premature skin aging induced by ultraviolet light. N Engl J Med. 1997;337(20):1419-28.
24. El-Domyati, Attia S, Saleh F, Brown D, Birk DE, Gasparro F, et al. Intrinsic aging vs. photoaging: a comparative histopathological, im-munohistochemical, and ultrastructural study of skin. Exp Dermatol. 2002;11(5):398-405.
25. Mahoney MG, Brennan D, Starcher B, Faryniarz J, Ramirez J, Parr L, et al. Extracellular matrix in cutaneous ageing: the effects of 0.1% copper-zinc malonate-containing cream on elastin biosynthesis. Exp Dermatol. 2009;18(3):205-11.
26. Miyasaka M, Sakai S, Kusaka A, Endo Y, Kobayashi M, Kobayashi K, et al. Ultrasonic tissue characterization of photodamaged skin by scanning acoustic microscopy. Tokay J Exp Clin Med. 2005;30(4):217-25.
27. Pasquali-Ronchetti I, Baccarani-Contri M. Elastic fiber during development and aging. Microsc Res Tech. 1997;38(4):428-35.
28. Bouissou H, Pieraggi MT, Julian M, Savit T. The elastic tissue of the skin. A comparison of spontaneous and actinic (solar) aging. Int J Dermatol. 1988;27(5):327-35.
29. Wulf HC, Sandby-Moller J, Kobayasi T, Gniadecki R. Skin aging and natural photoprotection. Micron. 2004;35(3):185-91.
30. Braverman IM, Fonferko E. Studies in cutaneous aging: I. The elastic fiber network. J Invest Dermatol. 1982;78(5):434-43.
31. Kelly RI, Pearse R, Bull RH, Leveque JL, Rigal J, Mortimer PS. The effects of aging on the cutaneous microvasculature. J Am Acad Der-matol. 1995;33(5 Pt 1):749-56.
32. Chung JH, Yano K, Lee MK,Youn CS, Seo JY, Kim KH, et al. Differential effects of photoaging vs intrinsic aging on the vascularization of human skin. Arch Dermatol. 2002;138(11):1437-42.
33. Chung JH, Eun HC. Angiogenesis in skin aging and photoaging. J Dermatol. 2007;34(9):593-600.
34. Smith L. Histopathologic characteristics and ultrastructure of aging skin. Cutis. 1989;43(5):414-24.
35. Braverman IM, Yen A. Ultrastructure of the human dermal microcirculation. II. The capillary loops of the dermal papillae. J Invest Dermatol. 1977;68(1):44-52.
1. Mestre em Cirurgia, ginecologista e obstetra da Santa Casa de Misericórdia de Ponta Grossa, Ponta Grossa, PR, Brasil
2. Doutora em Cirurgia Experimental, professora associada do Departamento de Cirurgia da Universidade Federal do Paraná, Curitiba, PR, Brasil
3. Mestre em Cirurgia, dermatologista da Santa Casa de Misericórdia de Ponta Grossa, Ponta Grossa, PR, Brasil
4. Mestre em Cirurgia, cirurgião plástico, membro titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), Curitiba, PR, Brasil
5. Cirurgião plástico, membro titular da SBCP, Curitiba, PR, Brasil
6. Mestre em Cirurgia, professor de Anatomia Patológica da Universidade Estadual de Ponta Grossa, Ponta Grossa, PR, Brasil
7. Médica residente em Cirurgia Geral do Hospital Angelina Caron, Campina Grande do Sul, PR, Brasil
Correspondencia para:
André Auersvald
Alameda Presidente Taunay, 1.756
Curitiba, PR, Brasil - CEP 82030-590
E-mail: andreauersvald@uol.com.br
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 6/1/2013
Artigo aceito: 27/2/2013
Trabalho realizado na Pontifícia Universidade Católica do Paraná, Curitiba, PR, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter