

Original Article - Year 2012 - Volume 27 -
Tratamento da ptose mamária e hipomastia utilizando técnica de mamoplastia com pedículo súpero-medial e implante mamário
Treatment of breast ptosis and hypomastia using the superomedial pedicle technique of mammaplasty combined with breast augmentation
RESUMO
INTRODUÇÃO: O tratamento da ptose mamária com hipomastia utilizando técnica de mastopexia associada a implante mamário em um tempo cirúrgico é frequentemente associado a potenciais complicações mais graves do que quando se utilizam os métodos separadamente. Na literatura, a incidência relatada de complicações é semelhante à de procedimentos realizados em dois tempos cirúrgicos. Vários autores descrevem padronizações e cuidados específicos que possibilitam a utilização dessa combinação de técnicas com segurança. O objetivo deste trabalho é relatar técnica operatória para aumento mamário em pacientes com ptoses mamárias, analisando a incidência de complicações e revisões cirúrgicas.
MÉTODO: Foi avaliada a incidência de complicações e revisões cirúrgicas de 27 pacientes submetidas a mastopexia com implante mamário em um tempo cirúrgico utilizando técnica de pedículo súpero-medial, operadas entre 2005 e 2010.
RESULTADOS: Não foram observadas complicações imediatas que levassem a reoperações precoces. Três (11,1%) pacientes apresentaram pequenas deiscências de sutura na junção do "T" invertido, com resolução espontânea. Uma (3,7%) paciente apresentou contratura capsular, 1 ano após a operação. Quatro (14,8%) pacientes foram submetidas a revisões cirúrgicas de cicatrizes. História prévia de tabagismo aumentou em 4 vezes a incidência de deiscências de suturas e, em 2 vezes, o índice de revisões cirúrgicas de cicatrizes, porém sem diferença estatisticamente significante.
CONCLUSÕES: A técnica de mastopexia associada a implante mamário utilizando técnica de pedículo súpero-medial foi eficaz e segura para o tratamento da ptose mamária com hipomastia.
Palavras-chave: Mama/cirurgia. Implante mamário. Mamoplastia.
ABSTRACT
BACKGROUND: One-stage treatment of breast ptosis with hypomastia using mastopexy techniques combined with breast augmentation is often believed to have the potential for more serious complications than when the procedures are performed separately. However, available data show that the incidence of complications associated with the combined treatment is similar to that of both procedures performed separately. Several authors have developed standard and specific care techniques that facilitate the safe use of this combined technique. The aim of this study is to describe the surgical technique used for breast augmentation in patients with breast ptosis, as well as the incidence of complications and surgical revision.
METHODS: The incidence of complications and surgical revision was analyzed in 27 patients who underwent one-stage mastopexy combined with breast augmentation using the superomedial pedicle technique, between 2005 and 2010.
RESULTS: There were no immediate complications that required early reoperations. Three (11.1%) patients had slight dehiscence of the suture at the inverted-T junction, with spontaneous resolution. One (3.7%) patient developed capsular contracture 1 year after the operation. Four (14.8%) patients underwent scar revision procedures. A history of smoking was associated with a four-fold increase in the incidence of suture dehiscence and doubled the number of scar revision procedures; however, the difference was not statistically significant.
CONCLUSIONS: The mastopexy technique combined with breast augmentation using the superomedial pedicle technique was effective and safe for the treatment of breast ptosis with hypomastia.
Keywords: Breast/surgery. Breast implantation. Mammaplasty.
A associação de mastopexia com implante mamário em um único tempo cirúrgico foi descrita inicialmente na década de 1960 1,2. Na literatura, a associação de mastopexia com implante mamário em um tempo cirúrgico é assunto controverso, com autores descrevendo complicações e resultados estéticos insuficientes3-6, e outros descrevendo padronizações de técnicas para elevar a segurança e eficácia dessa combinação6-11.
Spear et al.5 descreveram aumento da incidência de complicações mais graves em mastopexias associadas a implantes mamários em um tempo cirúrgico. Dentre as complicações referidas encontram-se: infecção, exposição do implante, perda de sensibilidade da aréola e papila, mal posicionamento da papila, mal posicionamento do implante, necrose da aréola, necrose de pele, além de má qualidade das cicatrizes. Esses autores consideraram que, comparativamente a mastopexias isoladas ou aumentos mamários isolados, a combinação dos dois procedimentos em um único tempo cirúrgico aumenta a incidência total de complicações, e pode resultar em complicações mais graves.
Uma das principais razões que tornam esse procedimento complexo é o fato de que, nessa combinação, praticamente todas as variáveis que determinam o aspecto estético da mama são manipulados em algum grau4,12.
Lindsey13 propôs o tratamento de mamas com ptose grau 2 utilizando apenas implantes mamários, colocados através de acesso periareolar inferior. Para o autor, o acesso periareolar permite melhor disposição do implante mamário, comparado ao acesso inframamário, permitindo melhor correção da ptose.
Na literatura, a incidência reportada de complicações e revisões cirúrgicas após mastopexias com implantes mamários em um tempo cirúrgico é muito variada, e inclui diferentes técnicas de mastopexia, distintos tipos de implante mamário utilizados, e diferentes tempos de seguimento, dificultando a interpretação dos resultados obtidos4,14. Stevens et al.10 demonstraram que a taxa de revisões cirúrgicas em mastopexias com implantes mamários em um período de 3,5 anos foi de 14,6%, semelhante às taxas de revisões em pacientes submetidas a mastopexias isoladas (8,6%) e implantes mamários apenas (13%), no mesmo período. A incidência maior de revisões ocorreu em pacientes tabagistas, com uso de implantes preenchidos com solução salina, e quando se utilizou técnica periareolar para a mastopexia. De qualquer forma, segundo os autores, "...essa taxa de revisões é substancialmente menor do que os 100% de pacientes que teriam ao menos uma segunda operação para mastopexia e aumento mamário em duas etapas". Seify et al.15 reportaram 6,8% de revisões cirúrgicas no período de 3,5 anos após mastopexia com implantes mamários em um tempo cirúrgico, e 10,5% de complicações. Gomes11 relatou técnica de pedículo superior, com implante subglandular, obtendo recidiva de ptose em 7,4% dos casos operados.
Karacaoglu12 relatou ausência de revisões cirúrgicas em 20,6 meses após mastopexia com implante mamário, usando técnica de mastopexia vertical, posicionamento do implante subpeitoral, e enxerto de derme suturado entre a borda do músculo peitoral e a parede torácica, atuando como um sling ou suporte para o implante. Spear et al.5 referiram 8,7% de revisões cirúrgicas em mastopexias associadas a implantes mamários, comparados a 1,7% de revisões em aumentos mamários primários. O intervalo médio entre a mastopexia com implante mamário e as revisões foi de 7 anos. O índice de complicações foi de 17%.
Cannon & Lindsey14 recomendaram mastopexia periareolar associada a implante mamário submuscular em um tempo cirúrgico, para ptoses moderadas. Para migrações de aréolas > 4 cm, os autores sugerem a utilização de técnicas de mastopexia vertical ou em "T" invertido isoladamente, seguidas por implante mamário em um segundo tempo cirúrgico, 6 meses após. Dessa forma, segundo os autores, reduzem-se os riscos de necrose de aréolas, assimetrias, necrose de tecido mamário e cicatrizes hipertróficas.
Em pacientes com grandes ptoses mamárias secundárias a emagrecimento após cirurgias bariátricas, a realização de mastopexia associada a implante mamário no mesmo tempo cirúrgico deve ser bem avaliada, em decorrência da necessidade de grande mobilização de aréola, resultando em pedículos para aréola muito longos. Além disso, a pele previamente submetida a tração por tempo prolongado no período de obesidade tem menor capacidade para suportar implantes muito volumosos16-18.
Don Parsa et al.19 propuseram planejamento cirúrgico para correção de ptoses mamárias utilizando implantes mamários, baseado no grau de ptose observado. Para ptoses leves (papila acima da projeção anterior do sulco inframamário, e tecido mamário abaixo do sulco até 1 cm), os autores utilizam apenas o implante mamário, subglandular ou submuscular, dependendo da quantidade de tecido mamário existente. Para ptoses moderadas (papila acima ou coincidente com a projeção anterior do sulco inframamário, e tecido mamário de 1 cm a 4 cm abaixo do sulco), os autores indicam implante mamário isolado, seguido por alguma forma de mastopexia após 3 meses. Para ptoses graves (papila coincidente com sulco inframamário, ou abaixo dele, e tecido mamário mais de 4 cm abaixo do sulco), os autores recomendam mastopexia no primeiro tempo cirúrgico, seguida por implante mamário após 3 meses.
Spear et al.5 recomendam minuciosa preparação, planejamento e cuidados, particularmente em relação a posicionamento da aréola, preservação da irrigação sanguínea da aréola, e fechamento da pele com tensão adequada.
Elliott20 descreveu técnica de mastopexia circum-areolar com implante mamário subpeitoral, em um tempo cirúrgico, para pacientes em que a distância da fúrcula esternal à papila seja de até 24 cm.
Apesar de existirem opiniões favoráveis à realização de mastopexia e implantes mamários em dois tempos cirúrgicos, a mastopexia realizada em pacientes previamente submetidas a aumentos mamários com implantes também não é um procedimento isento de riscos15. Handel21 descreveu as complicações existentes em pacientes com implantes mamários prévios, submetidas a mastopexias secundárias. A presença do implante mamário ocasiona alterações anatômicas e funcionais nos tecidos adjacentes, reduzindo a irrigação sanguínea local e levando a potenciais complicações quando se utilizam as técnicas convencionais de mastopexia.
Não há consenso na literatura quanto à melhor técnica para mastopexia com implante mamário em um tempo cirúrgico, tampouco em relação à indicação de se realizar o procedimento em um ou dois tempos. Por outro lado, com o aumento da procura das pacientes para tratamento de ptoses mamárias com hipomastia, tornam-se necessários estudos demonstrando eficácia e segurança das variadas técnicas operatórias.
O objetivo deste trabalho é relatar a técnica operatória para aumento mamário em pacientes com ptoses mamárias, analisando a incidência de complicações e revisões cirúrgicas.
MÉTODO
Por meio de análise retrospectiva de prontuários médicos, foram identificadas 38 pacientes submetidas a mastopexias com inclusão de implante mamário em um único tempo cirúrgico, operadas de junho de 2005 a maio de 2010, e com tempo mínimo de seguimento de 6 meses no pós-operatório. Dessas 38 pacientes, foram excluídas as pacientes submetidas a procedimentos secundários (n = 2), com mastopexias prévias (n = 3) ou inclusões de implantes mamários prévios (n = 4). Também foram excluídas pacientes submetidas a mastopexias com inclusão de implante mamário associadas a ressecções de tumores por equipes de mastologia (n = 2). Portanto, 27 pacientes participaram deste estudo, e seus prontuários e registros fotográficos foram revisados.
A técnica operatória consistiu em mastopexia com cicatriz em "T" invertido e pedículo súpero-medial para o complexo areolopapilar (CAP), e implante mamário em posição subglandular. Todos os procedimentos cirúrgicos foram realizados em hospitais, sob anestesia geral. Os implantes mamários utilizados (Mentor Corporation) foram redondos, de perfil alto, e superfície texturizada.
A marcação cirúrgica foi feita no período pré-operatório imediato, no quarto hospitalar, com a paciente em posição sentada e com os membros superiores mantidos ao longo da face lateral do tronco. Foi marcada a linha média, da fúrcula esternal à cicatriz umbilical; a partir de um ponto sobre a clavícula, a 6 cm da fúrcula esternal, foi traçada uma linha ao longo da mama, correspondente à linha média mamária. Sobre a linha média mamária, em um ponto correspondente à projeção anterior do sulco mamário, foi marcado o ponto "A", que corresponde à borda superior da futura aréola. A quantidade de pele a ser ressecada foi estimada com base na técnica de compressão localizada do tecido mamário (pinch test). Neste ponto, cerca de 11 cm do ponto "A", foram traçadas 2 linhas partindo do ponto "A". Nos extremos dessas linhas, foram traçadas 2 outras linhas, unindo esses pontos aos limites mediais e laterais da mama, no sulco inframamário.
A cirurgia foi realizada com a paciente em decúbito dorsal horizontal, e os membros superiores em abdução ao nível do ombro, a 90 graus em relação à borda lateral do tórax. Foi realizada incisão no sulco inframamário até visualização da fáscia muscular (Figura 1). O plano subglandular foi dissecado com bisturi elétrico até cerca de 4 cm acima do ponto "A" (Figura 2). A aréola foi então marcada utilizando-se areolótomo, e realizada decorticação de uma área triangular cujos vértices eram o ponto "A" e as duas junções das linhas demarcadas previamente, preservando-se a aréola (Figura 3).
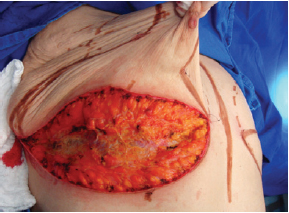
Figura 1 - Incisão em sulco inframamário até visualização da fáscia muscular.
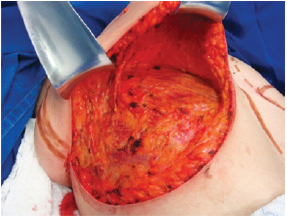
Figura 2 - Descolamento subglandular até 4 cm acima do ponto "A".
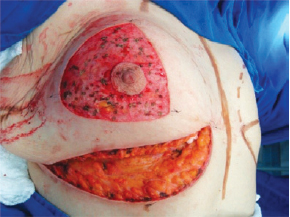
Figura 3 - Decorticação de triângulo com vértices do ponto "A" e nas junções das linhas demarcadas.
Nesse momento, o pedículo súpero-medial para o CAP foi demarcado, sendo realizada sua dissecção (Figuras 4 e 5). O tecido mamário correspondente ao polo inferior e à porção central foi ressecado, preservando-se o pedículo e o CAP (Figura 6).
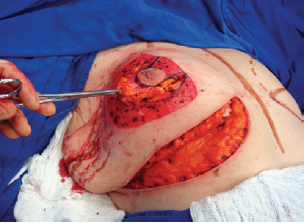
Figura 4 - Dissecção do pedículo súpero-medial para o complexo areolopapilar.
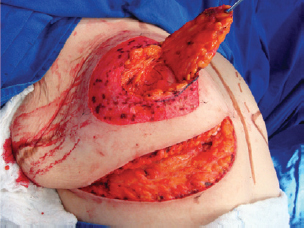
Figura 5 - Pedículo súpero-medial elevado.
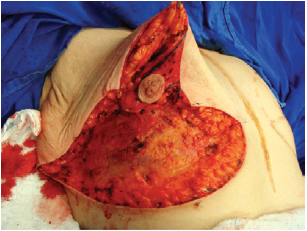
Figura 6 - Polos inferior e central ressecados.
O CAP foi elevado até sua posição previamente demarcada no ponto "A" (Figura 7), e as duas vertentes, lateral e medial, foram unidas ao centro e suturadas (Figura 8). Após finalização da sutura vertical, o implante mamário foi posicionado logo abaixo do tecido mamário, sobre a fáscia muscular (Figura 9).
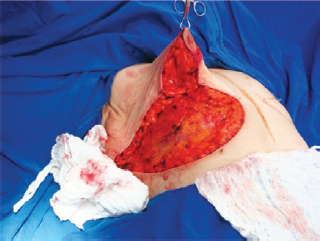
Figura 7 - Complexo areolopapilar posicionado no ponto "A".
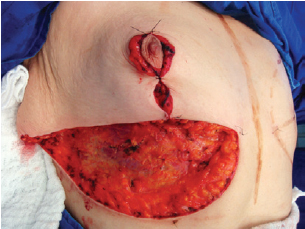
Figura 8 - Vertentes lateral e medial unidas ao centro.
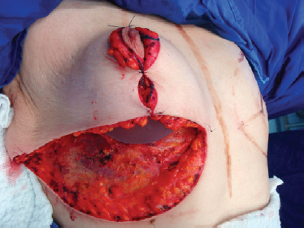
Figura 9 - Implante posicionado sob o tecido mamário.
Foi realizada sutura da incisão horizontal, no sulco inframamário, obtendo-se a total cobertura do implante (Figuras 10 e 11).
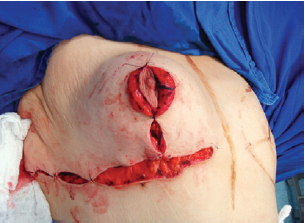
Figura 10 - Fechamento do sulco inframamário, recobrindo totalmente o implante.
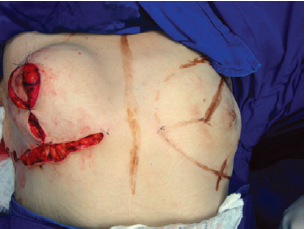
Figura 11 - Aspecto da mama ao final do procedimento.
Um dreno de sucção foi posicionado ao longo da borda inferior do implante, e exteriorizado por contra-abertura. Todas as pacientes receberam antibioticoterapia profilática, com cefalosporina de 2ª geração, iniciando-se na indução anestésica até 7 dias após a cirurgia.
RESULTADOS
A média de idade das 27 pacientes incluídas neste estudo foi de 36,7 anos, com variação de 23 anos a 54 anos. Quatro (14,8%) pacientes eram ex-obesas mórbidas, previamente submetidas a cirurgias bariátricas. Oito (29,6%) pacientes tinham antecedente pessoal de tabagismo, porém todas com intervalo > 1 ano entre a interrupção do tabagismo e a cirurgia. Cinco (18,5%) pacientes eram hipertensas, todas controladas com medicamentos. Uma (3,7%) paciente possuía antecedente pessoal de asma, em uso regular de corticosteroides e beta-agonistas de resgate. Não foi detectado antecedente pessoal de diabetes na população deste estudo. O índice de massa corporal (IMC) médio foi de 24,4 kg/m2, variando entre 19,5 kg/m2 e 28,6 kg/m2. Três (11,1%) pacientes apresentavam IMC > 25 kg/m2. Das 27 pacientes, 18 (66,7%) tinham histórico de gestação, todas com intervalo > 1 ano entre a última gestação e a cirurgia.
O tempo de seguimento após as cirurgias variou entre 6 meses e 5 anos, com média de 1,8 ano (Figuras 12 a 14).
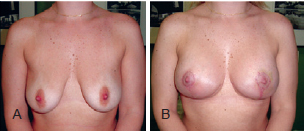
Figura 12 - Paciente A. Em A, aspecto pré-operatório. Em B, aspecto 6 meses após o procedimento.
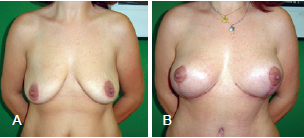
Figura 13 - Paciente B. Em A, aspecto pré-operatório. Em B, aspecto 6 meses após o procedimento.
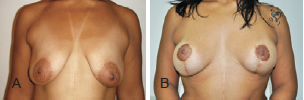
Figura 14 - Paciente C. Em A, aspecto pré-operatório. Em B, aspecto 1 ano e 4 meses após o procedimento.
Não houve complicações imediatas que levassem a reoperações precoces. Uma (3,7%) paciente apresentou hematoma tardio, no 30ºdia de pós-operatório, após queda da própria altura. Essa paciente, que não possuía antecedentes pessoais mórbidos, foi submetida a drenagem do hematoma em centro cirúrgico, e ligadura de ramo arterial de perfurante do músculo peitoral maior com sangramento ativo. Três (11,1%) pacientes apresentaram pequenas deiscências de suturas, todas na junção do "T" invertido da mastopexia, e todas com resolução espontânea após tratamento clínico, com limpeza local e curativos diários. Uma dessas pacientes apresentava antecedente pessoal de hipertensão arterial; outra paciente apresentava antecedente pessoal de hipertensão arterial e tabagismo; a terceira paciente possuía história prévia de tabagismo apenas. Não houve casos de necrose total ou parcial do CAP (Tabelas 1 e 2).


Todas as pacientes receberam alta hospitalar até o dia seguinte à cirurgia. O tempo de permanência do dreno de sucção foi de 3 dias a 5 dias, com média de 3,8 dias.
As cicatrizes foram revisadas em 4 (14,8%) pacientes: 2 delas apresentavam antecedente de tabagismo e 2 não tinham qualquer antecedente mórbido. Duas dessas pacientes pertenciam ao grupo das pacientes com pequenas deiscências de sutura (Tabela 3).

Uma (3,7%) paciente apresentou contratura capsular, detectada com 1 ano de pós-operatório, e foi reoperada (capsulectomia parcial, troca de implante mamário, e troca de sítio do implante para submuscular). Duas (7,4%) pacientes foram reoperadas para troca de implantes mamários por outros com volumes maiores, sem troca de sítios de implantes ou capsulectomia. Essas 2 pacientes pertenciam ao grupo das 4 pacientes cujas cicatrizes foram revisadas, o que ocorreu no mesmo tempo cirúrgico da troca dos implantes mamários. Não houve complicações no grupo das 4 pacientes ex-obesas mórbidas. A Tabela 4 apresenta os dados referentes às complicações observadas no estudo.

DISCUSSÃO
Entre as pacientes que procuram o cirurgião plástico para realização de cirurgias para aumento mamário, frequentemente há casos em que somente a introdução do implante mamário não permite adequado tratamento da região mamária. Incluem-se nesses casos as ptoses mamárias, as assimetrias mamárias, as mamas tuberosas e, mais recentemente, as alterações mamárias decorrentes de grandes perdas ponderais pós-cirurgias bariátricas8,11. Frequentemente, a paciente que procura o cirurgião plástico para realização de aumento mamário desconhece a necessidade de se corrigir a ptose mamária. Tentativas de correção de ptoses mamárias com introdução de implantes mamários de grandes volumes, muitas vezes, produzem resultados estéticos insatisfatórios a médio e longo prazos3,5. Da mesma forma, a utilização de técnicas de mastopexia ou mamoplastia redutora isoladamente, sem a introdução de implante mamário, também frequentemente não satisfaz totalmente a paciente e o cirurgião, sob o ponto de vista estético22.
A associação, em um mesmo tempo cirúrgico, de mastopexia com implante mamário possui a vantagem de permitir o tratamento estético da mama, modificando-a em múltiplos aspectos simultaneamente: volume, projeção, formato, posição, simetria, altura e largura do CAP. Porém, essa vantagem pode se tornar um fator de aumento da complexidade no planejamento cirúrgico, justamente por interferir em todas as variáveis responsáveis pelo resultado final estético da cirurgia4. Portanto, planejamento cuidadoso e minucioso é fundamental quando se realiza esse procedimento. Além disso, existe a possibilidade de complicações potencialmente mais graves quando se utiliza a mastopexia combinada a implante mamário3,4.
Neste estudo, é descrita técnica operatória para tratamento de ptoses mamárias com mastopexia combinada a implante mamário em um tempo cirúrgico. Utilizou-se a técnica de pedículo súpero-medial para o CAP, que possibilita ampla migração do CAP, e sua irrigação por um pedículo seguro, baseado em ramos intercostais anteriores e ramos dos vasos torácicos internos. Essa técnica também preserva boa parte da irrigação cutânea, porque não prevê descolamentos da pele em relação aos tecidos mais profundos23. Comparativamente à mamoplastia sem implante mamário, na mastopexia associada a implante mamário, a marcação de pele no pré-operatório leva em consideração o volume total maior decorrente do implante; portanto, no pinch test é obtida tensão menor na pele.
A colocação do implante mamário em posição subglandular permite melhor distribuição da tensão sob o tecido mamário resultante da mastopexia. Portanto, obtém-se projeção uniforme de todos os tecidos que recobrem o implante (pele e tecido mamário). Esse posicionamento do implante nas mastopexias combinadas a implante mamário possui a desvantagem de se obter menor quantidade de tecido recobrindo o implante, comparativamente ao posicionamento submuscular. Também pode resultar em menor suporte para o implante, levando a recorrência ou recidiva da ptose, bem como deslocamento inferior do implante, originando pseudoptose mamária. Por outro lado, o posicionamento submuscular do implante nessa situação pode resultar em ptose mamária sobre o músculo peitoral maior e sobre o implante, formando o aspecto em "dupla bolha". Neste estudo, com os implantes em posição subglandular, não se observaram recorrências ou recidivas de ptose mamária, ou pseudoptoses. O índice de 3,7% de contratura capsular foi compatível com dados da literatura.
Por se tratar de uma técnica cirúrgica com amplo descolamento e mobilização de tecidos, a cirurgia é realizada com minuciosa atenção à preservação da integridade tecidual, da irrigação cutânea e do CAP, e rigorosa hemostasia. Houve 1 caso de hematoma tardio, 30 dias após a cirurgia, e claramente associado a trauma direto na região após queda da própria altura. Nessa paciente, foi detectado sangramento ativo por ramo arterial perfurante medial, na borda medial da cápsula. A hipótese para o sangramento foi a mobilização traumática do implante para a região medial, com ruptura de ramo arterial medial perfurante. A conduta nesse caso foi de exploração do hematoma em centro cirúrgico, em decorrência do cuidado com a manutenção da situação de assepsia intracapsular e peri-implante. Além disso, a realização do procedimento em centro cirúrgico permitiu correta manipulação do implante, preservando sua integridade, e adequada localização do vaso sanguíneo responsável pelo sangramento e sua ligadura.
A irrigação sanguínea da pele e do CAP em uma mastoplastia é foco de bastante atenção nessas cirurgias24. No caso de mastopexia combinada a implante mamário é um aspecto crítico e potencialmente desastroso para uma situação em que há um implante que deve ser protegido pelos tecidos íntegros sobre ele3. Quando se utilizam técnicas com grandes descolamentos e mobilizações teciduais, muitos vasos nutrientes são seccionados, e a irrigação sanguínea passa a ser limitada; portanto, há redução do aporte nutricional ao tecido, que deve ser capaz de resistir a essa escassez nutricional para sobreviver e cicatrizar corretamente. Neste estudo, não houve qualquer caso de necrose do CAP, parcial ou total. A utilização do pedículo súpero-medial para o CAP permite migração segura do mesmo ao ponto "A", com bom aporte sanguíneo proveniente de vasos calibrosos e com anatomia pouco variável. Porém, 3 (11,1%) pacientes apresentaram pequenas necroses de pele na junção do "T" invertido, denotando combinação de irrigação limítrofe naquela região de pele extrema, e tensão excessiva no fechamento, por utilização de implante maior que o adequado, ou marcação de pele no limite da tensão. Nenhuma dessas 3 pacientes apresentou exposição do implante, e todas evoluíram com completa epitelização da ferida resultante, em até 3 semanas após a cirurgia. Duas pacientes eram hipertensas, o que resulta em 40% das pacientes hipertensas com deiscências de pele; duas pacientes eram tabagistas, resultando em 25% das tabagistas com deiscências de pele. Neste estudo, a hipertensão arterial aumentou em 9 vezes o risco de deiscências de pele, comparativamente a pacientes sem hipertensão arterial. O tabagismo, por sua vez, aumentou em 4 vezes o risco dessa complicação.
O número total de pacientes submetidas a revisões cirúrgicas foi de 5 (18,5%), sendo 4 delas por cicatrizes hipertróficas e 1 por contratura capsular. Das pacientes com cicatrizes hipertróficas, 2 delas eram ex-tabagistas. Portanto, 25% das pacientes tabagistas foram submetidas a revisões de cicatrizes. A única paciente submetida a troca de implante mamário em decorrência de contratura capsular possuía como único antecedente mórbido asma brônquica, com crises de broncoespasmo controladas com beta-agonistas e corticosteroides. Essa paciente não apresentou crise de broncoespasmo no período perioperatório e até 1 ano após a cirurgia inicial. O tabagismo, mesmo se considerado apenas como antecedente pessoal, pode levar a alterações cicatriciais, com discromias, alargamento cicatricial, hipertrofia e atrofia. Neste estudo, a presença de história prévia de tabagismo levou a aumento de 2 vezes no índice de revisões cirúrgicas das cicatrizes. Esse aumento no índice de cicatrizes desfavoráveis pode sugerir influência negativa dos efeitos do tabagismo em uma situação de tensão cutânea limítrofe em decorrência da presença do implante mamário sob a mama submetida a mastopexia.
CONCLUSÕES
Este estudo demonstra a técnica de mastopexia utilizando pedículo súpero-medial para o CAP, associada a implante mamário em posição subglandular em um mesmo tempo cirúrgico. Essa técnica foi efetiva para o tratamento de pacientes com ptoses mamárias, desejando aumento do volume mamário e correção da ptose mamária. A incidência de complicações foi compatível com os dados disponíveis na literatura, e tanto a hipertensão arterial sistêmica como a história prévia de tabagismo aumentaram o risco de pequenas deiscências de suturas e de revisões de cicatrizes.
REFERÊNCIAS
1. Regnault P. The hypoplastic and ptotic breast: a combined operation with prosthetic augmentation. Plast Reconstr Surg. 1966;37(1):31-7.
2. Gonzalez-Ulloa M. Correction of hypotrophy of the breast by means of exogenous material. Plast Reconstr Surg Transplant Bull. 1960;25:15-26.
3. Spear S. Augmentation/mastopexy: "surgeon, beware". Plast Reconstr Surg. 2003;112(3):905-6.
4. Spear SL, Low M, Ducic I. Revision augmentation mastopexy: indications, operations, and outcomes. Ann Plast Surg. 2003;51(6):540-6.
5. Spear SL, Boehmler JHT, Clemens MW. Augmentation/mastopexy: a 3-year review of a single surgeons practice. Plast Reconstr Surg. 2006;118(7 Suppl):136S-47S.
6. Nahai F, Fisher J, Maxwell PG, Mills DC 2nd. Augmentation mastopexy: to stage or not. Aesthet Surg J. 2007;27(3):297-305.
7. Pitanguy I, Carreirão S, Mazzarone F, Fróes LB, Cló TT. Mastopexia associada à inclusão de prótese. Rev Bras Cir Plást. 1991;81(2):101-11.
8. Carramaschi FR, Tanaka MP. Mastopexia associada a inclusão de prótese mamária. Rev Bras Cir Plást. 2003;18(1):25-36.
9. Stevens WG, Stoker DA, Freeman ME, Quardt SM, Hirsch EM, Cohen R. Is one-stage breast augmentation with mastopexy safe and effective? A review of 186 primary cases. Aesthet Surg J. 2006;26(6):674-81.
10. Stevens WG, Freeman ME, Stoker DA, Quardt SM, Cohen R, Hirsch EM. One-stage mastopexy with breast augmentation: a review of 321 patients. Plast Reconstr Surg. 2007;120(6):1674-9.
11. Gomes RS. Mastopexia com retalho de pedículo superior e implante de silicone. Rev Bras Cir Plást. 2008;23(4):241-7.
12. Karacaoglu E. Single stage augmentation mastopexy: a novel technique using autologous dermal graft. Ann Plast Surg. 2009;63(6):600-4.
13. Lindsey JT. Importance of the periareolar approach in the augmentation of the ptotic breast. Ann Plast Surg. 2002;48(5):460-2.
14. Cannon CL 3rd, Lindsey JT. Conservative augmentation with periareolar mastopexy reduces complications and treats a variety of breast types: a 5-year retrospective review of 100 consecutive patients. Ann Plast Surg. 2010;64(5):516-21.
15. Seify H, Ismail K, Evans G. Primary augmentation/mastopexy using large implants: is it a safe technique? A 4-year single surgeon review. Plast Reconstr Surg. 2010;126(Suppl. 4):67.
16. Kwei S, Borud LJ, Lee BT. Mastopexy with autologous augmentation after massive weight loss: the intercostal artery perforator (ICAP) flap. Ann Plast Surg. 2006;57(4):361-5.
17. Rubin JP, Khachi G. Mastopexy after massive weight loss: dermal suspension and selective auto-augmentation. Clin Plast Surg. 2008;35(1):123-9.
18. Colwell AS, Driscoll D, Breuing KH. Mastopexy techniques after massive weight loss: an algorithmic approach and review of the literature. Ann Plast Surg. 2009;63(1):28-33.
19. Don Parsa F, Brickman M, Parsa AA. Augmentation/mastopexy. Plast Reconstr Surg. 2005;115(5):1428-9.
20. Elliott LF. Circumareolar mastopexy with augmentation. Clin Plast Surg. 2002;29(3):337-47.
21. Handel N. Secondary mastopexy in the augmented patient: a recipe for disaster. Plast Reconstr Surg. 2006;118(7 Suppl):152S-63S.
22. Ferreira MC. Evaluation of results in aesthetic plastic surgery: preliminary observations on mammaplasty. Plast Reconstr Surg. 2000;106(7):1630-5.
23. Orlando JC, Guthrie RH Jr. The superomedial dermal pedicle for nipple transposition. Br J Plast Surg. 1975;28(1):42-5.
24. Silveira-Neto E. Mastoplastia redutora setorial com pedículo areolar interno. XIII Congresso Brasileiro de Cirurgia Plástica; 1976; Porto Alegre, RS, Brasil.
1. Mestre, cirurgião plástico, membro titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), médico assistente da Divisão de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP), São Paulo, SP, Brasil.
2. Cirurgião plástico, membro associado da SBCP, médico preceptor da Divisão de Cirurgia Plástica e Queimaduras do HCFMUSP, São Paulo, SP, Brasil.
3. Livre-docente, cirurgião plástico, membro titular da SBCP, professor associado da Divisão de Cirurgia Plástica e Queimaduras do HCFMUSP, São Paulo, SP, Brasil.
4. Professor titular da Faculdade de Medicina da Universidade de São Paulo, cirurgião plástico, membro titular da SBCP, chefe da Divisão de Cirurgia Plástica e Queimaduras do HCFMUSP, São Paulo, SP, Brasil.
Correspondência para:
Alexandre Wada
Av. Dr. Enéas Carvalho de Aguiar, 255 - 8º andar - sala 8.128 - Cerqueira César
São Paulo, SP, Brasil - CEP 05403-000
E-mail: alexandrewada@gmail.com
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 2/9/2012
Artigo aceito: 15/10/2012
Trabalho realizado no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, São Paulo, SP, Brasil.
Trabalho apresentado no 48º Congresso Brasileiro de Cirurgia Plástica para obtenção do título de membro titular da Sociedade Brasileira de Cirurgia Plástica.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter