
Original Article - Year 2012 - Volume 27 -
Efeitos de diferentes pressões de aspiração do tecido adiposo na obtenção de células-tronco mesenquimais
Effects of different liposuction techniques on the isolation of mesenchymal stem cells
RESUMO
INTRODUÇÃO: O enxerto de gordura nos últimos anos voltou a ter destaque como aliado dos cirurgiões plásticos no preenchimento de partes moles, no rejuvenescimento facial volumétrico, nos refinamentos de reconstruções mamárias e por ser rica fonte de células-tronco de comportamento mesenquimal (células-tronco adipoderivadas). Considerando que essas células têm importante papel na angiogênese e na diferenciação adipogênica, com impacto direto na sobrevivência dos enxertos de gordura, determinar parâmetros que otimizem a sua obtenção é imperativo. Nesse contexto, o objetivo deste trabalho é avaliar e comparar dois métodos de obtenção do tecido adiposo da região abdominal quanto ao número de células viáveis presentes na fração vásculo-estromal e analisar a expressão de marcadores de superfície.
MÉTODO: Foram selecionadas 9 pacientes do sexo feminino submetidas a lipoaspiração. O tecido adiposo foi obtido da região abdominal infraumbilical. Da metade direita foram coletados 20 ml de gordura, empregando-se cânula acoplada a uma seringa, cujo êmbolo foi tracionado de 2 cc em 2 cc, gerando baixas pressões de aspiração (grupo manual). O mesmo processo foi repetido na metade esquerda, entretanto a cânula estava acoplada a um coletor intermediário estéril e esse a uma máquina de vácuo sob pressão negativa constante de 350 mmHg (grupo a vácuo). As amostras foram centrifugadas e a gordura da camada intermediária dos dois grupos foi submetida a contagem celular, estabelecimento de culturas e posterior imunofenotipagem.
RESULTADOS: Este estudo demonstrou que, apesar de não haver diferença estatisticamente significativa, a obtenção da gordura da região abdominal empregando-se lipoaspirador com pressão negativa de 350 mmHg proporcionou maior número de células presentes na fração vásculo-estromal quando comparado à obtenção por meio de seringas de 10 ml, com baixas pressões de aspiração.
CONCLUSÕES: O emprego de pressão negativa de 350 mmHg é seguro para a obtenção das células-tronco adipoderivadas e o rendimento celular entre os dois grupos não apresentou diferença estatisticamente significativa.
Palavras-chave: Lipectomia. Imunofenotipagem. Células-tronco. Transplante de células-tronco mesenquimais. Gordura subcutânea abdominal. Medicina regenerativa.
ABSTRACT
BACKGROUND: In recent years, fat grafts have become useful in plastic surgery. They are mainly used to fill soft tissues, refine breast reconstructions, and for volumetric facial rejuvenation. They are also a rich source of mesenchymal stem cells (i.e., adipose-derived stem cells [ADSCs]), which directly influence fat graft survival. Since ADSCs play an important role in angiogenesis and adipogenic differentiation, it is essential to optimize their isolation. Therefore, in this study, we evaluated and compared 2 procedures used to isolate viable cells from the stromal vascular fraction of abdominal adipose tissue and assess the expressions of surface markers.
METHODS: We examined 9 female subjects who were scheduled to undergo liposuction. The adipose tissue was isolated from the abdominal infraumbilical region. Fat (20 mL) was collected from the right side by using a cannula attached to a syringe; the plunger was pulled back every 2 cm3 to create low-pressure suction (manual group). The same procedure was repeated on the left side, but the cannula was attached to a sterile and intermediate collector coupled to a vacuum pump that provided a constant negative pressure of 350 mmHg (pump group). The samples were centrifuged, and the adipocytes of the intermediate layer were counted, cultured, and immunophenotyped.
RESULTS: The isolation of abdominal adipocytes with a pump providing a negative pressure of 350 mmHg yielded a higher concentration of cells in the stromal vascular fraction than that obtained using 10-mL syringes and low-pressure suction, although the difference was not significant.
CONCLUSIONS: A negative pressure of 350 mmHg may be safely applied to isolate ADSCs. The cell yield did not indicate any statistically significant difference between the techniques.
Keywords: Immunophenotyping. Stem cells. Mesenchymal stem cell transplantation. Subcutaneous fat, abdominal. Regenerative medicine.
Desde a sua introdução, em 1893, o enxerto de gordura vem sendo utilizado como importante método de preenchimento de partes moles1. Inicialmente na forma de pequenos e grandes fragmentos1,2, evoluiu para pequenos glóbulos de gordura após o advento da lipoaspiração3. Coleman4 desenvolveu técnica que sistematizou a obtenção, o preparo e a introdução do tecido adiposo no leito receptor; objetivando melhor integração dos adipócitos maduros presentes no enxerto e resultados clínicos mais duradouros.
A fisiologia da integração dos enxertos de gordura envolve embebição plasmática inicial, angiogênese, sobrevivência de adipócitos maduros e diferenciação de precursores adipogênicos presentes no enxerto e no leito receptor5. Após a identificação do pré-adipócito, em 1926 1, diversos autores, em estudos experimentais, demonstraram a capacidade dos precursores adipocitários de formar tecido adiposo maduro e funcional6-8. Zuk et al.9 isolaram na fração vásculo-estromal do tecido adiposo uma população celular com capacidade de diferenciação pluripotente, semelhante à das células-tronco mesenquimais encontradas na medula óssea. A essas células deu-se o nome de células-tronco adipoderivadas (CTAD).
O tecido adiposo vem sendo utilizado como rica fonte de células-tronco de comportamento mesenquimal, pela aplicação dessas células na engenharia e regeneração de tecidos. Dessa maneira, é necessário desenvolver metodologia de obtenção e preparo que disponibilize o maior número dessas células por grama de tecido adiposo obtido. O objetivo deste trabalho é avaliar e comparar dois métodos de obtenção do tecido adiposo da região abdominal quanto ao número de células viáveis presentes na fração vásculo-estromal e analisar a expressão de marcadores de superfície.
MÉTODO
Foram selecionadas 9 pacientes do sexo feminino, hígidas, submetidas a lipoaspiração por razões estéticas, sob anestesia geral. As pacientes assinaram Termo de Consentimento Informado, aprovado pelo Comitê de Ética em Pesquisa do Instituto de Biociências da Universidade de São Paulo.
O tecido adiposo foi obtido da região abdominal infraumbilical. Da metade direita foram coletados 20 ml de gordura, empregando-se cânula de 2,5 mm de diâmetro e 15 cm de comprimento, acoplada a uma seringa com rosca de 10 cc. O êmbolo da seringa foi tracionado de 2 cc em 2 cc, gerando, assim, baixas pressões de aspiração. Esse grupo foi denominado de grupo manual (GM).
Da metade esquerda foram coletados 20 ml de gordura, empregando-se cânula de 3 mm de diâmetro e 25 cm de comprimento, acoplada a um coletor intermediário estéril e esse a uma máquina de vácuo sob pressão negativa constante de 350 mmHg. Esse grupo foi denominado de grupo a vácuo (GV).
Devidamente identificadas, as amostras foram centrifugadas por 3 minutos, sob força centrífuga relativa de 700 g. Após centrifugação, das 3 camadas que se formaram, tanto a superior como a inferior foram descartadas. A gordura das camadas intermediárias provenientes dos dois grupos, GM e GV, foram imediatamente encaminhadas ao Laboratório de Genética do Instituto de Biociências da Universidade de São Paulo e receberam o mesmo tratamento para contagem celular, estabelecimento de culturas e posterior imunofenotipagem.
As amostras de gordura foram submetidas a digestão enzimática com colagenase tipo Ia (Sigma Aldrich), na concentração de 0,5 mg/ml, em banho-maria à temperatura de 37ºC, por 30 minutos. A fase líquida, mais densa, foi coletada e a colagenase foi inativada com o meio de Hanks (Gibco, Invitrogen). Essa mistura foi centrifugada por 5 minutos a 500 g, para obtenção do aglomerado celular depositado no fundo do tubo, após descarte do sobrenadante.
Após resuspensão, os aglomerados celulares de cada grupo foram divididos em 4 alíquotas. Uma alíquota foi preparada com azul de Tripan a 0,05%, para a contagem celular automatizada (Countess Automated Cell Counter, Invitrogen). O número final de células foi determinado para cada centímetro cúbico de gordura digerida. Outra alíquota foi criopreservada, para permitir que novas análises pudessem ser realizadas, caso fosse necessário.
Executadas em duplicata, as alíquotas remanescentes foram semeadas em garrafas plásticas de 75 cm2, contendo DMEM/F12, MEM NEAA 1%, solução antibiótica de estreptomicina e penicilina 1% (Gibco, Invitrogen) e soro fetal bovino a 10% (Hyclone). As garrafas foram mantidas em estufa a 37ºC, contendo CO2 a 5%. O meio de cultura foi trocado a cada 3 dias até a obtenção de confluência celular de 85%, quando se estabeleceu a passagem zero (P0).
Nesse momento, as garrafas foram lavadas com solução salina tamponada e as células aderidas ao fundo foram tripsinizadas (0,125% trypsin, 0,02% EDTA em PBS). Pequenas alíquotas contendo 5 x 103 células cada, foram preparadas para receber os anticorpos monoclonais IgG contra as proteínas de membrana CD29, CD 31, CD34, CD44, CD45, CD73, CD90 e CD105. A citometria foi realizada utilizando-se o citômetro de fluxo Guava EasyCyte e a análise dos resultados com o programa Guava ExpressPlus (Guava Technologies Hayward, CA, USA).
Com o objetivo de comparar o número de células obtidas nos grupos GM e GV, foi empregado o teste t de Student para amostras pareadas, com nível de significância igual a 5%.
RESULTADOS
O grupo formado por 9 pacientes do sexo feminino, com média de idade de 46,7 anos (variação de 22 anos a 76 anos) e índice de massa corporal (IMC) médio de 24,9 kg/m2 (variação de 22 kg/m2 a 29,6 kg/m2) apresentou grande variabilidade quanto ao número de células obtidas da fração vásculo-estromal do tecido adiposo da região infraumbilical (Tabela 1).
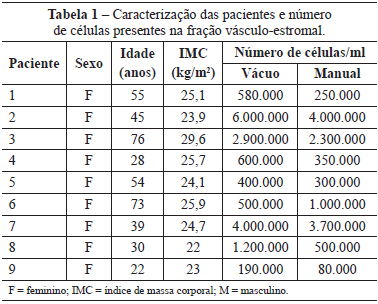
A média do número de células obtidas pelo método manual foi de 1,35 x 106 células, enquanto que no método a vácuo a média foi de 1,77 x 106 células.
Apesar de haver tendência de maior número de células no grupo GV quando comparado ao grupo GM (Figura 1), não houve diferença estatisticamente significativa (P = 0,094).
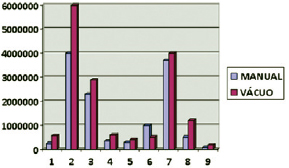
Figura 1 - Rendimento celular nos grupos manual e a vácuo.
A imunofenotipagem realizada na P0 demonstrou ausência de expressão de marcadores de linhagem endotelial (CD31-) e expressão muito fraca de marcadores de linhagem hematopoiética (CD34+ e CD45+) (Figura 2). Entretanto, os marcadores presentes em populações celulares de origem mesenquimal demonstraram-se fortemente positivos (CD29+, CD44+, CD 73+, CD90+ e CD105+) nas células obtidas da fração vásculo-estromal do tecido adiposo da região abdominal em ambos os grupos (Figura 3).
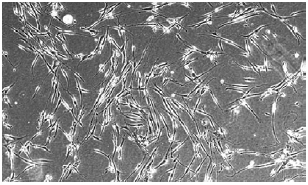
Figura 2 - Células isoladas da fração vásculo-estromal do tecido adiposo, em garrafa plástica contendo meio de cultivo de manutenção permitindo a confluência celular. Observa-se que as células apresentam formato alongado, contendo diversos prolongamentos dendríticos.
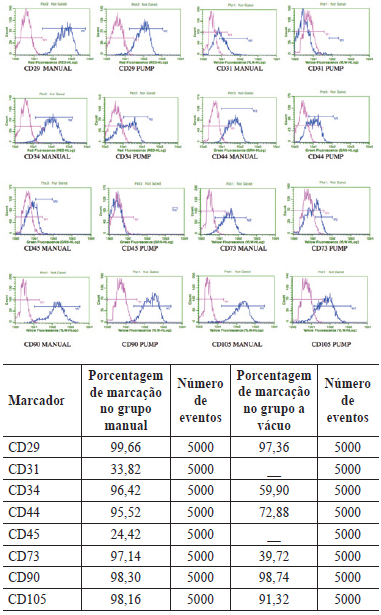
Figura 3 - Porcentagem de marcação e número de eventos nos grupos GM e GV com diferentes marcadores. Nos gráficos acima, a linha em magenta representa o controle e a linha em azul representa a expressão dos marcadores de superfície, que se mostrou semelhante nos grupos GM e GV. MANUAL = grupo manual (GM); PUMP = grupo a vácuo (GV).
DISCUSSÃO
Analisando-se a história dos enxertos de gordura, dos primórdios aos dias atuais, pode-se encontrar grande variabilidade de resultados na análise em longo prazo. Entretanto, os melhores resultados foram os obtidos por autores que manipularam o tecido adiposo com a preocupação de lesar o menor número possível de adipócitos durante obtenção, preparo e enxertia propriamente dita10,11. Nessa última etapa, permitir adequada nutrição e respiração celulares por meio da embebição plasmática, até que tenha início a neoangiogênese, é fundamental5. Como a participação de precursores adipocitários presentes na fração vásculo-estromal do enxerto de gordura tem importante papel na neoangiogênese, na diferenciação adipogênica e consequente manutenção volumétrica do enxerto no longo prazo, quanto maior o número dessas células no enxerto, melhor12,13.
A contagem celular demonstrou que, apesar da diferença entre os grupos GM e GV não ter sido significativa, o rendimento de células nucleadas presentes na fração vásculo-estromal no grupo GV foi maior. Apesar de não ser um teste de viabilidade celular direto, pois não avalia o metabolismo das células, o ensaio com azul de Tripan cora a membrana das células presentes na fração vásculo-estromal do tecido adiposo, onde se encontram células-tronco de comportamento mesenquimal (CTAD), macrófagos, pericitos, células-tronco hematopoiéticas e endoteliais, pré-adipócitos e fibroblastos, entre outras.
A realização da imunofenotipagem permitiu evidenciar que a pressão negativa não alterou a expressão dos marcadores de superfície na passagem zero (P0), demonstrando que a capacidade de diferenciação adipogênica permaneceu inalterada, assim como o perfil de expressão desses marcadores nessa passagem é semelhante aos encontrados na literatura14.
Com o objetivo de melhorar a integração dos adipócitos, algumas substâncias foram adicionadas aos enxertos de gordura, tais como interleucina 8 15, plasma rico em plaquetas16, insulina17, AMD 3100 18, entre outras. Entretanto, em virtude de resultados paradoxais, permaneceram no campo da biologia experimental. Com a descoberta da pluripotencialidade das CTAD9 e do simples processo de obtenção dessas células, Yoshimura et al.19 desenvolveram os enxertos de gordura enriquecidos com CTAD e os empregaram no tratamento de lipodistrofias faciais e hipomastias20. Esses enxertos de gordura enriquecidos com CTAD também foram empregados em complicações com implantes mamários de silicone21. Entretanto, houve grande variabilidade nas taxas de integração desses enxertos.
Ainda não está completamente esclarecido o real papel dos precursores do tecido adiposo presentes nos enxertos de gordura durante o processo de integração dos mesmos, assim como o papel da suplementação desses enxertos com as células provenientes da fração vásculo-estromal do tecido adiposo maduro. Considerando a inexistência de estudos prospectivos aleatorizados comparando resultados clínicos de longo prazo de enxertos de gordura com e sem enriquecimento celular, não é possível afirmar, no momento, se o aumento da proporção de CTAD nos enxertos ou se alguma sinalização celular prévia deve ser realizada conjuntamente para obtenção taxas de integração maiores. Entretanto, o desenvolvimento de métodos que otimizem a obtenção das células da fração vásculo-estromal são necessários.
Este estudo corrobora os dados encontrados por Mojallal et al.22 e demonstra que a aspiração manual, empregando-se seringas de 10 cc, com baixas pressões, apresenta menor lise de adipócitos maduros, contudo rende menor número de células presentes na fração vásculo-estromal. Aguena et al.23 demonstraram que a região do abdome abaixo da cicatriz umbilical apresenta maior rendimento de células nucleadas presentes na fração vásculo-estromal quando comparado aos flancos; achados que corroboram o trabalho de Jurgens et al.24.
Apesar da grande variabilidade individual, o rendimento celular por centímetro cúbico de gordura mostrou-se compatível com os existentes na literatura25 e, apesar deste estudo não ter realizado ensaios de formação de colônias (CFU-F), o tempo necessário para ocorrer confluência celular de 85% foi o mesmo em ambos os grupos e este achado denota que a pressão negativa de 350 mmHg não alterou a velocidade de crescimento celular (doubling time). Kurita et al.26 demonstraram que forças centrífugas relativas de até 4200 g são seguras para as células nucleadas presentes na fração vásculo-estromal do tecido adiposo.
Em congruência com os resultados de Mitchell et al.14, a imunofenotipagem realizada na passagem zero (P0) demonstrou-se homogênea entreas amostras deambos os grupos (GM e GV) e os anticorpos identificaram marcadores de superfície com padrão de células-tronco de linhagem mesenquimal, o que atesta sua capacidade de diferenciação adipogênica.
CONCLUSÕES
Este estudo permite concluir que o emprego de pressão negativa de 350 mmHg é seguro para a obtenção das células-tronco adipoderivadas e o rendimento celular entre os dois grupos não apresentou diferença estatisticamente significativa. Considerando a possibilidade do uso dessas células, em salas de cirurgia, enriquecendo enxertos de gordura imediatamente após a sua extração, faz-se necessária a realização da imunofenotipagem nas amostras frescas da fração vásculo-estromal. Futuros estudos deverão ser realizados para se estabelecer qual a melhor taxa de enriquecimento dos enxertos de gordura com as células-tronco adipoderivadas, objetivando-se melhores resultados clínicos no longo prazo.
REFERÊNCIAS
1. Billings E Jr, May JW Jr. Historical review and present status of free fat graft autotransplantation in plastic and reconstructive surgery. Plast Reconstr Surg. 1989;83(2):368-81.
2. Ellenbogen R. Fat transfer: current use in practice. Clin Plast Surg. 2000;27(4):545-56.
3. Illouz YG. Body contouring by lipolysis: a 5-year experience with over 3000 cases. Plast Reconstr Surg. 1983;72(5):591-7.
4. Coleman SR. Facial recontouring with lipostructure. Clin Plast Surg. 1997;24(2):347-67.
5. Coleman SR. Structural fat grafting: more than a permanent filler. Plast Reconstr Surg. 2006;118(3 suppl.):108S-20S.
6. Hausberger FX. Quantitative studies on the development of auto-transplants of immature adipose tissue of rats. Anat Rec. 1955;122(4):507-15.
7. Van RL, Roncari DA. Complete differentiation in vivo of implanted cultured adipocyte precursors from adult rats. Cell Tissue Res. 1982;225(3):557-66.
8. Rodeheffer MS, Birsoy K, Friedman JM. Identification of white adipocyte progenitor cells in vivo. Cell. 2008;135(2):240-9.
9. Zuk PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 2001;7(2):221-28.
10. Pu LL, Coleman SR, Cui X, Ferguson RE Jr, Vasconez HC. Autologous fat grafts harvested and refined by the Coleman technique: a comparative study. Plast Reconstr Surg. 2008;122(3):932-7.
11. Ramon Y, Shoshani O, Peled IJ, Gilhar A, Carmi N, Fodor L, et al. Enhancing the take of injected adipose tissue by a simple method for concentrating fat cells. Plast Reconstr Surg. 2005;115(1):197-201.
12. Planat-Bernard V, Silvestre JS, Cousin B, André M, Nibbelink M, Tamarat R, et al. Plasticity of human adipose lineage cells toward endothelial cells: physiological and therapeutic perspectives. Circulation. 2004;109(5):656-63.
13. Rehman J, Traktuev D, Li J, Merfeld-Clauss S, Temm-Grove CJ, Bovenberk JE, et al. Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells. Circulation. 2004;109(10):1292-8.
14. Mitchell JB, McIntosh K, Zvonic S, Garrett S, Floyd ZE, Kloster A, et al. Immunophenotype of human adipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 2006;24:376-85.
15. Shoshani O, Livne E, Armoni M, Shupak A, Berger J, Ramon Y, et al. The effect of interleukin-8 on the viability of injected adipose tissue in nude mice. Plast Reconstr Surg. 2005;115(3):853-9.
16. Salgarello M, Visconti G, Rusciani A. Breast fat grafting with plateletrich plasma: a comparative clinical study and current state of the art. Plast Reconstr Surg. 2011;127(6):2176-85.
17. Lu F, Li J, Gao J, Ogawa R, Ou C, Yang B,et al. Improvement of the survival of human autologous fat transplantation by using VEGF-transfected adipose-derived stem cells. Plast Reconstr Surg. 2009;124(5):1437-46.
18. Butala P, Sultan SM, Davidson EH, Crawford JL, Szpalski C, Knobel D, et al. Progenitor cell mobilization augments fat graft survival. Plast Reconstr Surg. 2010;126(4):56-7.
19. Yoshimura K, Sato K, Aoi N, Kurita M, Inoue K, Suga H, et al. Cell-assisted lipotransfer for facial lipoatrophy: efficacy of clinical use of adipose-derived stem cells. Dermatol Surg. 2008;34(9):1178-85.
20. Yoshimura K, Sato K, Aoi N, Kurita M, Hirohi T, Harii K. Cell-assisted lipotransfer for cosmetic breast augmentation: supportive use of adipose-derived stem/stromal cells. Aesthetic Plast Surg. 2008;32(1):48-55.
21. Yoshimura K, Asano Y, Aoi N, Kurita M, Oshima Y, Sato K, et al. Progenitor-enriched adipose tissue transplantation as rescue for breast implant complications. Breast J. 2010;16(2):169-75.
22. Mojallal A, Auxenfans C, Lequeux C, Braye F, Damour O. Influence of negative pressure when harvesting adipose tissue on cell yield of the stromal-vascular fraction. Biomed Mater Eng. 2008;18(4-5):193-7.
23. Aguena M, Fanganiello RD, Tissiani LA, Ishiy FA, Atique R, Alonso N, et al. Optimization of parameters for a more efficient use of adipose-derived stem cells in regenerative medicine therapies. Stem Cells Int. 2012;2012:303610.
24. Jurgens WJ, Oedayrajsingh-Varma MJ, Helder MN, Zandiehdoulabi B, Schouten TE, Kuik DJ, et al. Effect of tissue-harvesting site on yield of stem cells derived from adipose tissue: implications for cell-based therapies. Cell Tissue Res. 2008;332(3):415-26.
25. Aust L, Devlin B, Foster SJ, Halvorsen YD, Hicok K, du Laney T, et al. Yield of human adipose-derived adult stem cells from liposuction aspirates. Cytotherapy. 2004;6(1):7-14.
26. Kurita M, Matsumoto D, Shigeura T, Sato K, Gonda K, Harii K, et al. Influences of centrifugation on cells and tissues in liposuction aspirates: optimized centrifugation for lipotransfer and cell isolation. Plast Reconstr Surg. 2008;121(3):1033-41.
1. Cirurgião plástico, doutorando do Programa de Pós-Graduação da Faculdade de Medicina da Universidade de São Paulo (FMUSP), membro titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), São Paulo, SP, Brasil.
2. Doutora em Ciências Biológicas, bióloga do Genoma Humano, Instituto de Biociências da Universidade de São Paulo (USP), São Paulo, SP, Brasil.
3. Livre-docente, professora titular do Departamento de Genética Evolutiva do Instituto de Biociências da USP, São Paulo, SP, Brasil.
4. Livre-docente, professor associado da FMUSP, cirurgião plástico, membro titular da SBCP, São Paulo, SP, Brasil.
Correspondência para:
Nivaldo Alonso
Rua Afonso Braz, 473 - cj. 65 - Vila Nova Conceição
São Paulo, SP, Brasil - CEP 04511-010
E-mail: nivalonso@gmail.com
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 15/7/2012
Artigo aceito: 30/10/2012
Trabalho realizado no Hospital Municipal Carmino Caricchio, no Instituto de Biociências da Universidade de São Paulo e na Faculdade de Medicina da Universidade de São Paulo, São Paulo, SP, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter