

Original Article - Year 2012 - Volume 27 -
Construção de substituto da pele composto por matriz de colágeno porcino povoada por fibroblastos dérmicos e queratinócitos humanos: avaliação histológica
Construction of a skin substitute composed of porcine collagen matrix populated with human dermal fibroblasts and keratinocytes: histological evaluation
RESUMO
INTRODUÇÃO: O uso de enxertos autólogos é limitado pela extensão da área doadora e pelo estado clínico dos pacientes, no caso de lesões extensas. Alotransplantes coletados de cadáveres ou voluntários são rejeitados após uma ou duas semanas, servindo apenas como cobertura temporária para essas lesões. O tratamento de grandes lesões cutâneas com tegumento autólogo reconstruído constitui alternativa atraente, já que, a partir de um pequeno fragmento de pele do paciente, pode-se obter culturas de células que se multiplicam rapidamente e podem ser criopreservadas, permitindo, assim, sua utilização em novos tratamentos por tempo indeterminado. Este estudo pretendeu avaliar o comportamento histológico de queratinócitos e fibroblastos humanos cultivados sobre uma matriz de colágeno porcino derivada da submucosa intestinal.
MÉTODO: Células da epiderme e derme humana foram cultivadas separadamente e semeadas sobre matriz de colágeno porcino, onde permaneceram em ambiente controlado por 21 dias, antes de serem submetidas a análise histológica.
RESULTADOS: Observou-se que os fibroblastos invadem e colonizam a matriz de colágeno, enquanto os queratinócitos se organizam de forma laminar e estratificada sobre a superfície em que foram semeados.
CONCLUSÕES: A utilização da matriz de colágeno porcino como carreador de células da pele humana é possível e a organização dessas células se assemelha à arquitetura da pele humana.
Palavras-chave: Engenharia tecidual. Técnicas de cultura de células. Células cultivadas. Queimaduras/terapia.
ABSTRACT
BACKGROUND: In the case of extensive lesions, the use of autologous grafts is limited by the extent of the donor area and the clinical condition of patients. Allografts collected from cadavers or volunteers are usually rejected after 1 to 2 weeks, thus serving only as temporary cover for these lesions. Treating major cutaneous lesions with reconstructed autologous skin is an attractive alternative, because it is possible to obtain cultures of cells that multiply rapidly and can be cryopreserved from a small fragment of the patient's skin, thereby facilitating its indefinite use in new treatments. This study evaluated the histological behavior of cultured human keratinocytes and fibroblasts on a collagen matrix derived from porcine small intestinal submucosa.
METHODS: Cells from human epidermis and dermis were grown separately and seeded on porcine collagen matrix, which was maintained in a controlled environment for 21 days before being subjected to histological analysis.
RESULTS: Fibroblasts invaded and colonized the collagen matrix, whereas keratinocytes were organized in laminated and stratified layers on the surface on which they were seeded.
CONCLUSIONS: The use of porcine collagen matrix as a support for human skin cells is feasible, and the organization of these cells resembles the architecture of human skin.
Keywords: Tissue engineering. Cell culture techniques. Cells, cultured. Burns/therapy.
Situações clínicas, como queimaduras, traumatismos, infecções, doenças autoimunes e o que classificamos como feridas complexas, podem resultar na perda completa do revestimento cutâneo1. Essa dissolução da barreira cutânea predispõe a infecções, aumento das perdas insensíveis de água e alteração da regulação térmica, gerando aumento de morbidade, internações prolongadas com alto custo ou até ocasionando a morte do indivíduo. Uma solução consagrada pela cirurgia plástica tem sido a enxertia de pele alógena, porém há pacientes em que pode ocorrer escassez de áreas doadoras cutâneas, um problema ainda não totalmente solucionado pela comunidade médica. Assim, atualmente há muito interesse em materiais sintéticos ou biológicos que possam ser utilizados como substitutos cutâneos2.
Incluem-se como opções de tratamento para as grandes perdas de pele os substitutos cutâneos, sejam eles de pele humana ou de origem sintética. Exemplos disso são os aloenxertos (derivados da pele de cadáver), xenoenxertos (derivados da pele de animais) ou sintéticos construídos por engenharia de tecidos. A decisão de qual substituto cutâneo empregar é influenciada por fatores como tipo, tamanho e profundidade da ferida, comorbidades presentes, preferências do paciente e experiência do cirurgião.
O enxerto alógeno de pele pode ser usado para teste terapêutico do leito receptor; se houver boa integração, aumentam as chances de sucesso da autoenxertia, diminuindo o risco de perda dos tecidos autógenos escassos. Isso pode ser especialmente importante em pacientes grandes queimados ou vítimas de traumas extensos3.
A primeira tentativa de fabricação de substitutos cutâneos a partir de cultura de células epidérmicas foi descrita, em 1974, por Rheinwald & Green4, quando um pequeno fragmento de pele saudável foi cultivado até que uma lâmina suficiente de queratinócitos fosse produzida para cobrir a ferida. Apesar da inovação tecnológica que a ideia de se "construir pele" trazia, há desvantagens no uso desse procedimento, como o retardo na enxertia de aproximadamente 3 a 4 semanas (tempo necessário para desenvolvimento do epitélio), fragilidade, menor resistência à infecção e maior incidência de perda do enxerto. O sucesso do enxerto dependeria da presença de elementos dérmicos remanescentes ou transportados para o leito dessa ferida, motivando, assim, novas pesquisas sobre substitutos cutâneos2.
Dá-se o nome de substitutos cutâneos a um grupo heterogêneo de elementos biológicos e/ou sintéticos que possibilitam a oclusão temporária ou permanente das feridas. Podemos considerar como substituto dérmico desde o xeno ou aloenxerto de pele até a combinação de cultura de queratinócitos autólogos sobre matriz dérmica, em busca da maior semelhança possível com a pele do paciente5,6.
Diversos estudos têm descrito a utilização de matriz dérmica glicerolada e descelularizada como arcabouço para desenvolvimento de células cultivadas, como queratinócitos e fibroblastos7-9, ou mesmo células mesenquimais10.
Outros estudos propõem diferentes polímeros como matrizes de sustentação para essas células11,12. Constituída por substância similar à derme humana, a matriz de colágeno porcino derivada da submucosa intestinal (OASIS® - Cook Biotech, Inc., West Lafayette, Estados Unidos) é consagrada na literatura por sua capacidade de interferir no processo de cicatrização13.
O objetivo deste estudo foi avaliar o comportamento histológico de queratinócitos e fibroblastos humanos cultivados sobre uma matriz de colágeno porcino derivada da submucosa intestinal, usada como matriz de sustentação dessas células.
MÉTODO
Este estudo foi aprovado pela Comissão de Ética para Análise de Projetos de Pesquisa - CAPPesq da Diretoria Clínica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP) e foi realizado no Laboratório de Pesquisa em Cultura de Células e Cicatrização de Feridas (LIM 04) da Disciplina de Cirurgia Plástica do HCFMUSP (São Paulo, SP, Brasil).
Cultura de Células
Queratinócitos e fibroblastos provenientes de pele normal foram obtidos a partir de excedentes de pele oriundos de 5 pacientes do sexo feminino, com idade entre 20 anos e 35 anos, de cores branca e parda.
As amostras de pele foram doadas, para finalidade de pesquisa, por ocasião de sua ressecção cirúrgica e cedidas pelo Banco de Tecidos do Instituto Central do HCFMUSP para a realização deste estudo.
Cultura de Queratinócitos
Para isolamento de queratinócitos, fragmentos cutâneos foram recortados e imersos em solução enzimática de tripsina a 0,05% (EDTA, do inglês Ethylenediamine Tetraacetic Acid) a 0,02% (GIBCO, Life Technologies, Baltimore, Estados Unidos) e mantidos sob agitação a 37ºC, para que haja desprendimento das células contidas nesses fragmentos. A suspensão de células foi centrifugada a 1.500 rpm, durante 5 minutos, e o pellet de células resultante foi ressuspendido em volume conhecido de Dulbecco's Modified Eagle's Medium (DMEM) (GIBCO). O número de células por mililitro de diluente (céls/ml) foi estabelecido pela contagem em câmara hemocitométrica de Neubauer, de acordo com protocolo proposto por Rheinwald & Green14.
O total de células obtido foi semeado em frascos para cultivo celular de 25 cm2 de superfície sobre uma camada de sustentação (feeder layer) composta por fibroblastos CCL-92 irradiados, na proporção de 2 x 106 queratinócitos/ 25 cm2 e mantidos em Keratinocyte Growth Medium (KGM) a saber: 60% de meio DMEM, 30% de meio Ham F12 (GIBCO), 10% de soro bovino fetal (GIBCO), glutamina (GIBCO) (4 mM), adenina (SIGMA Chemical, St. Louis, Estados Unidos) (0,18 mM), insulina (SIGMA) (5 mg/ml), hidrocortisona (SIGMA) (0,4 mg/ml), toxina da cólera (SIGMA) (0,1 mM), tri-iodotironina (SIGMA) (2 mM), fator de crescimento epidérmico (EGF - SIGMA) (10 ng/ml) e solução antibiótica de penicilina, 100 UI/ml-estreptomicina, 100 mg/ml (GIBCO). O meio de cultura foi trocado a cada 48 horas, até a subconfluência celular, quando essas culturas foram amplificadas pela adição da solução de tripsina a 0,05%/ácido etilenodiaminotetracético (EDTA) a 0,02% (GIBCO), durante 15 minutos. A cada amplificação, o número de células será contado em hemocitômetro.
Cultura de Fibroblastos
Da mesma forma, células obtidas por digestão enzimática foram depositadas em frascos de 25 cm2 contendo meio de cultura para fibroblastos, a saber: meio de DMEM acrescido de 10% de soro bovino fetal com estreptomicina 100 mg/ml, penicilina 100 UI/ml e anfotericina B 0,25 mg/ml. Os frascos foram mantidos em estufa a 37ºC, em uma atmosfera de 5% de CO2 e o meio de cultura trocado a cada 72 horas, até aspecto de subconfluência celular, quando essas culturas foram amplificadas.
Os ensaios de semeadura celular sobre matriz foram realizados sob condições assépticas e em ambiente controlado, utilizando-se apenas materiais e reagentes esterilizados.
Culturas Secundárias de Queratinócitos e Fibroblastos sobre Matrizes Dérmicas de Colágeno Porcino (OASIS®)
Aproximadamente 3 x 105 fibroblastos e 3 x 105 queratinócitos suspensos em 1 ml de meio de cultura foram semeados, individualmente ou em conjunto, dentro de anéis de aço inoxidável, com 1 cm de diâmetro, acomodados sobre os fragmentos de matriz de colágeno porcino de 4 cm2 de área. Após 24 horas, esses anéis foram removidos e o meio de cultura trocado.
As culturas foram mantidas em incubadora com ambiente controlado, sendo o meio de cultivo trocado a cada 2 dias, até o 7º dia de estudo, quando as matrizes repovoadas por células foram suspensas em grelhas de aço inoxidável, de maneira que apenas a base dérmica ficasse em contato com o meio de cultura e os queratinócitos expostos ao ar, criando-se a situação de cultivo na interface ar-líquido, como proposto, em 1989, por Regnier & Darmon15. O meio de cultivo foi trocado a cada 2 dias, até o 14º dia de estudo, e diariamente, até o 21ºdia, quando o protocolo foi concluído.
Fragmentos de membrana de colágeno porcino sem adição de células foram mantidos nas mesmas condições, para que servissem como controle dos experimentos.
Análise Histológica
Após o período determinado, os fragmentos de matriz de colágeno com e sem células foram preservados em formol a 10% e encaminhados ao Serviço de Histologia da Faculdade de Medicina da Universidade de São Paulo, para que fossem confeccionadas lâminas histológicas coradas com hematoxilina-eosina e pela técnica de picrosirius e analisadas à microscopia de luz.
RESULTADOS
O aspecto histológico das matrizes controle (sem adição de células) coradas com hematoxilina-eosina e por picrosirius pode ser observado na Figura 1.
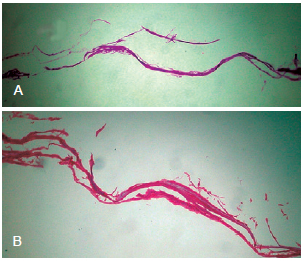
Figura 1 - Em A, matriz de colágeno de submucosa intestinal porcina (OASIS®) sem adição de células (microscopia óptica, hematoxilina-eosina, 100x). Em B, matriz de colágeno de submucosa intestinal porcina (OASIS®) sem adição de células (microscopia óptica, picrosirius, 100x).
Fibroblastos, quando semeados sobre a matriz, migraram para seu interior, povoando a rede de colágeno (Figura 2).
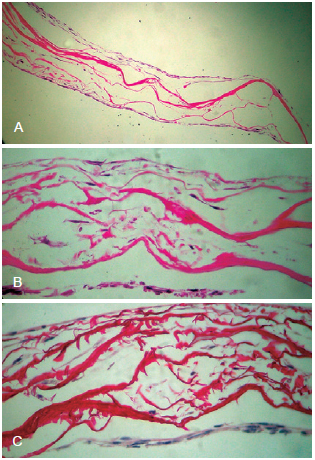
Figura 2 - Microscopia óptica. Em A, rede de colágeno denso disposta em feixes, com fibroblastos entremeados (hematoxilina-eosina, 100x). Em B, detalhe da distribuição celular entre os feixes de colágeno (hematoxilina-eosina, 400x). Em C, detalhe da distribuição celular entre os feixes de colágeno (picrosirius, 400x).
Quando semeados sobre a matriz de colágeno, os queratinócitos se organizaram em camada estratificada (Figura 3).
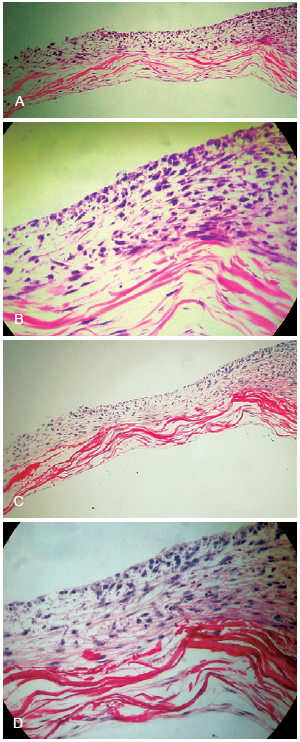
Figura 3 - Em A, rede de colágeno denso disposta em feixes intercalados por fibroblastos e recobertos por queratinócitos estratificados sobre uma das faces da matriz, após 21 dias de cultivo (microscopia óptica, hematoxilina-eosina, 100x). Em B, detalhe da distribuição de fibroblastos entre os feixes de colágeno e uma estratificação dos queratinócitos em seus rostos (microscopia óptica, hematoxilina-eosina, 400x). Em C, rede de colágeno denso disposta em feixes intercalados com fibroblastos e queratinócitos estratificados sobre uma das faces da matriz, após 21 dias de cultivo (microscopia óptica, picrosirius, 100x). Em D, detalhe da distribuição de fibroblastos entre os feixes de colágeno e uma estratificação dos queratinócitos em seus rostos (microscopia óptica, picrosirius, 400x).
DISCUSSÃO
Substitutos de pele contendo queratinócitos e fibroblastos cultivados sobre diferentes matrizes têm sido desenvolvidos6. Modelos de pele humana reconstruída utilizando-se derme humana ou animal desepidermizada, matrizes inertes, géis de colágeno, colágeno liofilizado e outros polímeros preenchidos com melanócitos e/ou células de Langerhans têm sido descritos na literatura. Esses equivalentes pretendem mimetizar a pele in vivo, fornecendo informações sobre interações célula-célula e célula-matriz, respostas das células dérmicas e epiteliais a sinais biológicos e agentes farmacológicos, bem como efeitos de drogas e fatores de crescimento na cicatrização de feridas10.
Assim como Lazic & Falanga16, nosso grupo acredita que substitutos de pele utilizando células cultivadas podem proporcionar grande avanço no tratamento clínico e/ou cirúrgico das feridas6. É sabido que, nas lesões ulceradas com mais de 3 semanas de existência, há processo inflamatório crônico com presença prolongada de macrófagos, linfócitos T e neutrófilos. Há também aumento de metaloproteases que degradam fatores de crescimento e proteínas de adesão na matriz extracelular. Além disso, existem, na ferida, fibroblastos senescentes com capacidade de migração deficitária e respostas inadequadas aos fatores de crescimento, originando uma matriz extracelular deteriorada, o que dificulta o processo de cicatrização17.
Com o intuito de modificar as características dessa matriz extracelular, há no mercado alguns produtos que pretendem melhorar o leito da ferida, incrementando os processos de cicatrização e integração de enxertos.
Um desses produtos, proveniente de desenvolvimento biotecnológico, que auxilia na granulação e epitelização de lesões, impedindo perda de líquidos e infecção de bactérias, é uma matriz tridimensional de colágeno derivado de submucosa intestinal porcina, com, aproximadamente, 0,15 mm de espessura (OASIS®).
Diferentemente de outros produtos, o OASIS® apresenta componentes da matriz extracelular de forma ativa e intacta, como glicosaminoglicanas (ácido hialurônico), proteoglicanas, fibronectinas, FGF (basic fibroblast grown factor) e βTGF (transforming growth factor beta)18.
Neste estudo foi avaliado o comportamento de células da pele humana (queratinócito e fibroblastos) quando semeados sobre essa matriz de colágeno porcino, com o intuito de construir um substituto cutâneo. A avaliação da capacidade de crescimento celular sobre matrizes foi feita utilizando-se colorações histológicas adequadas, que permitissem a observação dos fenômenos ocorridos.
A coloração hematoxilina-eosina é a principal técnica de coloração de tecidos em histologia. Por meio dessa técnica, é possível diferenciar partes basófilas (pela hematoxilina) e acidófilas ou eosinófilas (pela eosina), em decorrência da atração da hematoxilina por substâncias ácidas componentes dos tecidos, como as proteínas, ricas em radicais amina, os núcleos e o retículo endoplasmático rugoso e ácidos nucleicos. Já a eosina, sendo basófila, colore predominantemente citoplasma, fibras de colágeno e outras estruturas compostas de substâncias com caráter básico19.
A coloração pelo método do picrosirius faz com que grande quantidade de moléculas do Sirius Red, de caráter ácido, disponha-se paralelamente às moléculas do colágeno. Assim, o método da coloração com picrosirius é específico para detecção de estruturas compostas de moléculas de colágeno orientadas20.
O composto dermoepidérmico proposto neste estudo foi executado sem dificuldade, podendo ser facilmente reproduzido, pois se trata de uma base dérmica simplificada com predomínio de colágeno tipo I, sobre a qual foram semeados fibroblastos e queratinócitos humanos. Foi observado que, durante o crescimento do epitélio cultivado, houve diferenciação celular dos queratinócitos, com consequente estratificação da epiderme. Nas imagens histológicas é possível a visualização da produção de queratina (Figura 3).
O cultivo de queratinócitos em interface ar-líquido gera uma estrutura epitelial mais bem formada, com células mais diferenciadas e mais próximas das encontradas no tecido normal. Apesar da formação de epitélio confluente e estratificado, pode-se notar certa desorganização celular, talvez decorrente de alguma malformação da membrana basal. Estudos por microscopia eletrônica serão necessários para elucidar esse fato.
CONCLUSÕES
Este estudo comprovou ser possível estabelecer um composto dermoepidérmico, que, com mais testes e algumas modificações, pode se tornar uma opção interessante no tratamento de pacientes queimados com falta de área doadora ou portadores de feridas crônicas.
REFERÊNCIAS
1. Ferreira MC, Tuma Jr. P, Carvalho VF, Kamamoto F. Complex wounds. Clinics. 2006;61(6):571-8.
2. Atiyeh BS, Costagliola M. Cultured epithelial autograft (CEA) in burn treatment: three decades later. Burns. 2007;33(4):405-13.
3. Catena F, Ansaloni L, Gazzotti F, Gagliardi S , Di Saverio S, D'Alessandro L, et al. Use of porcine dermal collagen graft (Permacol) for hernia repair in contaminated fields. Hernia. 2007;11(1):57-60.
4. Rheinwald JG, Green H. Growth of cultured mammalian cells on secondary glucose sources. Cell. 1974;2(4):287-93.
5. Shores JT, Gabriel A, Gupta S. Skin substitutes and alternatives: a review. Adv Skin Wound Care. 2007;20(9):493-508.
6. Paggiaro AO, Isaac C, Bariani G, Mathor M, Herson MR, Ferreira MC. Construção de equivalente dermo-epidérmico. Rev Soc Bras Cir Plást. 2007;22(3):153-7.
7. Herson MR, Mathor MB, Altran S, Capelozzi VL, Ferreira MC. In vitro construction of a potential skin substitute through direct human keratinocyte plating onto decellularized glycerol-preserved allodermis. Artif Organs. 2001;25(11):901-6.
8. Rehder J, Souto LR, Issa CM, Puzzi MB. Model of human epidermis reconstructed in vitro with keratinocytes and melanocytes on dead deepidermized human dermis. Sao Paulo Med J. 2004;122(1):22-5.
9. Bello YM, Falabella AF, Eaglstein WH. Tissue-engineered skin. Current status in wound healing. Am J Clin Dermatol. 2001;2(5):305-13.
10. Pianigiani E, Ierardi F, Mazzanti B, Saccardi R, Cuciti C, Fimiani M. Human de-epidermized dermis as a stem cell carrier. Transplant Proc. 2010;42(6):2244-6.
11. Selim M, Bullock AJ, Blackwood KA, Chapple CR, MacNeil S. Developing biodegradable scaffolds for tissue engineering of the urethra. BJU Int. 2011;107(2):296-302.
12. Shahabeddin L, Berthod F, Damour O, Collombel C. Characterization of skin reconstructed on a chitosan-cross-linked collagen-glycosaminoglycan matrix. Skin Pharmacol. 1990;3(2):107-14.
13. Mostow EN, Haraway GD, Dalsing M, Hodde JP, King D; OASIS Venus Ulcer Study Group. Effectiveness of an extracellular matrix graft (OASIS Wound Matrix) in the treatment of chronic leg ulcers: a randomized clinical trial. J Vasc Surg. 2005;41(5):837-43.
14. Rheinwald JG, Green H. Formation of a keratinizing epithelium in culture by a cloned cell line derived from a teratoma. Cell. 1975;6(3):317-30.
15. Regnier M, Darmon M. Humanepidermis reconstructed in vitro:a model to study keratinocyte differentiation and its modulation by retinoic acid. In Vitro Cell Dev Biol. 1989;25(11):1000-8.
16. Lazic T, Falanga V. Bioengineered skin constructs and their use in wound healing. Plast Reconstr Surg. 2011;127(S1):75S-90S.
17. Moore K, Huddleston E, Stacey MC, Harding KG. Venous leg ulcers: the search for a prognostic indicator. Int Wound J. 2007;4(2):163-72.
18. Niezgoda JA, Van Gils CC, Frykberg RG, Hodde JP. Randomized clinical trial comparing OASIS wound matrix to regranex gel for diabetic ulcers. Adv Skin Wound Care. 2005;18(5 Pt 1):258-66.
19. Bancroft JD, Stevens A. Theory and practice of histological techniques. 2nd ed. New York: Churchill Livingstone;1982. p111.
20. Junqueira LC, Bignolas G, Brentani RR. Picrosirius staining plus polarization microscopy, a specific method for collagen detection in tissue sections. Histochem J. 1979;11(4):447-55.
1. Doutor, responsável pelo Laboratório de Pesquisa em Cultura de Células e Cicatrização de Feridas (LIM 04) da Disciplina de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP), São Paulo, SP, Brasil.
2. Acadêmico de Medicina da Faculdade de Medicina da Universidade de São Paulo, São Paulo, SP, Brasil.
3. Mestre, pesquisadora do Laboratório de Pesquisa em Cultura de Células e Cicatrização de Feridas (LIM 04) da Disciplina de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
4. Biomédica, mestranda, pesquisadora do Laboratório de Pesquisa em Cultura de Células e Cicatrização de Feridas (LIM 04) da Disciplina de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
5. Médico residente da Disciplina de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
6. Doutor, responsável pelo Banco de Tecidos do Instituto Central do HCFMUSP, São Paulo, SP, Brasil.
7. Professor titular da Disciplina de Cirurgia Plástica do HCFMUSP, São Paulo, SP, Brasil.
Correspondência para:
Cesar Isaac
Avenida Doutor Arnaldo, 455 - sala 1.363 - Pinheiros
São Paulo, SP, Brasil - CEP 01246-903
E-mail: cesaris@uol.com.br
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 17/8/2012
Artigo aceito: 19/10/2012
Trabalho laureado com o "Prêmio Roberto Correa Chem", da Sociedade Brasileira de Cirurgia Plástica, durante o 49ºCongresso Brasileiro de Cirurgia Plástica (2012).
Trabalho realizado no Laboratório de Pesquisa em Cultura de Células e Cicatrização de Feridas (LIM 04) da Disciplina de Cirurgia Plástica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP), São Paulo, SP, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter