

Original Article - Year 2012 - Volume 27 -
Tratamento de mamas tuberosas com incisões combinadas
Treatment of tuberous breast with combined incisions
RESUMO
INTRODUÇÃO: A deformidade tuberosa da mama é uma rara entidade, descrita por Rees e Aston em 1976. O desenvolvimento mamário encontra-se alterado, com herniação do parênquima pelo complexo areolopapilar, alargamento dessa estrutura e hipoplasia do tecido mamário, principalmente nos quadrantes inferiores. A mama, portanto, adquire um aspecto tubular ao invés do aspecto cônico natural.
MÉTODO: No total, 4 pacientes foram submetidas a tratamento cirúrgico em um único tempo, com incisões combinadas: inframamária e periareolar. Detalhes técnicos devem ser individualizados para cada caso, conforme a gravidade e a classificação do tipo de mama tuberosa.
RESULTADOS: O procedimento cirúrgico utilizado aborda todos os aspectos da deformidade da mama tuberosa em operação de um estágio. Cirurgia de revisão de cicatriz periareolar não foi necessária em nenhum caso. Em todos os casos, obteve-se resultado estético final aceitável e com satisfação da paciente e do cirurgião. O procedimento adotado não interfere em lactações futuras.
CONCLUSÕES: A mama tuberosa representa um verdadeiro desafio terapêutico. A técnica utilizada é muito atraente e mostra resultados confiáveis e reprodutíveis.
Palavras-chave: Mama/cirurgia. Mamoplastia. Cirurgia plástica/métodos.
ABSTRACT
BACKGROUND: Tuberous breast deformity is a rare entity, first described by Rees and Aston in 1976. In this condition, breast development is altered, with herniation of the parenchyma through the nipple-areolar complex, enlargement of this structure, and hypoplasia of the breast tissue, especially in the lower quadrants. The breast thus acquires a tubular shape rather than the natural conical look.
METHODS: Four patients underwent a single surgical treatment, with combined inframammary and periareolar incisions. Technical details must be individualized for each case depending on the severity and classification type of the tuberous breasts.
RESULTS: The surgical procedure used covers all aspects of tuberous breast deformity in a single-stage operation. Revision of periareolar surgery scar was not necessary in any case. In all cases, the final aesthetic result was satisfactory for the patient and the surgeon. The procedure adopted does not interfere with future lactation.
CONCLUSIONS: Tuberous breast represents a real therapeutic challenge. The technique reported herein is very attractive and provides reliable and reproducible results.
Keywords: Breast/surgery. Mammaplasty. Plastic surgery/methods.
A deformidade tuberosa da mama é uma rara entidade, que acomete mulheres jovens, uni ou bilateralmente. Sua incidência e prevalência exatas são desconhecidas em decorrência do subdiagnóstico e da ausência de correlação clínica em casos de assimetria mamária. Foi primeiramente descrita por Rees e Aston1, em 1976. A deformidade recebeu essa denominação pela semelhança com raízes de plantas tuberosas.
Embriologicamente, a mama inicia seu desenvolvimento na quinta semana de vida intrauterina, a partir do ectoderma. Entre 10 semanas e 14 semanas, os brotos mamários da região torácica são envolvidos por uma lâmina de tecido mesodérmico, denominada fáscia superficial. O crescimento tanto glandular como areolopapilar é completo na puberdade e a fáscia superficial é a principal estrutura responsável pela conformação cônica das mamas.
A formação de mamas tuberosas decorre da inexistência da lâmina superior da fáscia superficial ao redor do complexo areolopapilar e de seu espessamento com formação de um anel fibroso na região periareolar. Em decorrência disso, o desenvolvimento mamário é alterado, com pseudo-herniação do parênquima pelo complexo areolopapilar e alargamento dessa estrutura, além de redução dos diâmetros horizontal e vertical, com constrição da base da mama. Há hipoplasia do parênquima mamário, principalmente nos quadrantes inferiores, e elevação do sulco inframamário (Figura 1). Todas essas alterações alteram a conformação das mamas, que adquirem aspecto tubular, ao invés do aspecto cônico natural1.
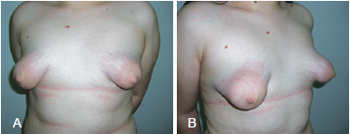
Figura 1 - Em A e B, aspecto tuberoso da mama, com hipoplasia de parênquima mamário e herniação através do complexo areolopapilar alargado, respectivamente, em vistas frontal e de perfil.
Além disso, a assimetria das mamas é muito comum, com prevalência de até 89% nos casos de mamas tuberosas, que, portanto, devem ser avaliadas cuidadosamente para otimizar o resultado cirúrgico, visto que representa um grande desafio técnico. Alguns autores afirmam que há deficiência de pele na parte inferior da mama, com o sulco inframamário sendo maior que o normal e em posição mais alta, representando outra dificuldade técnica na abordagem cirúrgica das mamas tuberosas.
As mamas tuberosas podem ser classificadas de acordo com a gravidade da malformação, que norteia a escolha do tratamento. Há duas classificações principais: a de Grolleau et al.2 e a de von Heimburg et al3.
A classificação de Grolleau et al.2 descreve três tipos de deformidade da mama tuberosa:
tipo I - caracteriza-se por hipoplasia do quadrante inferior medial, constituindo o tipo mais comum, presente em 54% dos casos; tipo II - ambos os quadrantes inferiores são hipoplásicos, constituindo 26% dos casos; tipo III - caracteriza-se por constrição grave, com base mínima de mama e deficiência aparente de todos os quadrantes da mama, constituindo a minoria, presente em 20% dos casos.
A classificação de von Heimburg et al.3, por sua vez, subdivide o tipo II de Grolleau et al.2, sendo o tipo II com pele subareolar normal e o tipo III, com deficiência de pele subareolar associada a hipoplasia parenquimatosa nos quadrantes inferiores medial e lateral. O tipo I na classificação de von Heimburg et al.3 equivale ao tipo I de Grolleau et al.2 e o tipo IV ao tipo III, respectivamente.
Posteriormente, preconizou-se uma definição objetiva de mama tuberosa, com utilização do índice de Northwood. Esse índice baseia-se, exclusivamente, na herniação do parênquima mamário através da aréola, como ponto fundamental no desenvolvimento da mama tuberosa. É calculado pela relação entre a medida da protrusão parenquimatosa pela aréola (distância da ponta da papila à base da aréola, em centímetros) e o diâmetro areolar (cm). O índice superior a 0,4 define uma mama tuberosa, que pode ser classificada, em relação à gravidade, em leve (0,4 a 0,5), moderada (0,51 a 0,6) ou grave (0,61 a 0,7). A vantagem dessa classificação em relação às mencionadas anteriormente é a objetividade na definição e na graduação de mama tuberosa4.
Neste estudo, os autores apresentam sua experiência com correção cirúrgica da hipoplasia glandular, com aumento do volume mamário e correção da forma da mama e do tamanho e projeção do complexo areolopapilar, realizado em um único procedimento.
Histórico
Várias técnicas operatórias têm sido sugeridas para corrigir as deformidades de mamas tuberosas.
Em 1976, a abordagem cirúrgica de mamas tuberosas iniciou-se com Rees e Aston1, por meio de técnica que emprega incisões radiadas no parênquima mamário para liberação do anel fibroso e correção da forma e disposição da mama, através de um acesso pelo sulco inframamário.
Ribeiro et al.5-7 descreveram técnica que utiliza abordagem periareolar exclusiva, com incisão horizontal no parênquima, e confecção de pedículo de base inferior, com ressecção dos prolongamentos medial e lateral e fixação do mesmo na parede torácica, dobrado sobre si mesmo. Essa técnica possibilita a correção da conformação das mamas, com preenchimento dos quadrantes inferiores hipoplásicos.
Mandrekas et al.8, desde 2003, preconizaram uma abordagem semelhante, porém com incisão vertical no parênquima, em posição equivalente a 6 horas, e separação deste em 2 pilares inferiores. Desde 1983, o uso de incisões combinadas periareolar e inframamária associadas à inclusão de implantes mamários foi descrito por Teimourian e Adham9. A maioria das pacientes com mama tuberosa deseja aumento de volume mamário e melhoria da forma, ambos proporcionados por tal técnica cirúrgica.
Os autores deste trabalho apresentam a tática empregada para tratamento de mama tuberosa com o emprego de incisões combinadas: inframamária, para posicionamento de implante mamário de silicone e periareolar, ajuste do tamanho da aréola e melhor tratamento do anel fibroso. A justificativa dessa abordagem como conduta consiste no melhor controle da hemostasia, no menor trauma tecidual e na maior facilidade técnica, pelo amplo acesso às traves fibrosas10.
MÉTODO
No período de janeiro de 2010 a janeiro de 2011, foram avaliadas 4 pacientes portadoras de mamas tuberosas na Disciplina de Cirurgia Plástica da Universidade Federal do Triângulo Mineiro. Todas as pacientes foram submetidas a tratamento cirúrgico em um único tempo, com incisões combinadas.
A marcação das referências cirúrgicas foi feita no pré-operatório, com a paciente em posição ortostática ou sentada (Figura 2). A linha média foi marcada e o tamanho desejado do novo complexo areolopapilar estabelecido, com diâmetro médio de 4 cm. Os limites de dissecção para a loja do implante foram planejados conforme a projeção do parênquima mamário, sendo decididas a posição ideal do novo complexo areolopapilar em relação ao manúbrio esternal e sua distância da linha média. O limite lateral foi coincidente com a linha axilar anterior. O limite medial geralmente foi posicionado 2 cm a 3 cm lateralmente à linha medioesternal. O limite superior ficou localizado aproximadamente 4 cm a 5 cm abaixo da clavícula. Por sua vez, o limite inferior foi definido pela posição do neossulco mamário, a uma distância média de 4 cm a 5 cm abaixo da aréola, onde foi realizada uma incisão transversal com 5 cm de extensão. As posições dos sulcos inframamários foram determinadas para corresponder ao lado normal contralateral ou à posição que a paciente usaria seu sutiã, tendo como parâmetro a distância do mamilo, ou seja, em torno de 7 cm abaixo da papila, se ambos os lados são anormais.
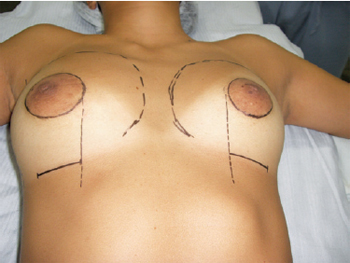
Figura 2 - Planejamento operatório: demarcação cirúrgica pré-operatória, ressaltando incisões combinadas inframamária e periareolar.
Primeiramente, foi realizada incisão inframamária, com descolamento no plano retroglandular subfascial, para inclusão de implantes de silicone. Em seguida, foi realizada a incisão periareolar, com uso de areolótomo médio de 4 cm de diâmetro e incisão no limite externo da aréola, com desepidermização entre essas incisões areolares, procedimento descrito tipo donut (semelhante à manobra de Schwartzman), para adequação dos diâmetros das aréolas (Figura 3). Posteriormente, foi realizada uma incisão semilunar inferior, com concavidade voltada para cima no parênquima mamário, com clara evidência da herniação de tecidos, seguida por excisão das traves do anel fibroso por quatro incisões radiadas nos quadrantes medial (posição equivalente a 9 horas), lateral (posição equivalente a 3 horas), superior (posição equivalente a 0 hora) e inferior (posição equivalente a 6 horas) (Figuras 4 e 5). Com essa técnica, há comunicação do acesso periareolar com o espaço retroglandular, permitindo ampla exposição do campo cirúrgico e facilidade de controle da hemostasia.
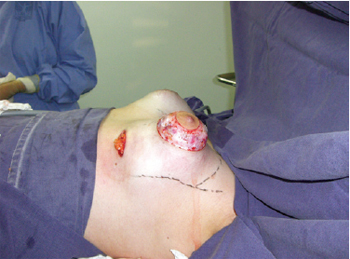
Figura 3 - Incisão em sulco mamário com descolamento subfascial, incisão periareolar com delimitação da neoaréola e desepidermização do excedente areolar. Observa-se evidente herniação do anel fibroso.
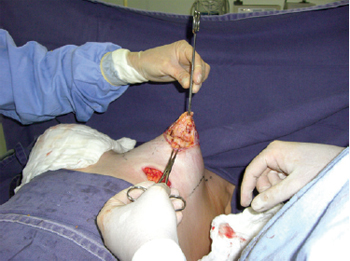
Figura 4 - Incisão semilunar com concavidade voltada para cima no parênquima mamário, comunicação com o espaço subfascial e incisões nos 4 quadrantes para quebra do anel fibroso.
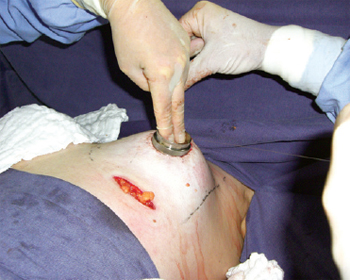
Figura 5 - Marcação da neoaréola com areolótomo médio de 4 cm de diâmetro e mamas com parênquima distribuído.
Foram incluídos implantes de gel de silicone coesivo, através do acesso inframamário, com superfície texturizada, bases redondas e de perfil alto ou extra-alto, com volumes variados e específicos para cada paciente, objetivando equilíbrio e simetrização mamária, variando de 200 cc a 265 cc (Figura 6).
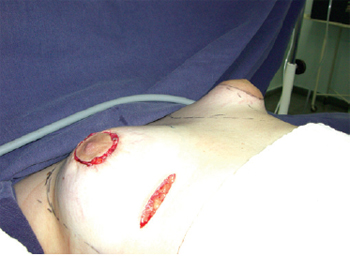
Figura 6 - Avaliação comparativa da conformação das mamas.
A síntese da incisão inframamária foi feita em três planos: subcutâneo, com náilon 4-0 incolor; subdérmico, com monocryl 4-0 e com pontos intradérmicos com náilon 3-0; e da periareolar, sutura em bolsa, round-block, em 2 planos, com náilon 4-0 incolor, para ajuste da pele sobre a aréola, complementados com pontos de Benelli com náilon 5-0, com o objetivo de atenuar o alargamento da cicatriz do complexo areolopapilar11,12 (Figura 7).
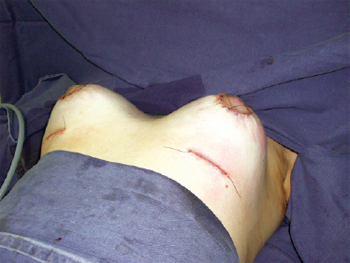
Figura 7 - Aspecto pós-operatório imediato, denotando incisões combinadas e posicionamento de implantes mamários retroglandulares.
Para finalização, foi realizado curativo oclusivo não-compressivo. Foi empregado sutiã de compressão elástica apropriado desde o pós-operatório imediato, que foi mantido por 60 dias. A primeira troca de curativo foi realizada após 48 horas. A prática de exercícios físicos só foi liberada após 45 dias.
Detalhes técnicos devem ser individualizados para cada caso, objetivando otimização do resultado cirúrgico. Em pacientes portadoras de aréolas de tamanhos normais, optamos por incisão hemiareolar inferior tipo Webster, similar à preconizada para correção cirúrgica de ginecomastia, ao invés da periareolar. Por outro lado, diante da presença de flacidez cutânea com ptose mamária associada, a preferência é para mastopexia com cicatriz em T invertido (Figura 8), possibilitando ressecção do excedente de pele, melhor posicionamento do complexo areolopapilar e melhor conformação das mamas.
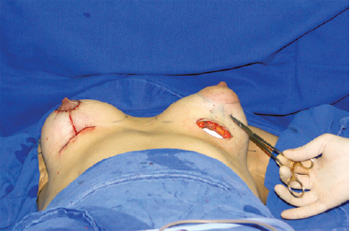
Figura 8 - Imagem intraoperatória para destacar incisão em T invertido para ressecção de excesso de pele em casos de ptose mamária associada.
RESULTADOS
A primeira paciente, de 32 anos de idade, possuía mamas tuberosas bilaterais assimétricas, grau I de Grolleau, à esquerda, e grau II, à direita. Foram incluídos implantes mamários com volumes de 215 cc, à esquerda, e 235 cc, à direita (Figura 9).
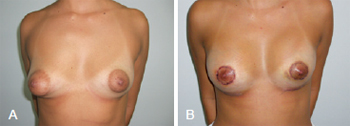
Figura 9 - Em A, aspecto pré-operatório de paciente portadora de mamas tuberosas bilaterais assimétricas, grau I de Grolleau, à esquerda, e grau II, à direita. Em B, aspecto pós-operatório após inclusão de implantes mamários com volumes de 215 cc, à esquerda, e 235 cc, à direita. Pós-operatório recente de 7 dias.
A segunda paciente, por sua vez, apresentava uma particularidade clínica: era portadora de síndrome de Turner, com mamas tuberosas bilaterais, grau III de Grolleau, e discreta assimetria. Essa paciente tinha 23 anos de idade, e foi submetida a inclusão de implantes de silicone de 200 cc, bilateralmente (Figura 10).
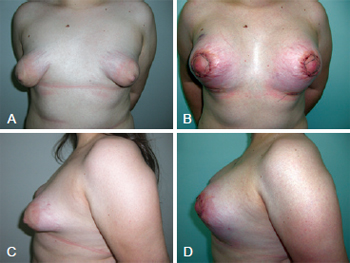
Figura 10 - Em A e C, aspecto pré-operatório de paciente portadora de síndrome de Turner, com mamas tuberosas bilaterais, grau III de Grolleau, e discreta assimetria. Em B e D, aspecto pós-operatório recente de 4 dias, após inclusão de implantes de silicone de 200 cc, bilateralmente.
No terceiro caso, a paciente tinha 25 anos de idade e mamas tuberosas simétricas bilaterais, grau II de Grolleau, com aréolas de tamanhos normais. Nessa paciente, foi realizada incisão hemiareolar inferior de Webster, com inclusão de implantes de 235 cc, bilateralmente (Figura 11).
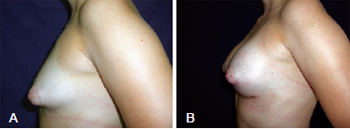
Figura 11 - Em A, aspecto pré-operatório de paciente portadora de mamas tuberosas bilaterais simétricas, grau II de Grolleau, com aréolas de tamanhos normais. Em B, aspecto em pós-operatório tardio de 90 dias. Realizada incisão hemiareolar inferior de Webster, com inclusão de implantes de 235 cc, bilateralmente.
A quarta paciente, de 39 anos de idade, apresentava mamas tuberosas assimétricas, com flacidez cutânea, estrias e ptose mamária leve, à esquerda, e moderada, à direita. A correção da assimetria ocorreu à custa de diferentes ressecções de pele por graus diferentes de ptose entre as duas mamas, permitindo a inclusão de implantes de volumes iguais de 265 cc, bilateralmente (Figura 12).
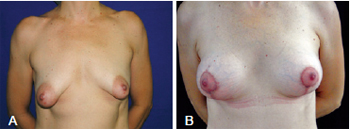
Figura 12 - Em A, aspecto pré-operatório de paciente portadora de mamas tuberosas assimétricas com flacidez cutânea, com estrias e ptose mamária leve, à esquerda, e moderada, à direita. Em B, aspecto pós-operatório de 14 dias. A correção da assimetria resultou de diferentes ressecções de pele por graus diferentes de ptose entre as duas mamas, permitindo a inclusão de implantes de volumes iguais de 265 cc, bilateralmente.
No presente estudo, 4 pacientes foram submetidas a procedimento cirúrgico que aborda todos os aspectos da deformidade em uma operação de um estágio. Reabordagem cirúrgica para refinamento ou revisão de cicatriz não foi necessária em nenhum caso.
Em todos os casos, resultado estético final aceitável foi atingido, com satisfação tanto da paciente como da equipe cirúrgica. O grau de satisfação foi avaliado de forma subjetiva.
Houve um caso de alargamento tardio do complexo areolopapilar, sem queixa da paciente, mas observado pelo cirurgião.
A técnica não apresenta repercussão funcional nas mamas, e tampouco interfere em lactações futuras. Não foram utilizados drenos em nenhum caso. Não foram observadas complicações como seroma ou hematoma.
Os resultados favoráveis baseiam-se nos seguintes aspectos: normalização do tamanho da aréola, naturalização do contorno e conformação das mamas, aquisição de boa simetria mamária e ausência de deformidade tuberosa residual.
DISCUSSÃO
As mamas tuberosas decorrem da alteração da fáscia superficial, com restrição do crescimento mamário radial e protrusão do tecido pelo segmento areolar, bem como alargamento da aréola.
Várias técnicas operatórias têm sido descritas nos últimos 30 anos. Dinner e Dowden13 utilizavam uma incisão na pele, com extensão para o subcutâneo e tecido mamário, desfazendo as traves, adicionada a um retalho de tecido subcutâneo. Outros autores tentaram rearranjar o polo inferior mamário com incisões horizontais no parênquima, com resultados estéticos insatisfatórios. Em nosso meio, Ribeiro et al.5 descreveram uma técnica na qual o anel fibrótico é incisado horizontalmente, com rotação de um retalho inferior para preenchimento de polo mamário. Mandrekas et al.8, por sua vez, propuseram a realização de apenas uma incisão periareolar, por onde são realizadas a transecção vertical do anel fibroso, em posição equivalente a 6 horas, e a criação de dois pilares inferiores, com a posterior remontagem da mama.
Pacifico e Kang4 descreveram uma abordagem cirúrgica alternativa, que associa redução da aréola e colocação de implantes de silicone subglandulares. Defendem que a deformidade tuberosa da mama é decorrente, exclusivamente, de anormalidade areolar, e não da presença de uma banda constritiva.
Coleman e Saboeiro14 relataram os benefícios da injeção de gordura autóloga nos tecidos subcutâneos da mama e músculos peitorais. Bons resultados também foram alcançados, em 1983, com Teimourian e Adham9, com a técnica de duas incisões (areolar e submamária) com o uso de próteses.
Acredita-se, geralmente, que a correção da deformidade da mama tuberosa requer atenção a vários pontos importantes. A abordagem que é defendida pela maioria dos autores é delinear um padrão circum-areolar em torno do perímetro do desejado complexo areolopapilar15. Um padrão de mastopexia tipo donut é descrito. Após a excisão de pele, a circunferência dos tecidos circundantes é incisada. Uma prótese de silicone é normalmente inserida no plano pré-peitoral e coberta totalmente por tecido parenquimatoso. Alguns autores preferem o implante da prótese submuscular, pela redução do risco de contratura capsular e fornecimento de melhor cobertura de tecidos moles das próteses.
É válido ressaltar que a opção de incisão periareolar exclusiva é viável pelo benefício de minimizar incisões, porém acarreta necessidade de reabordagem cirúrgica em até 53% dos casos, para correção de cicatriz periareolar alargada16. Portanto, o tratamento com incisões combinadas é uma tática empregada pelos autores, pelas vantagens da incisão inframamária associada, como maior facilidade técnica para confecção da loja retroglandular e para inclusão do implante mamário, menor trauma tecidual, melhor exposição do campo cirúrgico e melhor controle de hemostasia. Adicionalmente, a incisão é pouco aparente, o que facilita a definição da posição do novo sulco mamário.
CONCLUSÕES
A mama tuberosa representa um verdadeiro desafio terapêutico em pacientes física e psicologicamente comprometidas. Os sintomas no início da puberdade atrapalham a imagem corporal. Uma única técnica cirúrgica é capaz de corrigir qualquer grau de deformidade tuberosa da mama17. É certo que o tratamento dessa deformidade continuará a ser uma fonte de contínua controvérsia, mas esperamos que este trabalho seja útil para o máximo benefício das pacientes. O procedimento descrito é realizado em um único estágio, capaz de tratar todos os tipos de mama tuberosa, independentemente da gravidade, e de alcançar os mesmos resultados cirúrgicos. A técnica utilizada é atraente e mostra-se confiável e reprodutível, alcançando resultados estéticos considerados satisfatórios pelas pacientes e cirurgiões.
REFERÊNCIAS
1. Rees TD, Aston SJ. The tuberous breast. Clin Plast Surg. 1976;3(2):339-47.
2. Grolleau JL, Lanfrey E, Lavigne B, Chavoin JP, Costagliola M. Breast base anomalies: treatment strategy for tuberous breasts, minor deformities, and asymmetry. Plast Reconstr Surg. 1999;104(7):2040-8.
3. von Heimburg D, Exner K, Kruft S, Lemperle G. The tuberous breast deformity: classification and treatment. Br J Plast Surg. 1996;49(6):339-45.
4. Pacifico MD, Kang VN. The tuberous breast revisited. J Plast Reconstr Aesthet Surg. 2007;60(5):455-64.
5. Ribeiro L, Canzi W, Buss A Jr, Accorsi A Jr. Tuberous breast: a new approach. Plast Reconstr Surg. 1998;101(1):42-50.
6. Ribeiro L, Accorsi A Jr, Buss A, Pessĵa MC. Short scar correction of the tuberous breast. Clin Plast Surg. 2002;29(3):423-31.
7. Ribeiro L, Accorsi A Jr, Buss A, Marcal-Pessoa M. Creation and evolution of 30 years of the inferior pedicle in reduction mammaplasties. Plast Reconstr Surg. 2002;110(3):960-70.
8. Mandrekas AD, Zambacos GJ, Anastasopoulos A, Hapsas D, Lambrinaki N, Ioannidou-Mouzaka L. Aesthetic reconstruction of the tuberous breast deformity. Plast Reconstr Surg. 2003;112(4):1099-108.
9. Teimourian B, Adham MN. Surgical correction of the tuberous breast. Ann Plast Surg. 1983;10(3):190-3.
10. Sabino Neto M, Silva AL, Garcia EB, Freire M, Ferreira L. Quality of life and self-esteem after breast asymmetry surgery. Aesthet Surg J. 2007;27(6):616-21.
11. Peled IJ, Zagher U, Wexler MR. Purse-string suture to reduction and closure of skin defects. Ann Plast Surg. 1985;14(5):465-9.
12. Benelli L. Technique personnelle de plastie mammaire péri-aréolaire: le 'round-block'. Cah Chir. 1991;77(1):15-25.
13. Dinner MI, Dowden RV. The tubular / tuberous breast syndrome. Ann Plast Surg. 1987;19(5):414-20.
14. Coleman SR, Saboeiro AP. Fat grafting to the breast revisited: safety and efficacy. Plast Reconstr Surg. 2007;119(3):775-87.
15. DeLuca-Pytell DM, Piazza RC, Holding JC, Snyder N, Hunsicker LM, Phillips LG. The incidence of tuberous breast deformity in asymmetric and symmetric mammaplasty patients. Plast Reconstr Surg. 2005;116(7):1894-9.
16. Argenta LC, VanderKolk C, Friedman RJ, Marks M. Refinements in reconstruction of congenital breast deformities. Plast Reconstr Surg. 1985;76(1):73-82.
17. Reynaud JP, Gary-Bobo A, Baron JL, Bousquet P, Dessus B. Tuberous breast: clinical and therapeutic considerations. Report of 20 cases. Ann Chir Plast Esthet. 1990;35(6):453-8.
1. Membro titular da Sociedade Brasileira de Cirurgia Plástica (SBCP), orientador do Serviço de Cirurgia Plástica da Universidade Federal do Triângulo Mineiro (UFTM), Uberaba, MG, Brasil.
2. Médico residente do Serviço de Cirurgia Plástica da UFTM, membro associado da SBCP, Uberaba, MG, Brasil.
3. Médico residente do Serviço de Cirurgia Plástica da UFTM, Uberaba, MG, Brasil.
4. Membro associado da SBCP, Uberaba, MG, Brasil.
Correspondência para:
Manoel Pereira Silva Neto
Rua Dona Rafa Cecílio, 445 - Vila Maria Helena
Uberaba, MG, Brasil - CEP 38020-080
E-mail: drmanoel@drmanoel.com.br
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 15/6/2012
Artigo aceito: 7/8/2012
Trabalho realizado na Universidade Federal do Triângulo Mineiro, Uberaba, MG, Brasil.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter