ISSN Online: 2177-1235 | ISSN Print: 1983-5175
Histopathological evaluation of polymethylmethacrylate in rats for one year
Avaliação histopatológica do polimetilmetacrilato em ratos ao longo de um ano
Original Article -
Year2011 -
Volume26 -
Issue
2
Décio Luís Portella de Campos1; Ricardo Sestito Proto2; Daniel Carmona dos Santos3; Rogerio de Oliveira Ruiz4; Nelson Brancaccio5; Hamilton Aleardo Gonella6
ABSTRACT
Introduction: PMMA is used as a permanent filler in the form of microspheres. There are several commercial applications; many of them are used indiscriminately. Objective: Histological evaluation (of the applied place and organs) after PMMA filling in rats. Methods: 60 Wistar rats were used; each received an application of 1 ml of PMMA (Meta-Crill®) in deep frame (near the occipital region). The euthanasia occurred in groups of 15 rats at 1, 3, 6 and 12 months after application. Results: Presence of inflammatory infiltrate and fibrosis in the injected site, in addition to the reduced amount of PMMA in all samples. Foreign body reaction (FBR) granuloma type occurred in 3.3% of samples (2 mice). Statistical analysis was shown significant by Kruskal-Wallis. Conclusion: The PMMA used had a higher FBR and evident fibrosis in late samples, occurring FBR granuloma type. Although the PMMA seems safe, several complications can occur. Its use should be judicious, knowing that granulomas occur regardless of the technique.
Keywords:
Polymethyl methacrylate, Microspheres. Rats. Histology. Fibrosis. Foreign-Body Reaction.
RESUMO
Introdução: O PMMA é utilizado como preenchedor permanente na forma de microesferas. Existem diversas apresentações comerciais, muitas são utilizadas indiscriminadamente. Objetivo: Avaliação histológica (do local aplicado e órgãos) após preenchimento com PMMA em ratos. Método: Utilizaram-se 60 ratos Wistar, todos receberam aplicação de 1 ml de PMMA (Meta-Crill®) em plano profundo, próximo à região occipital. A eutanásia ocorreu em grupos de 15 ratos no 1º, 3º, 6º e 12º mês após aplicação. Resultados: Identificada presença de infiltrado inflamatório e fibrose no local injetado, além da diminuição da quantidade de PMMA em todas as amostras. Reação de corpo estranho (RCE) tipo granuloma ocorreu em 3,3% das amostras (2 ratos). A análise estatística mostrou-se significante pelo teste de Kruskal-Wallis. Conclusão: O PMMA utilizado apresentou maior RCE e evidente fibrose em amostras tardias, podendo ocorrer RCE tipo granuloma. Embora o PMMA pareça seguro, diversas complicações podem ocorrer. Sua utilização deve ser criteriosa, sabendo que granulomas ocorrem independente da técnica.
Palavras-chave:
Polimetil metacrilato. Microesferas. Ratos. Histologia. Fibrose. Reação a Corpo Estranho.
INTRODUÇÃO
Recentemente, substâncias preenchedoras com fluidos de alta viscosidade ou partículas de polímeros em suspensão têm sido utilizadas em larga escala em procedimentos cosméticos e correção de lipodistrofia de pacientes HIV positivos1.
A substância ideal deve ser segura, biocompativel, estável após implantação, não migratória, resistente a fagocitose, persistir e manter seu volume sem ser reabsorvida ou degradada; induzir mínima reação de corpo estranho; ser não teratogênica, não carcinogênica e não requerer testes alergênicos prévios ao seu uso2,3.
O polimetilmetacrilato (PMMA) é um polímero utilizado como preenchedor na forma de microesferas sintéticas de 40 a 60 µm, veiculadas em meio de suspensão, que pode ser colágeno aproteico ou cristaloide. Foi sintetizado em 1902 e tem sido usado como cimento ósseo no corpo humano. Sua excelente biocompatibilidade e não toxicidade vem sendo demonstradas em vários estudos desde 19304. Conforme o veículo utilizado, existem diversas apresentações comerciais. Vários preceitos são necessários para a indicação e a aplicação adequada dessa substância; além disso as complicações granulomatosas podem ocorrer independente da técnica utilizada5,6.
O uso de preenchimentos permanentes implica na responsabilidade médica de injeções precisas. O planejamento cuidadoso das profundidades de injeção e áreas de melhor eficácia é imperativo, assim como o domínio de eventuais complicações que podem ocorrer3,5.
Infelizmente, o PMMA está sendo utilizado de modo indiscriminado em função de seu baixo custo. Sua venda não é restrita, de modo que profissionais não médicos ou mesmo médicos sem especialização adequada fazem aplicações da substância5,6.
O objetivo deste estudo é avaliar histologicamente os efeitos locais da injeção de PMMA em ratos, bem como verificar a presença, durante o período de um ano, do material no local injetado e possíveis alterações histológicas em órgãos à distância.
MÉTODO
Este trabalho seguiu as normas para uso de animais de laboratório em experimentação, sendo conduzido de forma isenta de conflitos.
Utilizaram-se 60 ratos Wistar, idades entre 60 e 440 dias, pesos entre 240g e 350g. Os procedimentos foram realizados sob anestesia intramuscular, na coxa direita, com quetamina e xilazina. Após antissepsia com clorexidina alcoólica 0,5%, realizou-se o preenchimento em plano profundo do dorso, próximo à região occipital (Figura 1), com 1 ml de polimetilmetacrilato (PMMA) - Meta-Crill® (gel a 30%)7. Os animais foram acompanhados e não apresentaram sinais flogísticos ou infecciosos no local da aplicação.
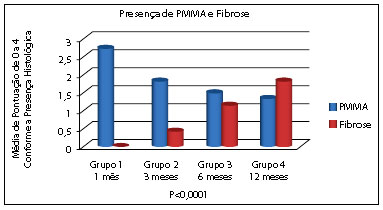
Figura 1 - Presença de PMMA e fibrose.
A eutanasia foi realizada em grupos de 15 ratos no 1º mês (grupo 1), 3º mês (grupo 2), 6º mês (grupo 3) e 12º mês (grupo 4) após aplicação. Ressecou-se o segmento de pele/ subcutâneo até o plano muscular do local da aplicação e outros órgãos (cérebro, fígado, baço, rins, pulmões e coração) (Figura 2).
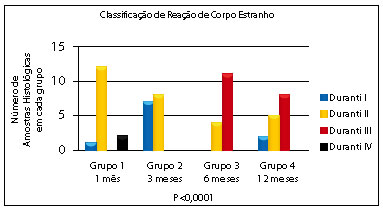
Figura 2 - Classificação da reação de corpo estranho nos diferentes grupos.
Os materiais ressecados foram mantidos em formol e enviados para estudo anatomopatológico, cortados com 5 µm de espessura e montados em lâminas. A análise foi realizada através da microscopia de luz, com microscópio Nikon® Eclipse 200. Todas as lâminas foram avaliadas por um mesmo patologista, que recebeu as amostras apenas numeradas.
Avaliou-se a quantidade de células inflamatórias, neoformação vascular, fibrose e PMMA nos fragmentos, com pontuação de 0 (nenhuma representação), 1 (até 25% do aspecto avaliado), 2 (25 a 50%), 3 (50 a 75%) e 4 (> 75%). Para avaliar a reação de corpo estranho (RCE) gerada pelo PMMA, utilizou-se a classificação para RCE de Duranti et al.8 (Quadro 1).
As pontuações de PMMA e fibrose observadas nos quatro grupos foram comparadas utilizando-se o teste de Kruskal-Wallis, seguido do teste de comparações múltiplas de Dunn. Os dados de classificação de Duranti foram analisados por meio de uma tabela de contingência para verificar a associação entre os grupos e a classificação. A associação foi obtida através do teste exato de Fisher. Em todos os testes foi utilizado o nível de significância de 5%. Todas as análises foram feitas utilizandose os programas GraphPad v.4.0 e SAS for Windows v.9.2.
RESULTADOS
Observou-se a presença de infiltrado inflamatório no local de implantação do PMMA nas amostras histológicas com 1 e 3 meses (grupos 1 e 2, respectivamente), porém estes achados não se mantiveram constantes e diferiram das amostras com 6 e 12 meses (grupos 3 e 4). Nenhum dos órgãos distantes avaliados apresentou alterações histológicas.
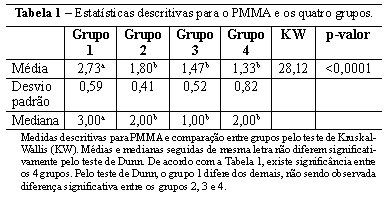
A quantidade de PMMA no local injetado apresentou-se em menor quantidade nas amostras com 6 e 12 meses (grupos 3 e 4) comparado às amostras iniciais (grupos 1 e 2), resultado estatisticamente significante pelo teste de Kruskal-Wallis. Na amostra com 1 mês (grupo 1), a presença de PMMA foi relativamente maior que nas demais amostras, mantendo-se homogênea nos demais grupos (avaliado pelo teste de Dunn). Dessa forma, fica evidente a diminuição do PMMA no local injetado conforme o tempo de evolução, sendo maior apenas com 1 mês após a aplicação (Tabela 1 e Figura 1).
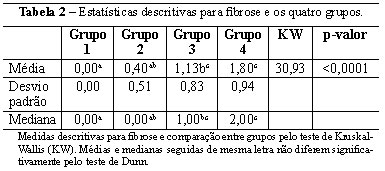
Analisando-se da mesma forma a fibrose, existe significância entre o grupo 1 (1 mês) com grupo 3 e 4 (6 e 12 meses) e grupo 2 (3 meses) com grupo 3 e 4 (6 e 12 meses). Assim sendo, a presença de fibrose aparece aumentada nas amostras mais tardias (6 e 12 meses), sendo que no grupo 1 foi nula (Figura 1 e Tabela 2), condizendo com apenas a presença de infiltrado inflamatório local. As demais comparações foram não significativas.
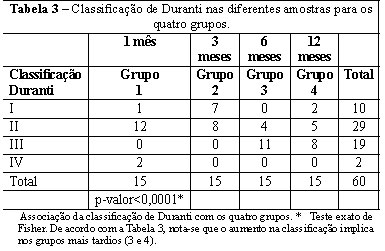
A classificação de Duranti foi associada aos grupos (Tabela 3 e Figura 2); sendo estatisticamente significante e evidenciando que a RCE grau II e III apresenta-se maior nas amostras com 6 e 12 meses (grupos 3 e 4). Sendo assim, fica claro o aumento da reação inflamatória e fibrose com o passar do tempo. Entre as amostras do grupo 1, dois ratos apresentaram a formação de granuloma evidente com material encapsulado (Duranti IV).
As Figuras 3 a 8 ilustram alguns aspectos histopatológicos dessa casuística.
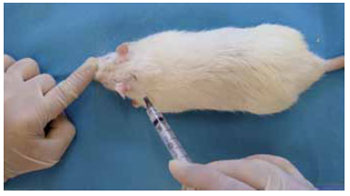
Figura 3 - Preenchimento em plano profundo próximo à região occipital, com 1 ml de PMMA.
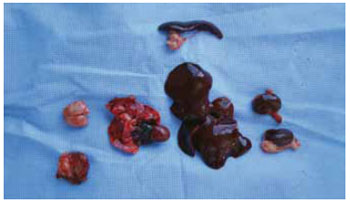
Figura 4 - Pele e subcutâneo até o plano muscular (no canto inferior esquerdo) e demais órgãos.
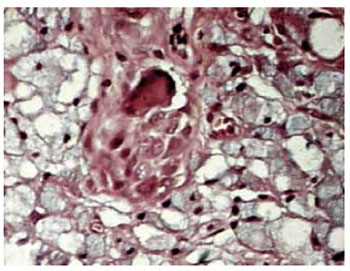
Figura 5 - Aumento de 200x presença de células gigantes.
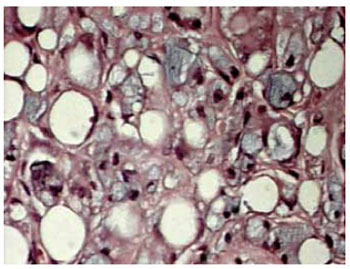
Figura 6 - Aumento de 100x - presença evidente de infiltrado inflamatório.
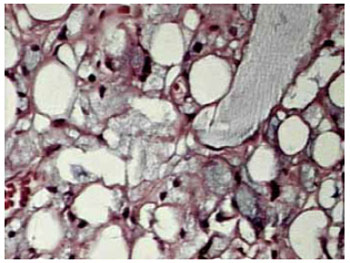
Figura 7 - Aumento de 100x - PMMA em coloração cinza (maior no canto superior direito) e infiltrado inflamatório crônico.
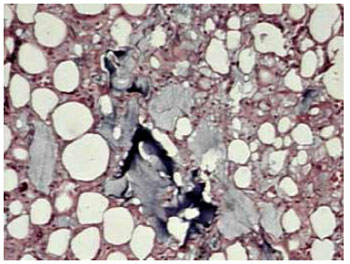
Figura 8 - Aumento de 100x - PMMA (ao centro/em cinza) com calcificações e fibrose.
DISCUSSÃO
Reações ao PMMA são divididas em: de curto, intermediário e longo prazo. O evento final da RCE é a fibrose e, quanto mais irritante o agente, mais pronunciada ela é4,6,9.
O PMMA aparenta ser mais estável que outras substâncias. Quando injetado, não é lisado por enzimas porque o grupo metil o estabiliza e quando aplicado em planos superficiais, torna-se desastroso2,4,10. Inicialmente, os artigos sugeriam uma evolução favorável, enquanto publicações posteriores descreveram complicações6 que, mesmo sendo raras, podem apresentar-se graves.
Quanto à histologia, ocorre a chegada de macrófagos resultando em cascata de citocinas5,11,12. A biocompatibilidade varia conforme o tamanho, forma e superfície: partículas irregulares ocasionam maior resposta inflamatória; vários tamanhos induzem intensa RCE3,5,11-14.
Considerando-se os diferentes fabricantes, a formação de granulomas varia entre 2,5 e 0,01% das aplicações6. Clinicamente, todos os fluidos injetáveis podem causar RCE e, até que a imunologia seja compreendida, é impossível prever seu desenvolvimento tardio1,3,9,12,14. Em nossas amostras, tivemos dois (3,3%) ratos com RCE evidente e encapsulamento do PMMA, demonstrando que esta complicação pode ocorrer em casos recentes (1 mês).
Avaliações da pele humana3,14 demonstraram o encapsulamento da microesfera com camada de colágeno, macrófagos e fibroblastos após um mês. Entre o 3º e o 6º mês, há presença de macrófagos e células gigantes. No 9º mês, o PMMA apresenta tamanho intacto, sugerindo a não fagocitose ou migração das microesferas: contradizendo este estudo que encontrou menor quantidade de PMMA a partir do 3º mês, porém em ratos.
Embora o PMMA aparente ser seguro, ele exibe complicações diversas em função da imunologia do hospedeiro reagir de diferentes formas9. Alguns estudos sugerem4 que infecção crônica seja a causa do desenvolvimento de nódulos inflamatórios. Microorganismos são encontrados em camadas profundas da pele, além da flora normal, pela contaminação de procedimentos.
Neste estudo, a não utilização de microscopia eletrônica impediu a avaliação de possíveis micropartículas de PMMA em órgãos distantes. Segundo Lemperle et al.2, partículas de 4,3 µm e de 20 µm foram encontradas nos pulmões de rato após 6 meses. Mas, acima de 40 µm não houve disseminação para órgãos distantes.
Portanto, o uso de PMMA implica na responsabilidade médica, indicação precisa e aplicação adequada, sabendo-se que complicações granulomatosas ocorrem independente da técnica3,5,6,10.
CONCLUSÃO
O presente estudo apresentou maior reação de corpo estranho e evidente fibrose em amostras tardias com 6 e 12 meses após sua aplicação. Também, verificou-se a presença diminuída de PMMA em todas as amostras avaliadas (diminuição sequencial do 1º ao 12º mês). Não se observou a presença de PMMA nos órgãos à distância.
REFERÊNCIAS
1. Lemperle G, Morhenn V, Charrier U. Human histology and persistence of various injectable filler substances for soft tissue augmentation. Aesthetic Plast Surg. 2003;27(5):354-66.
2. Lemperle G, Morhenn VB, Pestonjamasp V, Gallo RL. Migration studies and histology of injectable microspheres of different sizes in mice. Plast Reconstr Surg. 2004;113(5):1380-90.
3. Graivier M, Cohen SR. The semipermanent and permanent dermal/subdermal fillers supplement. Plast Reconstr Surg. 2006;118(Suppl):6S.
4. Christensen L, Breiting V, Janssen M, Vuust J, Hogdall E. Adverse reactions to injectable soft tissue permanent fillers. Aesthetic Plast Surg. 2005;29(1):34-48.
5. Vargas AF, Amorim NG, Pintanguy I. Complicações tardias dos preenchimentos permanentes. Rev Bras Cir Plást. 2009;24(1):71-81.
6. Salles AG, Lotierzo PH, Gemperli R, Besteiro JM, Ishida LC, Gimenez RP, et al. Complications after polymethylmethacrylate injections: report of 32 cases. Plast Reconstr Surg. 2008;121(5):1811-20.
7. Nutricel Laboratórios. Disponível em: http://www.metacrill.com.br 8. Duranti F, Salti G, Bovani B, Calandra M, Rosati ML. Injectable hyaluronic acid gel for soft tissue augmentation. A clinical and histological study. Dermatol Surg. 1998;24(12):1317-25.
9. Lemperle G, Rullan PP, Gauthier-Hazan N. Avoiding and treating dermal filler complications. Plast Reconstr Surg. 2006;118(3 Suppl):92S-107S.
10. Requena C, Izquierdo MJ, Navarro M, Martínez A, Vilata JJ, Botella R, et al. Adverse reactions to injectable aesthetic microimplants. Am J Dermatopathol. 2001;23(3):197-202.
11. Tomazic-Jezic VJ, Merritt K, Umbreit TH. Significance of the type and the size of biomaterial particles on phagocytosis and tissue distribution. J Biomat Mater Res. 2001;55(4):523-9.
12. Morhenn VB, Lemperle G, Gallo RL. Phagocytosis of different particulate dermal filler substances by human macrophages and skin cells. Dermatol Surg. 2002;28(6):484-90.
13. McClelland M, Egbert B, Hanko V, Berg RA, DeLustro F. Evaluation of artecoll polymethylmethacrylate implant for soft-tissue augmentation: biocompatibility and chemical characterization. Plast Reconstr Surg. 1997;100(6):1466-74.
14. Zimmermann US, Clerici TJ. The histological aspects of fillers complications. Semin Cutan Med Surg. 2004;23(4):241-50.
1. Membro Especialista da Sociedade Brasileira de Cirurgia Plástica (SBCP); Preceptor do Serviço de Cirurgia Plástica Linneu Mattos Silveira da Pontifícia Universidade Católica (PUC) - Sorocaba, Sorocaba, SP, Brasil.
2. Médico Residente de Cirurgia Plástica do Serviço de Cirurgia Plástica Linneu Mattos Silveira da PUC - Sorocaba, Sorocaba, SP, Brasil.
3. Médico Residente do Serviço de Cirurgia Plástica do Hospital Municipal Dr. Mario Gatti, Sorocaba, SP, Brasil.
4. Membro Titular da SBCP, Médico Preceptor do Serviço de Cirurgia Plástica Linneu Mattos Silveira da PUC - Sorocaba, Sorocaba, SP, Brasil.
5. Doutor; Professor da Disciplina de Patologia da PUC - Sorocaba, Sorocaba, SP, Brasil.
6. Doutor; Professor Titular da Disciplina de Cirurgia Plástica da PUC -Sorocaba e Regente do Serviço Linneu Mattos Silveira, Sorocaba, SP, Brasil.
Correspondência para:
Décio Luís Portella de Campos
Rua Profa. Maria de Lourdes Cruz Swenson, 240, apto 32 - Campolim
Sorocaba, SP, Brasil - CEP 18047-204
E-mail: decioportella@yahoo.com.br
Artigo submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 9/1/2011
Artigo aceito: 10/6/2011
Trabalho realizado na Faculdade de Medicina de Sorocaba - Pontifícia Universidade Católica de São Paulo, Sorocaba, SP, Brasil.
Trabalho recebeu prêmio Evaldo D`Assumpção, 2010.
 All scientific articles published at www.rbcp.org.br are licensed under a Creative Commons license
All scientific articles published at www.rbcp.org.br are licensed under a Creative Commons license