

Original Article - Year 2006 - Volume 21 -
Skull reconstruction with undifferentiated mesenchymal stem cells: experimental study
Reconstrução de Calota Craniana com Células-Tronco Mesenquimais Indiferenciadas: Estudo Experimental
ABSTRACT
Introduction: Bone graft employment is frequent in craniomaxillofacial procedures. Nonetheless, such routine is not free of troubles. This way, new techniques have been researched. Stem cells are becoming notorious for its regeneration potentials. For plastic surgery and tissue engineering, they may become an important arsenal for several tissue reconstructions, especially in the case of mesenchymal stem cells (MSC). Purpose: The aim of this study was to compare murine partial cranial vault reconstruction, using grafts that contained undifferentiated MSC or not. Method: There were used adult female isogenetic mice C57Bl/6. Each group was initially composed of 20 animals. A whole thickness failure measuring 5 x 3 mm was performed in the left parietal bone. In group 1 (G1), reconstruction was made with bovine freeze-dried bone (FDB) and MSC. Group 2 (G2) - matrix-control group - received only FDB. For G1, FDB was left inside MSC culture plate for 24 hours before procedure. After four weeks, all the animals were sacrificed in CO2 chambers. For histological evaluation, the following criteria were analyzed: new bone trabecules, osteoblastic activity, graft absorption, and bone matrix viability. Results: Fifteen samples were analyzed in G1 and 19, in G2. Statistical comparison has demonstrated significant differences between G1 and G2 (p=0.002). MSC employment has determined a higher degree in histological scale. Discussion: MSC utilized in FDB grafts seemed to improve integration and regeneration in receptor area. Histological scale has been based on four important criteria, which have demonstrated the presence of regeneration activity after surgery. MSC may have a primary or adjuvant role in tissue regeneration. Such importance remains to be well established. Conclusion: Bone grafts containing undifferentiated MSC have better histological results, when compared to those without cells. MSC employment may represent an improvement in graft quality and optimization of the integration period.
Keywords: Bone transplantation. Stem cells. Freeze-drying
RESUMO
Introdução: A cirurgia craniomaxilofacial utiliza enxertos freqüentemente para a reconstrução de perdas e deformidades esqueléticas. No entanto, essa rotina não é livre de problemas. Assim, técnicas novas vêm sendo estudadas. As células-tronco vêm ganhando notoriedade por sua capacidade potencial de regeneração. Dentro da cirurgia plástica e da engenharia de tecidos, elas poderão representar um arsenal importante para a reconstrução dos mais diversos tecidos, especialmente no caso das células-tronco mesenquimais (CTM). Objetivo: Comparar a reconstrução parcial da calota craniana de camundongos, com enxertos que contivessem ou não CTM indiferenciadas. Método: Foram utilizados camundongos isogênicos C57BL/6, fêmeas, adultas. Cada grupo foi composto inicialmente de 20 animais. Uma falha óssea de espessura total foi criada no osso parietal esquerdo do animal, medindo, aproximadamente, 5 x 3 mm. O grupo 1 (G1) foi reconstruído com osso liofilizado bovino (OL) e CTM; já o grupo 2 (G2) - controle da matriz -, apenas com OL. No caso do G1, o OL era deixado dentro da placa de cultivo por 24 horas antes do procedimento. Após quatro semanas, todos foram sacrificados em câmara de CO2. Para a avaliação histológica, foram utilizados os seguintes critérios histológicos: trabéculas ósseas neoformadas, atividade osteoblástica, absorção do transplante e viabilidade da medula óssea. Resultados: Foram analisadas 15 amostras no G1 e 19, no G2. A comparação estatística demonstrou diferença significativa entre o G1 e o G2 (p=0,002). A utilização de CTM determinou uma pontuação histológica maior nas amostras utilizadas. Discussão: A utilização de CTM indiferenciadas nos enxertos ósseos de OL pareceu melhorar a integração e a regeneração na área receptora. A escala histológica utilizada baseou-se em quatro critérios importantes, que demonstram a presença de uma atividade regenerativa após uma enxertia. As CTM podem ter um papel primário ou adjuvante na regeneração tecidual. Tal papel ainda está por ser determinado. Conclusão: Os enxertos contendo CTM indiferenciadas apresentaram resultados melhores, quando comparados àqueles sem combinação com células, do ponto de vista de regeneração histológica. O emprego de CTM pode significar uma melhoria na qualidade dos enxertos ósseos e uma otimização no tempo para a integração desses enxertos.
Palavras-chave: Transplante ósseo. Células-tronco. Liofilização
A cirurgia craniomaxilofacial utiliza enxertos freqüentemente para a reconstrução de perdas e deformidades esqueléticas. No entanto, essa rotina não é livre de problemas1. As áreas doadoras podem tornar-se escassas; a cicatrização pode ser ineficiente em muitos casos2; alguns pacientes apresentam defeitos congênitos da ossificação; pode haver morbidade considerável na área doadora3.
Assim, técnicas novas vêm sendo estudadas, tanto no sentido de diminuir o tamanho das áreas doadoras, como gerar enxertos com maior potencial de integração e regeneração, diminuindo a necessidade de reintervenções futuras.
A engenharia de tecidos (ET) é uma área biomédica relativamente nova4. Ela visa à reconstrução de tecidos e órgãos autógenos, por meio da expansão e diferenciação de amostras celulares ex vivo5. A manipulação pode ser feita em nível de células, matrizes ou mesmo estímulos biológicos6. Após o cultivo, essas amostras seriam reintroduzidas no organismo do paciente. Por se tratar de material autógeno, a preocupação com a rejeição imunológica a transplantes poderia tornar-se prescindível.
As células-tronco vêm ganhando notoriedade por sua capacidade potencial de regeneração7,8. Dentro da cirurgia plástica e da ET, elas poderão representar um arsenal importante para a reconstrução dos mais diversos tecidos. Especialmente no caso das células-tronco mesenquimais (CTM), podem ser precursoras importantes para o fornecimento das linhagens mesenquimais, como: osso, cartilagem, músculo, gordura e assim por diante9-11. O objetivo deste estudo foi comparar a reconstrução parcial da calota craniana de camundongos, com enxertos que contivessem ou não CTM indiferenciadas.
MÉTODO
Foram utilizados camundongos isogênicos C57BL/6, fêmeas, adultas, com massa entre 50 e 100g. Cada grupo foi composto, inicialmente, de 20 animais. O grupo 1 (G1) foi reconstruído com OL e CTM; já o grupo 2 (G2) - controle da matriz, apenas com OL.
Uma falha óssea de espessura total foi criada no osso parietal esquerdo do animal, medindo, aproximadamente, 5 x 3 mm (Figuras 1 e 2). A reconstrução foi realizada com um bloco de OL, fornecido pelo Banco de Osso do Hospital de Clínicas de Porto Alegre. Esse bloco continha, no G1, CTM indiferenciadas cultivadas em uma concentração de aproximadamente 5 x 105 células/ml (Figura 3). Os cultivos foram preparados e fornecidos pela Equipe do Laboratório de Imunogenética da Universidade Federal do Rio Grande do Sul. No caso do G1, o OL era deixado dentro da placa de cultivo por 24 horas antes do procedimento (Figura 4).
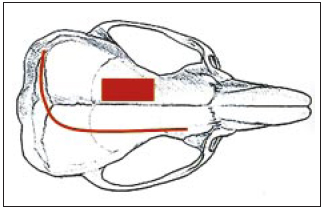
Figura 1 - Esquema gráfico da técnica cirúrgica. A linha arciforme representa a incisão na pele sobre a calota craniana, entre as orelhas, iniciando na região occipital e estendendo-se até a região parietal direita, afastando-se ao máximo da região de craniotomia, impedindo que esta área fique em contato com a ferida operatória após o fechamento do escalpo. A área retangular representa a área de craniotomia parietal esquerda, medindo 3 x 5 mm aproximadamente, realizada com broca de perfuração (6 furos) e osteotomia com tesoura ou mesmo com broca de corte.
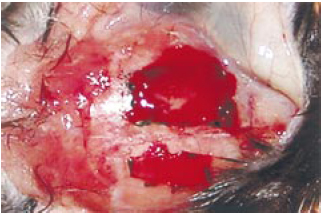
Figura 2 - Imagem da craniotomia. Note-se o fragmento inteiro, retirado na forma de um retângulo de 5 x 3 mm. A utilização de um descolador de periósteo delicado permitiu a manutenção da integridade meníngea.
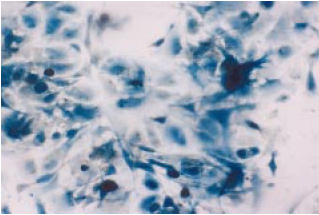
Figura 3 - Cultivo de CTM murinas. Ampliação: 100 vezes.

Figura 4 - Osso liofilizado fragmentado, após ter sido colocado em meio de cultivo celular contendo células-tronco mesenquimais indiferenciadas.
Após a cirurgia, os animais foram conduzidos a uma sala de recuperação e receberam tramadol injetável por 24 horas. Após quatro semanas, todos foram sacrificados em câmara de CO2, conforme o protocolo da Unidade de Experimentação Animal - Centro de Pesquisa - Hospital de Clínicas de Porto Alegre (HCPA).
O bloco de OL foi retirado para avaliação histológica. Nenhum osso nativo circunjacente foi levado junto. As amostras foram conduzidas imediatamente ao Laboratório de Patologia - Centro de Pesquisa - HCPA, para preparação histológica. A coloração utilizada foi com hematoxilinaeosina (HE) - Figuras 5 e 6.
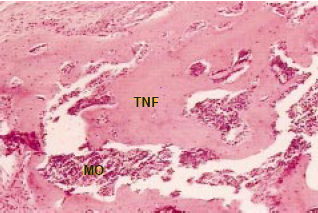
Figura 5 - Lâmina histológica de enxerto ósseo com célulastronco mesenquimais, corada com hematoxilina-eosina, após quatro semanas da cirurgia. Aumento: 400 vezes. (TNF: trabéculas neoformadas. MO: medula óssea).
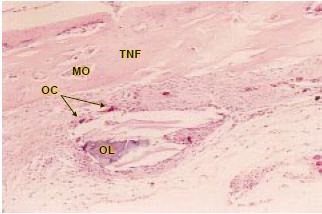
Figura 6 - Lâmina histológica de osso liofilizado, corada com hematoxilina-eosina, após quatro semanas da cirurgia. Observa-se neste corte um fragmento de osso liofilizado não totalmente reabsorvido, com osteoclastos ao seu redor. Aumento: 400 vezes. (TNF: trabéculas neoformadas, MO: medula óssea. OC: osteoclasto. OL: osso liofilizado).
Este trabalho seguiu as normas bioéticas estabelecidas pelo Grupo de Pesquisa e Pós-Graduação - HCPA, da Unidade de Experimentação Animal - Centro de Pesquisas - HCPA e do National Institutes of Health (NIRC).
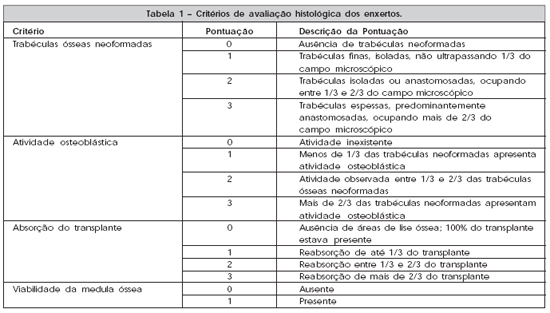
Para a avaliação histológica, foram utilizados os critérios histológicos propostos por Ferreira12, apresentados na Tabela 1. O critério de fusão de corticais foi retirado da avaliação neste estudo, porque poderia causar viés de aferição às análises bioquímicas futuras das amostras retiradas. O critério de número de osteoclastos também foi retirado porque se tratava de um número absoluto grande e que poderia distorcer a soma final da escala. O somatório da pontuação de cada critério permitiu uma análise semi-quantitativa dos resultados obtidos.
A análise estatística foi realizada com o Teste de Wilcoxon- Mann-Whitney para duas amostras independentes, uma vez que a natureza das variáveis era livre ou não-paramétrica. Foi considerada significativa uma diferença quando p< 0,05.
RESULTADOS
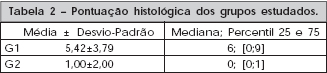
Foram analisadas 15 amostras no G1 e 19, no G2. A comparação estatística demonstrou diferença significativa entre o G1 e o G2 (p=0,002). A utilização de CTM determinou uma pontuação histológica maior nas amostras utilizadas, conforme demonstrado na Tabela 2.
DISCUSSÃO
Utilizaram-se animais transgênicos para facilitar a interação entre os cultivos e os organismos receptores. Utilizamos animais adultos porque a regeneração é menor; além disso, há maior absorção óssea nos imaturos13,14.
A utilização de CTM indiferenciadas nos enxertos ósseos de OL pareceu melhorar a integração e a regeneração na área receptora. A escala histológica utilizada baseou-se em quatro critérios importantes, que demonstram a presença de uma atividade regenerativa após uma enxertia.
Utilizamos o período de quatro semanas para a avaliação das condições do enxerto no sítio receptor. Esse período é condizente com aquele já observado por vários autores3,10,15,16.
O OL é oriundo de um Banco de Osso reconhecido pelo Ministério da Saúde, e que fornece enxertos de qualidade elevada. Trata-se do mesmo material utilizado em cirurgias ortopédicas do HCPA.
Não foi possível avaliar, neste estudo, alguns critérios importantes, como fusão de corticais e resistência da área reconstruída; para o último, animais maiores serão necessários.
As CTM podem ter um papel primário ou adjuvante na regeneração tecidual. Para determinar isso, far-se-á necessário um acompanhamento molecular de seu comportamento na área receptora, esclarecendo se ela faz a regeneração ou estimula outros grupos celulares a executá-la. A marcação dessas células com genes repórteres pode ser uma opção adequada.
CONCLUSÕES
Os enxertos com CTM indiferenciadas apresentaram resultados melhores, quando comparados àqueles sem combinação com células, do ponto de vista de regeneração histológica. O emprego de CTM pode significar uma melhoria na qualidade dos enxertos ósseos e uma otimização no tempo para a integração desses enxertos.
As técnicas de ET que utilizem CT e matrizes ósseas combinadas, preparadas antes de sua implantação na área a ser reconstruída, podem ser promissoras para cirurgias reparadoras do esqueleto craniofacial em seres humanos.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Shang Q, Wang Z, Liu W, Shi Y, Cui L, Cao Y. Tissueengineered bone repair of sheep cranial defects with autologous bone marrow stromal cells. J Craniofac Surg. 2001;12(6):586-95.
2. Issack PS, DiCesare PE. Recent advances toward the clinical application of bone morphogenetic proteins in bone and cartilage repair. Am J Orthop. 2003;32(9):429-36.
3. Brodie JC, Goldie E, Connel G, Merry J, Grant MH. Osteoblast interactions with calcium phosphate ceramics modified by coating with type I collagen. J Biomed Mater Res. 2005;73(4):409-21.
4. Chang SC, Wei FC, Chuang H, Chen YR, Chen JK, Lee KC et al. Ex vivo gene therapy in autologous critical-size craniofacial bone regeneration. Plast Reconstr Surg. 2003;112(7):1841-50.
5. Goessler UR, Hormann K, Riedel F. Tissue engineering with adult stem cells in reconstructive surgery. Int J Mol Med. 2005;15(6):899-905.
6. Muschler GF, Midura RJ. Connective tissue progenitors: practical concepts for clinical applications. Clin Orthop Relat Res. 2002;395:66-80.
7. Conrad C, Huss R. Adult stem cell lines in regenerative medicine and reconstructive surgery. J Surg Res. 2005;124(2):201-8.
8. Passier R, Mummery C. Cardiomyocyte differentiation from embryonic and adult stem cells. Curr Opin Biotechnol. 2005;16(5):498-502.
9. Sylvester KG, Longaker MT. Stem cells: review and update. Arch Surg. 2004;139(1):93-9.
10. Batouli S, Miura M, Brahim J, Tsutsui TW, Fisher LW, Gronthos S et al. Comparison of stem-cell-mediated osteogenesis and dentinogenesis. J Dent Res. 2003;82(12):976-81.
11. Pereira RF, O'Hara M, Laptev AV, Halford KW, Pollard MD, Class R et al. Marrow stromal cells as a source of progenitor cells for nonhematopoietic tissues in transgenic mice with a phenotype of osteogenesis imperfecta. Proc Natl Acad Sci USA. 1998;95(3):1142-7.
12. Ferreira JCR. Avaliação cintilográfica e histopatológica de transplantes ósseos autógenos, homógenos frescos e homógenos congelados do arco zigomático. Estudo experimental em coelhos [Tese de Doutorado]. São Paulo:Universidade Federal de São Paulo, Escola Paulista de Medicina;1997. 128p.
13. Riley EH, Lane JM, Urist MR, Lyons KM, Lieberman JR. Bone morphogenetic protein - 2: biology and applications. Clin Orthop Rel Res. 1996;324:39-46.
14. DeLacure MD. Physiology of bone healing and bone grafts. Otolaryngol Clin North Am. 1994;27(5):859-74.
15. Lohmann CH, Andreacchio D, Köster G, Carnes DL Jr, Cochran DL, Dean DD et al. Tissue response and osteoinduction of human bone grafts in vivo. Arch Orthop Trauma Surg. 2001;121(10):583-90.
16. Schwartz Z, Mellonig JT, Carnes DL Jr, De La Fontaine J, Cochran DL, Dean DD et al. Ability of commercial demineralized freeze-dried bone allograft to induce new bone formation. J Periodontol. 1996;67(9):918-26.
I. Cirurgião plástico. Membro associado da SBCP. Membro efetivo da SBCC. Mestre em Medicina pelo Programa de Pós-Graduação em Cirurgia - Faculdade de Medicina - Universidade Federal do Rio Grande do Sul (UFRGS).
II. Cirurgião plástico e craniomaxilofacial. Membro titular da SBCP e da SBCC. Chefe da Unidade de Cirurgia Craniomaxilofacial - Serviço de Cirurgia Plástica - Hospital de Clínicas de Porto Alegre (HCPA). Professor do Curso de Pós-Graduação em Cirurgia - Faculdade de Medicina - UFRGS. Doutor em Cirurgia pela Universidade de Barcelona.
III. Geneticista. Integrante do Laboratório de Imunogenética - Departamento de Genética - Instituto de Biociências - UFRGS. Mestre em Genética - UFRGS.
IV. Geneticista. Chefe do Laboratório de Imunogenética - Departamento de Genética - Instituto de Biociências - UFRGS. Doutora em Genética - University College London - University of London.
V. Cirurgião plástico. Membro titular da SBCP. Chefe do Serviço de Cirurgia Plástica - HCPA.
VI. Doutorandos da Faculdade de Medicina - UFRGS. Estagiários em pesquisa - Serviço de Cirurgia Plástica - HCPA.
Correspondência para:
Ciro Paz Portinho
Rua Chiriguano, 117 - Vila Assunção
Porto Alegre, RS - CEP 91900-570
Tel: (51) 8406-3076 - Fax: (51) 3066-4040
E-mail: cportinho@hotmail.com
Trabalho realizado na Unidade de Cirurgia Craniomaxilofacial - Serviço de Cirurgia Plástica - Hospital de Clínicas de Porto Alegre e no Laboratório de Imunogenética - Departamento de Genética - Instituto de Biociências - Universidade Federal do Rio Grande do Sul, RS.
Artigo recebido: 16/08/2006
Artigo aprovado: 11/09/2006


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter