

Reviw Article - Year 2010 - Volume 25 -
Diagnosis and treatment of infantile hemangioma
Diagnóstico e tratamento do hemangioma infantil
ABSTRACT
Infantile hemangioma is the most common benign tumor of infancy. Incidence is around 2.5 to 5% in caucasian newborns, with predominance in females. For a long period of time, the lack of a single classification accepted worlwide impaired treatment, management and comparisons between treatment groups. In 1996, The International Society for the Study of Vascular Anomalies proposed a classification for vascular anomalies, dividing vascular anomalies in two main groups: vascular tumors and vascular malformations. Infantile hemangioma is the most frequent vascular tumor. There are still several hypothesis for the explanation hemangioma development. Clinically there are three distinct phases, named proliferative, involutive and involuted. Diagnosis is clinically based and imaging methods like magnetic ressonance, ultrasound and interventional radiology may be useful in some cases. The majority of infantile hemangiomas have favorable resolution due to spontaneous regression. However, in some cases complications are present, like ulceration, bleeding, infection or systemic complications. In these cases, active treatment is indicated, as well as in cases of relative indication, depending on size and tumor location. Surgical resection and medical treatment are used. Medications more frequently used are oral corticosteroids, alfa-interferon - with more side effects and nowadays beta-blockers, with good response, less side effects, but still under research protocols.
Keywords: Hemangioma. Neoplasms, vascular tissue. Child.
RESUMO
O hemangioma infantil é o tumor vascular benigno mais frequente nas crianças. Apresenta incidência de 2,5 a 5% em recém-nascidos vivos caucasianos, com predominância no sexo feminino. Durante um longo período não havia uma classificação diagnóstica aceita internacionalmente, dificultando a criação de condutas, bem como comparações entre os diversos tratamentos. Em 1996, a International Society for the Study of Vascular Anomalies dividiu as anomalias vasculares em duas categorias: tumores vasculares e malformações vasculares. O hemangioma a partir deste momento passou a significar um tumor benigno com características peculiares. A sua origem ainda é incerta e diversas hipóteses são formuladas para explicá-la. O quadro clínico apresenta três fases bem definidas: proliferativa, involutiva e involuída. O diagnóstico é realizado por meio da anamnese e do exame físico; quando indicados, ressonância magnética, ultrassom e métodos angiográficos podem ser auxiliares. A maioria dos hemangiomas infantis tem resolução favorável para regressão completa, sem complicações. No entanto, alguns deles podem levar ao comprometimento funcional ou apresentar complicações como ulcerações, infecções, sangramentos ou complicações sistêmicas durante sua evolução. Estes são os casos em que há indicação terapêutica. Entretanto, outras indicações relativas de tratamento podem ser consideradas, devido à localização e às dimensões do tumor. Diversas opções de tratamentos estão disponíveis além do cirúrgico: os tratamentos clínicos, com corticoesteróides (o mais utilizado), o alfa-interferon, com suas indicações um pouco restritas pelos seus efeitos colaterais e, mais recentemente, os beta-bloqueadores, com boa resposta e poucos efeitos colaterais, mas ainda em fase de pesquisa em protocolos clínicos.
Palavras-chave: Hemangioma. Neoplasias de tecido vascular. Criança.
Conceitua-se anomalia vascular a lesão de etiologia congênita ou adquirida cujos componentes predominantes são estruturas vasculares. São incluídos neste grupo todas as malformações congênitas do sistema vascular, tais como as malformações arteriais, venosas, linfáticas, capilares e suas combinações, os tumores vasculares benignos, como os hemangiomas, hemangioendoteliomas, angiomas em tufos, glomangiomas, granulomas piogênicos e também os tumores vasculares malignos, como os hemangioendoteliossarcomas e os angiossarcomas1-5.
Por longo período de tempo não houve consenso em relação à terminologia e à classificação destas lesões, com impacto negativo nas indicações terapêuticas, muitas vezes aplicadas de forma heterogênea e não parametrizada, elevando a probabilidade de condutas iatrogênicas.
As primeiras classificações adotadas para a categorização das anomalias vasculares apresentavam características puramente descritivas. Sucessivamente, deram lugar às classificações baseadas em achados anatomopatológicos, embriológicos e as classificações baseadas no comportamento biológico da lesão1,6-8.
A falta de classificação diagnóstica aceita internacionalmente não permitia, até recentemente, a padronização terapêutica adequada, dificultando a criação de condutas protocoladas, além de comprometer a comparação entre diferentes opções de tratamento.
Na atualidade, a classificação baseada no aspecto biológico é adotada internacionalmente. Baseia-se na correlação entre comportamento biológico celular e evolução clínica, com impacto direto no tipo de tratamento definido. Em 1996, a International Society for the Study of Vascular Anomalies (ISSVA), entidade internacional responsável por definir as diretrizes no tratamento das anomalias vasculares, aprimorou a classificação proposta inicialmente por Mulliken e Glowacki, levando ao fim as clássicas denominações de hemangiomas fragifome, capilar, cavernoso ou tuberoso e ainda outras denominações como nevus flameus e linfangiomas. A classificação proposta pela ISSVA divide as anomalias vasculares de modo simples e prático, em apenas duas principais categorias: os tumores vasculares e as malformações vasculares (Tabela 1). Com a aplicação desta classificação, tornou-se possível um melhor diálogo entre os profissionais e uniformização na nomenclatura entre clínicos, cirurgiões e patologistas8,9.
Hemangioma, a partir deste momento, passou a significar apenas um tumor vascular benigno, com características peculiares, decorrente de distúrbios no processo de angiogênese, ou seja, a formação de estruturas vasculares a partir de vasos sanguíneos pré-existentes.
As malformações vasculares, anomalias congênitas da vasculogênese - processo de formação de estruturas vasculares a partir de precursores vasculares - contempla, portanto, todas as anomalias congênitas do sistema vascular. As antigas denominações de hemangiomas tuberoso, cavernoso, e capilar são agora classificadas e denominadas malformações vasculares artério-venosas, venosas e capilares, respectivamente. Da mesma forma, o linfangioma passou a ser denominado malformação linfática.
Hemangioma: um Tumor Vascular com Comportamento Peculiar
O hemangioma é uma neoplasia propriamente dita. Apresenta proliferação endotelial pré-natal ou pós-natal, crescimento por hiperplasia e hipertrofia celular, com características microscópicas e ultramicroscópicas de tecido neoplásico, sendo facilmente cultivado em culturas celulares8. A origem dos hemangiomas, ainda hoje, é incerta. As teorias propostas incluem alterações intrínsecas do feto, resposta inadequada das células endoteliais aos fatores estimuladores e inibidores da angiogênese, incluindo também a modulação hormonal materna e defeitos clonais nos precursores das células endoteliais10,11.
Diversos fatores causais estão sendo estudados na tentativa de compreender a fisiopatologia do hemangioma infantil. O foco é o microambiente. Dentre as principais hipóteses podemos citar a influência das alterações genéticas, o papel dos receptores hormonais, a proliferação de células tronco (precursoras de células endoteliais), o balanço entre fatores pró e anti-angiogênicos e a influência do suprimento nervoso autonômico10.
Identificam-se alterações nas células estromais à imunohistoquímica, que apresentam padrão específico para o hemangioma, podendo estar presente de maneira diferenciada conforme a fase evolutiva do tumor.
Dentre os marcadores de proliferação celular, podemos citar a elevação dos níveis de VEGF (vascular endothelial growth factor) e bFGF (basic fibroblast grow factor). Além desses marcadores, identificou-se nos hemangiomas a presença de marcadores positivos para GLUT-1 (Glucose Transporter 1), proteína transportadora de glicose, que é também expresso na placenta, tecidos embrionários e fetais. O GLUT-1 não apresenta relação com atividade mitótica e é negativo em outras patologias vasculares, como granuloma piogênico, angiossarcoma e malformações vasculares. É considerado um marcador específico para diagnóstico do hemangioma infantil e encontra-se presente em todas as fases evolutivas do hemangioma infantil (HI)8,10.
Aspectos Epidemiológicos
Os HI cutâneos são os tumores vasculares benignos mais frequentes dentre todas as lesões tumorais da criança. A incidência dos hemangiomas cutâneos varia de 2,5 a 5% em recém-nascidos caucasianos. Se avaliados durante o primeiro ano de vida, a incidência aumenta para 10 a 12%. Cerca de 80% das lesões são observadas durante o primeiro mês de vida, sendo localizadas na região cérvico-facial em 60% dos casos. Há predominância no sexo feminino, 3 a 5 vezes maior que no masculino4,5,10-15.
Estudo recente de Haggstrom et al.16 determinou fatores de risco para o surgimento de hemangiomas. Dentre diversos fatores, foram considerados relevantes:
1. baixo peso ao nascer3;
2. prematuridade5,15;
3. sexo feminino5;
4. multiparidade (últimos filhos);
5. idade materna avançada.
Classificação Atual dos Hemangiomas Infantis
Os hemangiomas podem ser classificados em cutâneos ou viscerais.
A forma cutânea, por sua vez, é dividida sob dois aspectos: profundidade e extensão. Quanto à profundidade, podem ser superficiais (acometimento apenas da pele), profundos (acometimento das partes moles, profundos a pele) ou mistos (Figura 1). Quanto à extensão, podem ser localizados ou segmentares (Figura 2). Hemangioma segmentar é aquele que acomete inteiramente uma unidade anatômica ou um segmento corporal (uma hemiface, um membro, etc). Hemangiomas segmentares apresentam maior correlação com complicações, anomalias estruturais e necessidade de tratamento4.
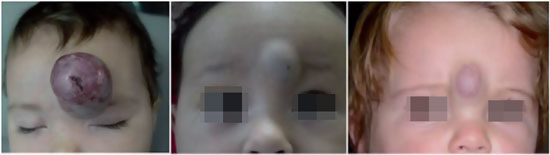
Figura 1 - Tipos de hemangioma quanto à profundidade. Da esquerda para a direita, superficial, profundo e misto.
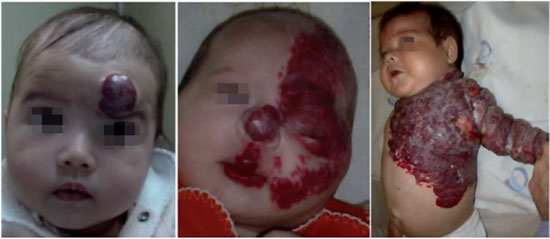
Figura 2 - Tipos de hemangioma conforme a localização. À esquerda localizado; centro, segmentar facial; direita, segmentar acometendo tronco e membro.
Quadro Clínico
A história natural do hemangioma é dividida em três fases bem caracterizadas: a fase inicial de crescimento, denominada fase proliferativa, seguida de uma fase de regressão espontânea ou fase involutiva e uma terceira fase de equilíbrio final ou fase involuída13 (Figura 3).
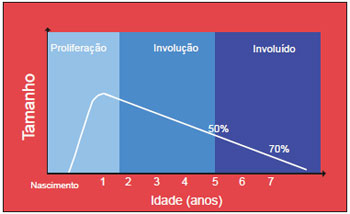
Figura 3 - Representação gráfica dos hemangiomas conforme a fase evolutiva.
Durante a fase proliferativa, o tumor cresce de maneira rápida, podendo assumir dimensões consideráveis em proporção ao tamanho da criança. Dependendo de sua localização, pode causar comprometimento funcional, estético e psíquico. O crescimento neoplásico pode causar necrose da lesão por insuficiência vascular, principalmente em suas porções centrais, levando a ulcerações de repetição e, potencialmente, a sangramentos e processos infecciosos locais, fatores que não guardam relação com o potencial de regressão da lesão (Figura 4) .
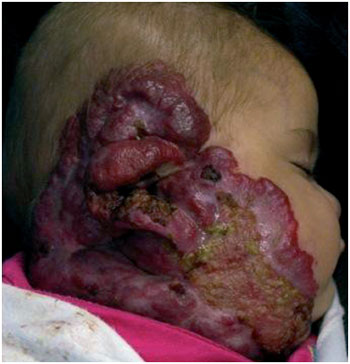
Figura 4 - Exemplo de hemangioma em fase proliferativa com ulceração.
A fase proliferativa é mais pronunciada nos primeiros 3 a 6 meses de vida e alcança, na maior parte dos casos, suas dimensões máximas ao redor de 9 a 12 meses de vida, podendo se estender até o segundo ano de vida9,10 (Gráfico 1).
Durante a proliferação, o tumor se caracteriza como lesão sólida, compressível, quente, bem delimitada e sem sinais de hiperfluxo. Eventualmente, pode se observar aumento da vascularização peritumoral, o que explica o aumento de volume aos esforços e ao chorar. Os HI cutâneos e mistos apresentam coloração avermelhada típica, explicando a antiga denominação de hemangioma fragiforme.
A fase de involução ocorre a seguir, caracterizada pela mudança de coloração (do vermelho vivo ao pálido ou cinza)e torna-se mais compressível à medida que é substituído por tecido fibro-adiposo, num processo biologicamente caracterizado por indução à apoptose celular. O processo tipicamente se inicia do centro para a periferia da lesão9,10,14 (Figura 5).
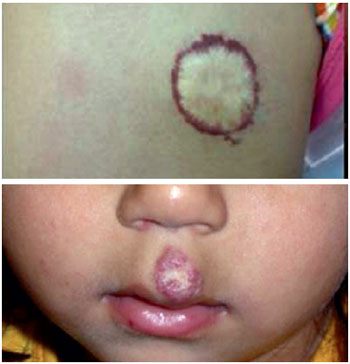
Figura 5 - Aspecto típico de hemangioma em fase involutiva com atrofia cicatricial da região central.
Estima-se que o ritmo de involução seja ao redor de 10% ao ano e que cerca de 70% das lesões já estejam involuídas aos 7 anos de idade9 (Figura 6). Uma vez estabilizada esta fase, considera-se o hemangioma involuído10. A fase involuída do hemangioma não implica obrigatoriamente em retorno à normalidade, uma vez que no local da lesão podem restar sequelas, como tumor residual, atrofia cutânea, áreas cicatriciais, telangectasia, hipo ou hipercromia cutânea, alopecia e irregularidades de contorno6,10,13,15.
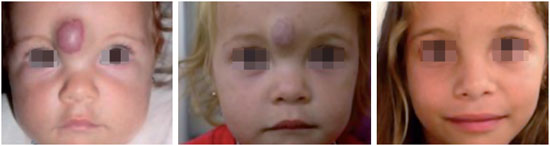
Figura 6 - Exemplo evolutivo de hemangioma cutâneo misto.
Durante a evolução dos hemangiomas, podem ocorrer situações que causem desvio do comportamento inofensivo desta afecção. Denomina-se complicação aos eventos que causam problemas locais ou sistêmicos. As complicações locais mais frequentes são ulceração, sangramento e infecção. Complicações sistêmicas são consideradas quando há comprometimento à função de um sistema ou órgão, tais como insuficiência cardíaca congestiva, obstrução de vias aéreas e obstrução visual9,10,14 (Figura 7).
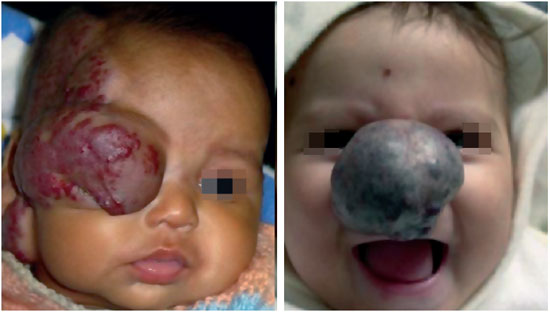
Figura 7 - Complicações sistêmicas: obstrução do eixo visual e de vias aéreas.
Métodos Diagnósticos Auxiliares
A grande maioria dos HI pode ser diagnosticada apenas pela anamnese e exame físico. Quando indicados,ultrassonografia, tomografia computadorizada, ressonância magnética e métodos angiográficos são utilizados como métodos auxiliares no diagnóstico das anomalias vasculares. Atualmente, o método de maior sensibilidade e especificidade para o diagnóstico do HI é a ressonância nuclear magnética12. Portanto, nos casos de dúvida, a ressonância magnética é o método de escolha.
À ressonância nuclear magnética em T1, os HI apresentam sinal isointenso ou hipointenso em relação ao tecido muscular. À injeção de contraste, apresentam intensificação uniforme. Nas sequências em T2, apresentam hipersinal, como massa lobulada. Nos estudos de gradiente de fluxo mostram vasos perilesionais com alto fluxo16.
A tomografia computadorizada revela intensificação uniforme da massa, com vasos dilatados ao seu redor, sendo menos específico12.
Apesar de pouco invasivo, o exame ultrassonográfico mostra massa tumoral composta por vasos de alto fluxo, com pequena resistência arterial, sendo também pouco específico quanto ao diagnóstico diferencial12.
Na fase involutiva, à ressonância magnética, nas sequências em T1 e T2, observa-se conteúdo variável de gordura. As mesmas alterações se observam na ultrassonografia e na tomografia computadorizada.
Na fase involuída, os HI comportam-se como uma lesão avascular. A ressonância em T1 mostra lesão com hipersinal (similar à gordura), sem intensificação após a injeção de contraste. Em T2, apresenta hiposinal (similar à gordura), sem sinais de fluxo sanguíneo nos estudos de gradiente. À tomografia computadorizada observa-se uma massa com densidade de tecido gorduroso. À ultrassonografia mostra-se como uma massa avascular ecogênica16.
Tratamento
A grande maioria dos hemangiomas tem evolução favorável para regressão completa, sem complicações. Nestes casos, a conduta recomendada é conservadora, classicamente conhecida como conduta expectante. Deve englobar acompanhamento clínico rigoroso, documentação fotográfica seriada e apoio psicológico ao paciente e seus familiares10,12,17.
A evolução favorável e desejada nem sempre ocorre. Desta forma, a instituição de algum tipo de tratamento pode se tornar necessária, para reduzir o volume da lesão, tratar a dor, sangramento, infecção ou restabelecer a integridade funcional e estética do paciente, em qualquer momento.
Tratamento Ativo dos Hemangiomas
O risco de comprometimento funcional, as dimensões e a ocorrência de complicações evolutivas são os principaisfatores considerados na indicação terapêutica. Um bom exemplo é a relação entre hemangiomas faciais que têm distribuição na região da barba e a presença de hemangiomas subglóticos que podem causar obstrução respiratória4.
Hemangiomas perioculares, lombossacrais, que comprometam as vias aéreas ou que sejam múltiplos (maior que 5), são também indicativos de maior atenção e indicação terapêutica4.
A indicação para tratamento ativo dos hemangiomas pode ser didaticamente dividida em duas categorias: indicação emergencial e indicação relativa.
O tratamento emergencial é indicado em situações específicas que requerem intervenção precoce, incluindo o acometimento funcional grave, como a obstrução do eixo visual com risco de ambliopia, obstrução ou compressão das vias respiratórias e do canal auditivo, além de coagulopatias e insuficiência cardíaca congestiva, causadas por lesões de grande volume. Complicações sistêmicas associadas a tumores vasculares podem compor síndromes, como a síndrome de Kassabach- Merrit (SKM). É caracterizada por trombocitopenia, anemia hemolítica e coagulopatia. Os importantes estudos de Drolet et al.4 e Enjoras et al.3 comprovaram, entretanto, que a SKM não ocorre em HI e sim em outros tumores vasculares, os hemangioendoteliomas kaposiformes e os angiomas em tufos.
Em todas as situações emergenciais, a indicação de uma conduta ativa, clínica ou cirúrgica, é absoluta, estabelecida e sem aparentes controvérsias na literatura.
As indicações relativas de tratamento, por outro lado, requerem melhor avaliação por parte do médico, pesando o risco de uma terapêutica e os possíveis efeitos adversos do tratamento. Nestes casos, a definição de critérios para indicação de tratamento é fundamental (Tabela 2).
Tipos de Tratamento
Independente da indicação, as modalidades de tratamento podem ser cirúrgica ou clínica.
Tratamento Clínico
O tratamento clínico medicamentoso pode utilizar drogas de uso local (tópico ou intralesional) ou sistêmico (oral ou injetável). Os medicamentos mais utilizados são os corticoesteróides e o alfa-Interferon10,12. A recente indicação do uso de betabloqueadores, ainda sob investigação, parece bastante promissora18,19.
Corticoesteróides
A prednisona, corticosteróide de uso sistêmico administrado por via oral, é largamente utilizada. As teorias mais aceitas atribuem ao corticosteróide efeito inibidor inespecífico da angiogênese e ação por contração dos esfíncteres pré-capilares, causando hipofluxo sanguíneo à lesão10,20. Entretanto, seu mecanismo específico de ação não é totalmente esclarecido. A resposta terapêutica ao corticóide é variável e oscila entre taxas de eficácia de 30 a 84%14,20, podendo ocorrer respostas marcadamente efetivas ou apenas uma redução na taxa decrescimento da lesão (Figura 8).
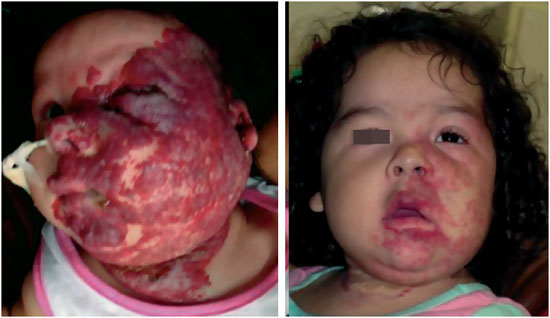
Figura 8 - Resposta ao tratamento clínico com corticoesteróides.
A dose de prednisona utilizada na maioria dos protocolos varia de 1 a 3mg/kg/dia, mantendo-se a medicação, em média, por 3 a 6 meses, quando eficaz14,20.
A resposta, quando efetiva, é observada, em média, após uma semana do início do tratamento. Os efeitos colaterais não são desprezíveis e os mais comuns são aparência cushingóide, irritabilidade, hipertensão arterial, transtornos gastrointestinais, diminuição da velocidade de crescimento e do perímetro cefálico e ganho de peso14. Apesar de ser uma medicação supressora da função de células T, infecção parece ser uma complicação pouco frequente. Segundo a maioria dos estudos, os efeitos adversos são reversíveis com a suspensão da medicação12,20.
Observa-se, em alguns casos, que a suspensão da medicação pode causar efeito rebote e novo crescimento da lesão. A reintrodução da medicação é indicada ou pode ser substituída por outra opção terapêutica21.
Dentre os corticoesteróides de uso injetável intralesional, os mais utilizados são o acetato de triancinolona e de betametasona. A eficácia terapêutica é comparável aos corticoesteróides sistêmicos. Entretanto, efeitos colaterais, como atrofia cutânea e alterações pigmentares na pele, podem ocorrer. Estudos que avaliaram sua aplicação em HI faciais relataram vários casos de comprometimento da visão, necrose cutânea e alterações tróficas da pele11.
Alfa-Interferon
Nos casos sem resposta efetiva ao corticoesteróide, a opção mais frequentemente utilizada, como segunda linha de tratamento, é o alfa-interferon 2b, administrado por via subcutânea, na dose de 3 milhões de UI/m2 SC. O alfa-interferon (alfa-IF) age como inibidor da proliferação endotelial e leva à diminuição da expressão de bFGF (basic fibroblast growth factor). Geralmente, os efeitos terapêuticos do alfa-IF apresentam surgimento mais tardio em comparação ao corticóide oral, porém sua eficácia é maior12,21-23.
A associação de corticoesteróides e alfa-IF não encontra respaldo na literatura em relação ao efeito aditivo destas medicações. Ao contrário, somam-se apenas os efeitos colaterais.
Esta medicação apesar de bastante efetiva, apresenta maior taxa de efeitos colaterais, como febre, mal-estar, diarréia, neutropenia, anemia e elevação de transaminases. A complicação mais grave e definitiva é o desenvolvimento de transtorno neurológico denominado diplegia espástica4,4,12,23. Nos casos em que a terapêutica clínica foi indicada e não houve sucesso com o uso de corticosteróides ou interferon, outras drogas têm sido utilizadas, como os quimioterápicos (vincristina e a ciclosfosfamida), que agem como inibidores de angiogenese tumoral10,12 e os imunomoduladores (imiquimod, bleomicina e becaplemin)10,13. Entretanto, os estudos publicados tratam de pequenas casuísticas, sem grandes estudos populacionais ou seguimento de longo prazo que justifique seu uso rotineiro.
Novas Perspectivas no Tratamento Clínico
Recentemente, Léauté-Labrèze et al.20 relataram o uso de betabloqueadores (propranolol) para o tratamento do HI10,19,24. O achado fortuito de redução significativa no volume de hemangiomas foi observado quando do uso desta droga para o tratamento dos efeitos colaterais decorrentes do uso de corticóide sistêmico para o tratamento do hemangioma infantil. Redução significativa do volume tumoral foi observada após introdução do betabloqueador, mesmo em um curto período de tempo, com resultados estáveis após o término do tratamento, sugerindo evidências do benefício da droga no tratamento do tumor. Outros autores também relataram o uso da medicação com sucesso18,24. Estudos iniciais recentes demonstraram efetividade do propranololquando utilizado isoladamente, sugerindo a presença de mecanismos de ação específicos para esta medicação.
As teorias para a efetividade dos betabloqueadores incluem a atuação no tumor por mecanismos vasoconstritores, a diminuição da expressão dos genes dos fatores de crescimento VEGF e bFGF e o incremento na taxa de apoptose das células endoteliais19,25 (Figura 9).
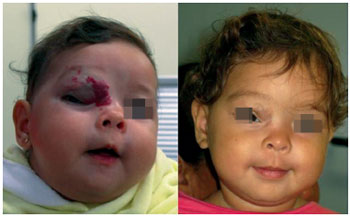
Figura 9 - Resposta ao tratamento clínico com betabloqueador.
Protocolo prospectivo foi iniciado em nosso meio, além de diversos outros em vários centros mundiais, com resultados promissores nas séries de casos individuais já publicadas.
Tratamento Cirúrgico
A ressecção cirúrgica dos hemangiomas deve respeitar preceitos técnicos rigorosos. A remoção da lesão não deve acarretar sequela resultante maior que a possivelmente deixada pela involução espontânea da lesão. Neste sentido, ressecções parciais de hemangiomas podem ser realizadas, resolvendo o problema que motivou a indicação de tratamento e permitindo, com a involução posterior da lesão, uma solução definitiva9 (Figura 10).
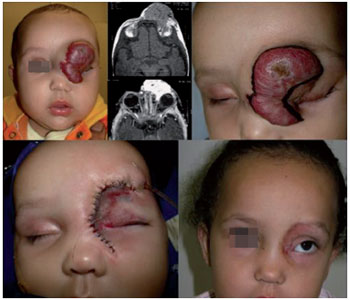
Figura 10 - Tratamento cirúrgico de hemangioma facial (indicação absoluta, obstrução do eixo visual).
Nos casos de indicação relativa, o tratamento cirúrgico é mais indicado para lesões em áreas em crescimento com potencial desfigurante ou comprometimento funcional relativo, como nariz, lábios e orelhas na face, lesões digitais, lesões na região mamária e genital. Nestes casos, o crescimento do hemangioma pode causar distorção definitiva das estruturas em crescimento e a remoção deste "efeito de massa" pode ser importante para o desenvolvimento normal da região. Além disso, o comprometimento estético e a dificuldade de convívio social na presença de lesões muito visíveis e estigmatizantes torna mais liberal a indicação de tratamento cirúrgico9 (Figura 11).
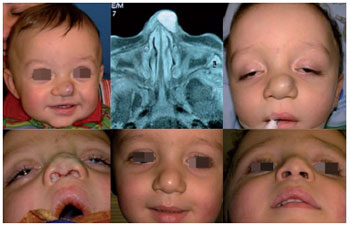
Figura 11 - Tratamento cirúrgico de hemangioma em ponta nasal (indicação relativa).
Lesões pedunculadas e facilmente removíveis também são de indicação cirúrgica pela característica definitiva do tratamento12,14.
Nas lesões involuídas, o tratamento cirúrgico se faz necessário para o tratamento das deformidades residuais definitivas, que somente serão reparadas com este tipo de abordagem, uma vez que não responderão à terapêutica medicamentosa9,14.
Na literatura, descreve-se a utilização de diversos tipos de Laser, em variadas situações durante o tratamento dos hemangiomas. Três indicações destacam-se por apresentarem resultados positivos em alguns estudos: na fase proliferativa, por meio da aplicação intralesional para redução do volume tumoral; no tratamento de hemangiomas ulcerados e no tratamento de telangectasias residuais, na fase involuída. O uso do laser para o tratamento dos HI em sua fase proliferativa é controverso, uma vez que somente respondem ao tratamento lesões finas e superficiais, após múltiplas sessões4,13,26,27.
REFERÊNCIAS
1. Mulliken JB, Glowacki J. Hemangiomas and vascular malformations in infants and children: a classification based on endothelial characteristics. Plast Reconstr Surg. 1982;69(3):412-22.
2. Jackson IT, Carreño R, Potparic Z, Hussain K. Hemangiomas, vascular malformations, and lymphovenous malformations: classification and methods of treatment. Plast Reconstr Surg. 1993;91(7):1216-30.
3. Enjolras O, Wassef M, Mazoyer E, Frieden IJ, Rieu PN, Drouet L, et al. Infants with Kasabach-Merritt syndrome do not have "true" hemangiomas. J Pediatr. 1997;130(4):631-40.
4. Drolet BA, Esterly NB, Frieden IJ. Hemangiomas in children. N Engl J Med. 1999;341(3):173-81.
5. Metry DW, Hebert AA. Benign cutaneous vascular tumors of infancy: when to worry, what to do. Arch Dermatol. 2000;136(7):905-14.
6. Mulliken JB, Young AE. Vascular birthmarks. Hemangiomas and malformations. Philadelphia:W.B. Saunders; 1998.
7. Niechajev IA, Clodius L. Diagnostic criteria of vascular lesions in the face. Ann Plast Surg. 1993;31(91):32-41.
8. Enjoras O, Wassef M, Chapot R. Introduction: ISSVA classification.Cambridge University Press. [Online] [Cited: 2009 16-06.] http://assets.cambridge.org/97805218/48510/excerpt/9780521848510_excerpt.pdf.
9. Goldenberg DC. Estudo crítico dos resultados obtidos no tratamento dos hemangiomas cutâneos cervicofaciais [Dissertação de mestrado]. São Paulo:Faculdade de Medicina da Universidade de São Paulo; 2002. 164p.
10. Boye E, Jinnin M, Olsen BR. Infantile hemangioma: challenges, new insights, and therapeutic promise. J Craniofac Surg. 2009;20(Suppl 1):678-84.
11. Bauland CG, van Steensel MA, Steijlen PM, Rieu PN, Spauwen PH. The pathogenesis of hemangiomas: a review. Plast Reconstr Surg. 2006;117(2):29e-35e.
12. Brown TJ, Friedman J, Levy ML. The diagnosis and treatment of common birthmarks. Clin Plast Surg. 1998;25(4):509-25.
13. Bruckner AL, Frieden IJ. Hemangiomas of infancy. J Am Acad Dermatol. 2003;48(4):477-93.
14. Frieden IJ, Eichenfield LF, Esterly NB, Geronemus R, Mallory SB. Guidelines of care for hemangiomas of infancy. J Am Acad Dermatol. 1997;37(4):631-7.
15. Takahashi K, Mulliken JB, Kozakewich HP, Rogers RA, Folkman J, Ezekowitz RA. Cellular markers that distinguish the phases of hemangioma during infancy and childhood. J Clin Invest. 1994;93(6):2357-64.
16. Haggstrom AN, Drolet BA, Baselga E, Chamlin SL, Garzon MC, Horii KA, et al. Prospective study of infantile hemangiomas: clinical characteristics predicting complications and treatment. Pediatrics. 2006;118(3):882-7.
17. Burrows PE, Laor T, Paltiel H, Robertson RL. Diagnostic imaging in theevaluation of vascular birthmarks. Dermatol Clin. 1998;16(3):455-88.
18. Goldenberg, DC., et al. Tratamento dos hemangiomas cutâneos. Pediatria. 2001:45-51.
19. Baselga E. Propanolol for the treatment of infantile hemangiomas of infancy. Ped Dermatol. 2008;25(6):674.
20. Léauté-Labrèze C, Dumas de la Roque E, Hubiche T, Boralevi F, Thambo JB, Taïeb A. Propanolol for severe hemangiomas of infancy. N Engl J Med. 2008;358(24):2649-51.
21. Pope E, Krafchik BR, Macarthur C, Stempak D, Stephens D, Weinstein M, et al. Oral versus high-dose pulse corticosteroids for problematic infantile hemangiomas: a randomized, controlloed trial. Pediatrics. 2007;119(6):e1239-47.
22. Mulliken JB. Pharmacologic therapy for endangering hemangiomas. Curr Opin Dermatol 1995:109-13.
23. Folkman J, Mulliken JB, Ezekowitz RA. Angiogenesis and hemangioma. Philadelphia:Lippcott Raven Publisher; 1997. p.569-80.
24. Chang E, Boyd A, Nelson CC, Crowley D, Law T, Keough KM, et al. Successful treatment of infantile hemangiomas with interferon-alfa-2b. J Pediatr Hematol Oncol. 1997;19(3):237-44.
25. Siegfried EC, Keenan WJ, Al-Jureidini S. More on propranolol for hemangioma of infancy. N Engl J Med. 2008;359(26):2846-7.
26. Léauté-Labrèze C, Taïeb A. Effecacité des bêtabloquants dans les hémangiomes capillaires infantiles: signification physiopathologique et conséquences thérapeutiques. Ann Dermatol Venereol. 2008;135(12):860-2.
27. Achauer BM, Celikoz B, Vanderkam VM. Intralesional bare fiber laser treatment of hemangioma of infancy. Plast Reconstr Surg. 1998;101(5):1212-7.
1. Médico Residente do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP).
2. Assistente Doutor da Divisão de Cirurgia Plástica do HC-FMUSP; Membro Titular da Sociedade Brasileira de Cirurgia Plástica.
Trabalho realizado no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP)
Artigo submetido no SGP (Sistema de Gestão de Publicações) da RBCP
Correspondência para:
Dov Charles Goldenberg
Rua Pedro de Toledo, 980 cj. 124 - Vila Clementino
São Paulo, SP, Brasil - CEP 04039-002
E-mail: drdov@terra.com.br
Artigo recebido: 17/12/2009
Artigo aceito: 27/4/2010



 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter