

Original Article - Year 2010 - Volume 25 -
Tamoxifen as treatment to keloids and hypertrophic scars
Uso do tamoxifeno no tratamento de quelóides e cicatrizes hipertróficas
ABSTRACT
Background: Keloids and hypertrophic scars (HScs) are poorly understood cicatricial lesions without a gold-standard treatment. Recent experiments demonstrated that cytokines imbalance has an action in scar pathogenesis, mainly due to transforming growth factor (TGF) β#1 overexpression. Tamoxifen, an antioestrogenic drug, can inhibit TGF-β1 release and consequently fibroblastic proliferation. This indicates a possible role of Tamoxifen as a therapeutic option in keloids and HScs. Method: Eighteen patients were selected for the evaluation of tamoxifen citrate 0.1% for six months. During that evolution, photographic registration, dimensional evaluation and hystopathologic analisis of the lesions were accomplished and questionnaires about aspects of the lesion were applied to patients. Results: There was a significant reduction of the lesion height (p < 0.0001), width (p = 0.009) and length (p = 0.009). Texture criteria, height and itch were the ones that obtained the largest variations among the periods before and after treatment. Histological changes suggested remodelling action of the collagen in those scars. Conclusions: Tamoxifen citrate presented positive results in most of the analyzed criteria, minima side effects and low cost, constituting a safe and comfortable treatment option, mainly in HScs. There will be necessary more research with larger sampling for greater conclusions.
Keywords: Keloid. Cicatrix, hypertrophic. Tamoxifen.
RESUMO
Introdução: Existe pouco entendimento a respeito dos mecanismos que levam à formação dos quelóides e cicatrizes hipertróficas (CHT), assim como não há um tratamento padrão-ouro para essas lesões. Experiências recentes demonstraram que as alterações na formação dessas cicatrizes envolvem concentrações desequilibradas de fatores de crescimento locais, em particular o fator de crescimento transformador (TGF) β1. O tamoxifeno, ao inibir a produção desta citocina, pode ser uma nova opção na conduta terapêutica destas lesões. Método: Dezoito pacientes portadores de quelóides e CHT foram selecionados para a avaliação do uso do citrato de tamoxifeno 0,1% por um período de seis meses. Durante essa evolução, foi realizado registro fotográfico, mensuração e análise histopatológica das lesões e questionários relativos a aspectos da lesão foram aplicados aos pacientes. Resultados: Houve redução significativa da altura (p < 0,0001), da largura (p = 0,009) e do comprimento (p = 0,009) das lesões. Os critérios de textura, altura e prurido foram os que obtiveram as maiores variações entre os períodos pré e pós-tratamento. As alterações histológicas sugerem uma ação de remodelamento do colágeno nessas cicatrizes. Conclusões: O citrato de tamoxifeno apresentou uma resposta favorável na maioria dos critérios analisados, mínimos efeitos colaterais e baixo custo, constituindo uma opção de tratamento segura e cômoda, principalmente nas CHT. São necessários novos estudos com maior amostragem para obtenção de conclusões mais abrangentes.
Palavras-chave: Quelóide. Cicatriz hipertrófica. Tamoxifeno.
O quelóide e a cicatriz hipertrófica (CHT) são fenômenos cicatriciais dérmicos anômalos, caracterizados por superprodução de matriz extracelular, diminuição de sua degradação e presença de fibroblastos dérmicos com altas taxas de proliferação, e que pode causar deformidades físicas, dor, prurido, dificuldade de movimentação e trauma psicológico1-5.
Quelóides são mais frequentes entre negros e asiáticos e na faixa etária que abrange a adolescência e adultos jovens. As regiões mais acometidas são áreas de pele espessa e tensa, tais como dorso, região pré-esternal e região deltóidea, podendo também afetar a face e os lobos das orelhas6. Não obstante o avanço na terapêutica clínica e cirúrgica destas lesões, não existe, até o momento, um tratamento padrão-ouro definido7.
Descreve-se como um dos fatores relacionados à patogênese destas lesões um desequilíbrio na liberação de fatores de crescimento locais, tais como o fator de crescimento transformador (TGF) β, uma citocina capaz de estimular a produção de matriz extracelular e com potente ação fibrogênica8-12.
O tamoxifeno é um agente anti-estrogênico não-esteroidal sintético que é usado no tratamento adjuvante de neoplasias da mama3. Estudos in vitro demonstraram a capacidade do tamoxifeno de promover a inibição da expressão do TGF-β, tendo como principal consequência a inibição da proliferação de fibroblastos produtores da matriz extracelular em amostras de tecidos queloidianos12-16. Esta ação do tamoxifeno sugere uma possível ação terapêutica em lesões cicatriciais patológicas.
A proposta desse estudo é observar os efeitos do uso tópico de citrato de tamoxifeno a 0,1% em pacientes portadores de quelóides e CHT, com avaliação clínica e histológica das lesões. O objetivo maior é tentar oferecer um tratamento de baixo custo, simples, atraumático e cômodo, facilitando a adesão do paciente ao mesmo.
MÉTODO
O estudo consistiu em uma análise descritiva das alterações clínicas e histológicas em quelóides e CHT submetidos à aplicação tópica de citrato de tamoxifeno a 0,1% veiculado em creme oil free para aplicação duas vezes por dia, após higienização local com água e sabão neutro, por um período de seis meses.
Os princípios éticos que regem a experimentação humana foram seguidos, todos os pacientes assinaram o termo de consentimento informado e houve aprovação pelo Comitê de Ética em Pesquisa do Hospital Universitário de Sergipe.
Foram selecionados 18 pacientes com o diagnóstico clínico de quelóide ou CHT, no período de maio a dezembro de 2008, no Centro de Tratamento de Queimaduras do Hospital de Urgências de Sergipe (HUSE) e nas enfermarias e ambulatórios do Hospital Universitário da Universidade Federal de Sergipe (UFS) e do HUSE.
Critérios de inclusão
Foram considerados aptos a participar da pesquisa os pacientes portadores de quelóides ou cicatrizes hipertróficas, de etiologia cirúrgica ou traumática, com mais de seis meses de evolução, comprometidos em comparecer, semanalmente, às consultas no primeiro mês e, mensalmente, nos meses subsequentes.
Critérios de exclusão
Pacientes com lesões em áreas de difícil aplicação do produto, portadores de alergia a algum componente da fórmula, que estivessem recebendo outro tipo de tratamento para quelóides ou com doenças associadas. Foram excluídos das biópsias os pacientes com coronariopatia descompensada, crianças de tenra idade ou pacientes com fobia ao procedimento.
No primeiro mês de seguimento, as consultas foram realizadas semanalmente e, após esse período, tornaram-se mensais. Em todas as consultas, foram realizados anamnese, exame físico, preenchimento de questionário relativo aos aspectos da cicatriz (altura, desconforto, dor, prurido e textura), bem como documentação fotográfica e mensuração das lesões, a qual foi realizada com auxílio de paquímetro (Figura 1). Para a avaliação subjetiva quanto aos aspectos da cicatriz, o paciente foi orientado a atribuir uma nota de 0 a 10, sendo 10 considerada uma nota negativa e 0 a mais favorável possível para cada quesito.
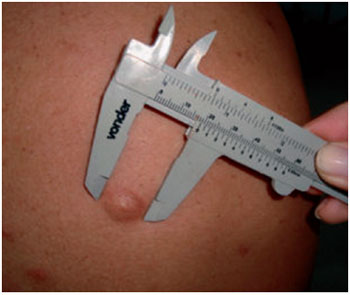
Figura 1 - Uso do paquímetro para a medição do quelóide em região dorsal.
Onze pacientes foram submetidos à biópsia tipo "punch" de tecido cutâneo e uma semana depois iniciaram a aplicação do citrato de tamoxifeno a 0,1%. Sete pacientes não foram submetidos à biopsia por se enquadrarem nos critérios de exclusão anteriormente expostos. Estes pacientes participaram da análise clínica e do registro fotográfico de suas cicatrizes. Seis pacientes que usaram o medicamento regularmente e realizaram a biópsia pré-tratamento, não aceitaram repetir o procedimento cirúrgico após o tratamento.
Parâmetros para análise histológica
Foram submetidos à análise histológica os seguintes aspectos das lesões cicatriciais: arquitetura da lesão, presença de fibras colágenas hialinas de padrão "queloideano", reação gigantocelular do tipo corpo estranho, reação inflamatória crônica linfomononuclear e aspecto da epiderme.
Análise estatística
As variáveis numéricas foram descritas como média e erro padrão. Quanto às variáveis categóricas, utilizou-se para sumarizá-las, frequências simples e relativas e intervalo de confiança para 95%, quando mais adequado. Utilizou-se o teste de Shapiro-Wilk para avaliar o pressuposto de normalidade. Para o teste de hipóteses relativas às variáveis categóricas para uma amostra, utilizou-se o teste binomial. A comparação entre os itens dos questionários e medidas no momento pré e pós-tratamento foi realizada mediante teste "t" de Student para amostras pareadas. O nível de confiança foi 0,05 para erro ? e poder de 0,80 e os testes assumidos como bicaudais. Utilizou-se para realizar os cálculos estatísticos o programa SPSS (Statistical Package for Social Sciences) versão 15.0.
RESULTADOS
Foram avaliados 18 indivíduos, sendo 14 mulheres e 4 homens, com idade média de 26,9 ± 16,9 anos (menor idade: 3 anos; maior: 67 anos). Dez (55,5%) pacientes eram de etnia branca, seis (33,3%) eram negros e dois (11,1%) pardos. O tempo de evolução das lesões, desde seu surgimento até o início do estudo foi, em média, de 3,6 anos (tempo mínimo de 1 ano e máximo de 20 anos), com desvio padrão (DP) de 4,78 e erro padrão de 1,13.
Quanto à realização de tratamentos anteriores, 10 (55,5%) pacientes relataram não terem sido submetidos a nenhum tratamento prévio, 2 (11,1%) relataram terem sido submetidos a procedimentos cirúrgicos excisionais exclusivamente, 2 (11,1%) referem ter usado corticóide tópico (dexametasona), 1 (5,5%) refere ter feito uso de malha compressiva e 3 (16,6%) afirmam terem sido submetidos a múltiplos tratamentos, incluindo betaterapia, laser e sessões de acetato de triancinolona injetável.
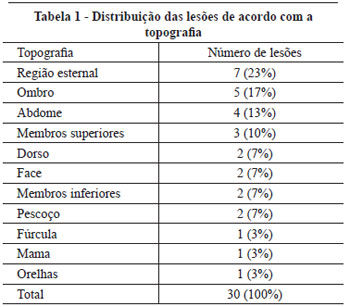
Doze (67%) pacientes apresentavam mais de uma lesão queloidiana ou de CHT, sendo o quelóide predominante, representando 72,2% das lesões. Quanto à etiologia, observamos que 16 (89%) pacientes apresentavam somente uma causa para sua(s) lesão(ões), enquanto 2 (11%) obtiveram lesões de etiologias diferentes. As etiologias e topografias das lesões estão referidas, respectivamente, na Figura 2 e na Tabela 1.
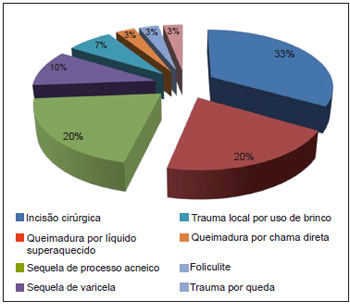
Figura 2 - Distribuição da casuística segundo etiologia das lesões, n=30.
Quanto às dimensões mensuradas das lesões, observou-se redução significativa (p = 0,009) no comprimento da lesão entre os períodos pré-tratamento (7,2 ± 1,1 cm) e pós-tratamento (6,6 ± 1,0 cm). A diferença média desses valores foi de 0,62 a 0,16 cm, com intervalo de confiança (IC) 95% de 0,27 a 0,97 cm. Verificou-se, também, redução significativa (p = 0,009) na largura da cicatriz entre os períodos pré-tratamento (2,3 ± 0,5 cm) e pós-tratamento (1,9 ± 0,4 cm). A diferença média encontrada foi de 0,37 a 0,12 cm, com IC 95% de 0,11 a 0,64 cm. Em relação à altura da cicatriz, também houve redução significativa (p < 0,0001), quando comparados os períodos pré e pós-tratamento (0,9 ± 0,27 cm e 0,67 ± 0,24 cm, respectivamente). A diferença média entre esses valores foi de 0,23 ± 0,04, com IC 95% de 0,15 a 0,32 cm.
Em relação às respostas dos questionários, observamos que a textura, a altura e o prurido foram as queixas mais predominantes, apresentando as maiores notas pré-tratamento. Houve queda progressiva das notas médias do critério textura, apresentando os valores de 8,6 ± 0,5 no 1° mês e 5,4 ± 0,5 no 6° mês (p < 0,001). A diferença média entre o 1° e o 6° mês foi de 3,2 ± 0,3 (IC 95% de 2,6 a 3,7). Em relação às notas atribuídas ao critério altura, a média da nota no 1° mês foi de 8,2 ± 0,5 e a média no 6° mês foi de 5,8 ± 0,6. Dessa forma, verificou-se redução significativa da nota (p < 0,01), sendo que diferença média entre a primeira e a última nota foi de 2,3 ± 0,2 (IC 95% de 1,8 a 2,8). Levando em consideração o critério prurido, observamos melhora significativa (p = 0,006) entre o 1° e o 2° mês, com médias respectivas de 7,5 ± 0,9 e 2.9 ± 0,8. A diferença média encontrada nesse caso foi de 2,1 ± 0,7 (IC 95% de 0,7 a 3,5). O critério prurido apresentou queda significativa nas duas primeiras semanas e manteve a regressão nos quatro meses seguintes, com certa estabilização posterior, ao contrário do critério textura, que apresentou declínio progressivo ao longo do tratamento (Figura 3).
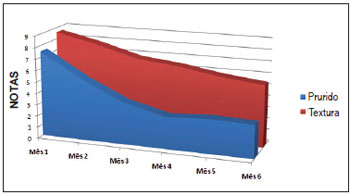
Figura 3 - Demonstração gráfica da evolução das notas médias dos critérios textura e prurido durante os seis meses de avaliação.
O critério desconforto também apresentou resultado estatisticamente significativo e revelou notas médias de 6,5 ± 0,9 no 1° mês e 4,1 ± 0,7 no 6° mês (p < 0,001), mostrando uma diferença média de 2,6 ± 0,6 (IC 95% de 1,1 a 3,6). Em relação ao critério dor, a média das notas no 1° mês foi de 2,9 ± 0,9 e no 6° mês, 1,7 ± 0,6 (p=0,02). A diferença média entre essas notas foi de 1,2 ± 0,5 (IC 95% de 0,25 a 2,2). A diferença entre as notas médias finais e iniciais de todos os parâmetros pode ser observada na Figura 4.
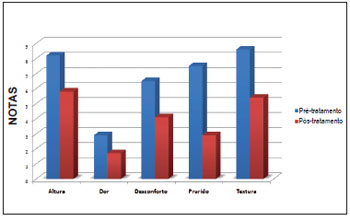
Figura 4 - Demonstração gráfica das notas médias, no período pré e pós-tratamento, dos parâmetros avaliados subjetivamente pelos pacientes.
Outro critério considerado na anamnese foi a mudança da coloração da pele da lesão queloidiana durante o tratamento. Treze pacientes apresentavam cicatriz hipercrômica e dois, coloração róseo-avermelhada. Observou-se o clareamento da cicatriz em 14 (77,8%) pacientes, dentre os quais 13 relataram que a coloração da lesão assemelhou-se ao tom da pele circunjacente. Apenas um paciente relatou escurecimento da cicatriz, atribuído, pelo próprio paciente, à exposição solar ocorrida na época.
Como efeito colateral, dois (11,2%) pacientes relataram ardência de leve intensidade, cerca de cinco minutos após a aplicação, com duração de 10 a 15 minutos, em média. Não foi observada recorrência do processo queloidiano ou de cicatrização hipertrófica em nenhum dos 18 casos analisados.
Em relação à qualidade de vida, 18 (100%) pacientes relataram algum tipo de melhora. Limitação funcional estava presente em seis (33,4%) pacientes, que apresentavam lesões de grandes dimensões em regiões articulares, os quais afirmaram ter adquirido maior amplitude de movimento após o tratamento (Figuras 5 a 8). Dezessete (94,5%) pacientes relataram ter melhorado sua auto-imagem e interação com a sociedade.
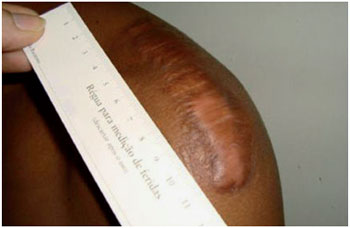
Figura 5 - E.M.S, 20 anos, portador de cicatriz hipertrófica em ombro esquerdo. Relatava dor e dificuldade de movimentação da articulação. Foto pré-tratamento.
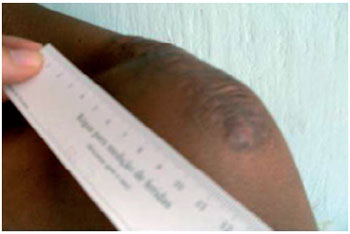
Figura 6 - E.M.S., após 6 meses de tratamento com citrato de tamoxifeno a 0,1%. Paciente relatou aumento da amplitude da movimentação em articulação de ombro e ausência de dor.
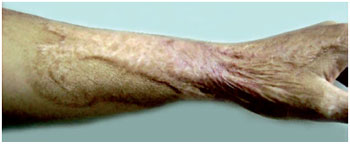
Figura 7 - A.S.S., 23 anos, vítima de queimadura por chama direta, portadora de cicatrizes hipertróficas em membro superior esquerdo, com limitação da amplitude de movimentos do punho. Foto pré-tratamento.
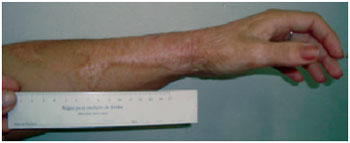
Figura 8 - A.S.S., após 6 meses de uso tópico de tamoxifeno. Observa-se acentuada redução do relevo cicatricial e coloração mais próxima ao tom de pele. Paciente refere maior amplitude dos movimentos do punho, associada à melhoria da textura e aumento da elasticidade cicatricial.
A análise histológica do grupo pré-tratamento confirmou o diagnóstico de quelóide e CHT em todos os casos analisados, com predomínio de um padrão arquitetural nodular (Figura 9). A presença de fibras hialinas de padrão queloidiano foi observada em quatro pacientes antes do tratamento. Destes, apenas dois pacientes realizaram a biópsia pós-tratamento e um permaneceu apresentando tais fibras. Este foi o único caso em que houve manutenção do padrão nodular dentre seis pacientes que realizaram a biópsia pós-tratamento, enquanto nos cinco restantes, observou-se a presença de feixes paralelos à epiderme (Figura 10).
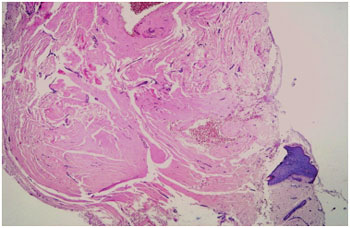
Figura 9 - Biópsia pré-tratamento. Pele com proliferação dérmica fibroblástica hialinizada, de aspecto nodular.
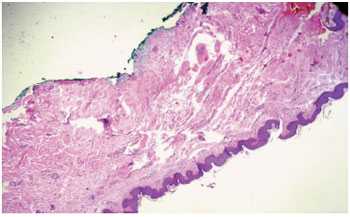
Figura 10 - Biópsia pós-tratamento do mesmo paciente da figura anterior. Ausência do padrão nodular e escasso tecido colágeno cicatricial residual, com fibras orientadas em sentido paralelo à epiderme.
Alterações histológicas na epiderme, tais como retificação dos cones epiteliais, acantose e hiperpigmentação melânica da camada basal, foram observadas antes e após o tratamento.
Reação gigantocelular do tipo corpo estranho foi observada em um paciente apenas na biópsia antes do tratamento. Reação inflamatória linfomononuclear dérmica foi constatada em seis pacientes. Todos estes realizaram biópsia pós-tratamento, revelando a ausência da inflamação em um paciente. Antes do tratamento, a distância entre a base da epiderme e a lesão dérmica variou de 0,2 a 0,9 mm, com média de 0,25 mm e DP de 0,29. Após o tratamento, essa distância variou de 0,3 a 1,0 mm, com média de 0,5 mm e DP de 0,35.
DISCUSSÃO
Quelóides e as CHT são lesões cicatriciais de etiopatogenia pouco conhecida e sem um padrão-ouro de tratamento. O tamoxifeno é uma substância que tem demonstrado importante ação contra os mecanismos anormais da formação da cicatriz, como diminuição das concentrações do TNF-?, inibição da proliferação de fibroblastos e decréscimo da produção de colágeno4,7,12-15,17.
Aspectos Clínicos
Clinicamente, observou-se a melhora em relação aos aspectos ectoscópicos de tamanho geral da lesão (altura, comprimento e largura) e a análise dos questionários refletiu a evolução favorável do tratamento, segundo a opinião dos pacientes, de acordo com os critérios de altura, dor, desconforto, prurido e textura. As notas iniciais elevadas para os critérios textura, altura e prurido revelam que esses são os itens que mais incomodam aos pacientes.
A redução importante do sintoma prurido, nas semanas iniciais do tratamento e na maioria dos pacientes, sugere ser um efeito do uso do medicamento. A estabilização deste sintoma após o quarto mês de tratamento, provavelmente, decorre da avaliação subjetiva desse critério. Destacamos, neste grupo, uma criança com escoriações cutâneas secundárias ao intenso prurido causado pela lesão e que evoluiu com a ausência deste sintoma após o início do tratamento.
O critério dor recebeu as notas iniciais mais baixas, sugerindo que este não é um sintoma relevante neste grupo. Dez pacientes atribuíram nota 0 para este critério, em todos os momentos da análise. Isso pode ser explicado, parcialmente, pelo tempo médio das lesões (3,6 anos), já que a dor, no quelóide, ocorre nos estágios iniciais da formação da cicatriz7.
O desconforto obteve notas altas nos pacientes cujas lesões localizavam-se em áreas funcionais ou bastante expostas, como a face. Neste grupo, identificamos um paciente com quelóide de grandes proporções na parte posterior do pescoço e dificuldade para extensão completa da cabeça e outro paciente com queimadura facial e retração cicatricial característica de queimaduras periorificiais.
Por meio da análise das medidas das cicatrizes, observamos que houve redução estatisticamente significativa, em particular nos casos CHT secundárias a queimaduras, com importante redução na altura. O processo ocorreu de forma centrípeta, ou seja, foi mais evidente nas bordas da lesão e pode ser decorrente da maior atividade metabólica e proliferativa observada nos fibroblastos da periferia das cicatrizes4.
O mesmo fenômeno não foi observado nas cicatrizes queloidianas. O centro do quelóide é bastante denso, com baixo metabolismo, poucos fibroblastos e muitas fibras colágenas hialinizadas. Como um dos principais mecanismos do tamoxifeno é a ação sobre citocinas produzidas por fibroblastos, a eficácia do medicamento é maior na CHT, onde há maior atividade proliferativa fibroblástica, e menor no quelóide, caracterizado por um núcleo denso de colágeno hipocelular11,18,19.
O clareamento foi observado em 93% dos casos que apresentavam alterações de pigmentação. Tanto as lesões que eram eritematosas ou róseas quanto as que eram hiperpigmentadas adquiriram coloração próxima à da pele sã do paciente. Apesar de não ter sido observada alteração histológica epidérmica significativa nas biópsias pós-tratamento, o clareamento macroscópico das lesões, observado ao exame clínico, pode refletir um efeito restaurador direito ou indireto do medicamento na quantidade de queratinócitos e melanócitos na epiderme.
O único efeito colateral relatado foi a ardência minutos após a aplicação, de duração efêmera. Não foram relatados efeitos sistêmicos que pudessem ser atribuídos ao medicamento. De fato, o uso tópico desta substância parece livre de complicações sistêmicas, uma vez que ocorre acúmulo da mesma apenas na pele e tecido adiposo subcutâneo, que funcionam como uma barreira, impedindo altas concentrações no plasma16.
Aspectos Histológicos
Dos seis pacientes submetidos ao tratamento que realizaram biópsia, foi observada alteração significativa em relação ao aspecto histológico inicial em quatro. Em dois pacientes, o padrão arquitetural nodular observado na biópsia inicial foi substituído por um padrão caracterizado por feixes paralelos ou feixes paralelos e perpendiculares, frouxos, com fibras delgadas. Em um outro paciente, fibras perpendiculares, porém sem aspecto nodular, foram substituídas por fibras com disposição paralela à epiderme. Dessa forma, a substituição do padrão nodular por fibras colágenas delgadas e paralelas à epiderme sugere remodelamento do colágeno e maturação da cicatriz por efeito do tratamento3,5,7,10.
A ação do tamoxifeno no remodelamento das lesões cicatriciais pode ser inferida também quando analisamos as distâncias entre a camada basal da epiderme e a lesão dérmica. No grupo pré-tratamento, a distância média epiderme-lesão foi de 0,25 mm e, no grupo pós-tratamento, foi de 5 mm. Estes dados sugerem que, no grupo pós-tratamento, as lesões dérmicas estão, em média, duas vezes mais distantes da epiderme do que no grupo inicial, o que pode indicar uma diminuição do volume cicatricial por efeito do tratamento.
As alterações observadas na epiderme no grupo pós-tratamento não foram diferentes do observado no grupo inicial, caracterizadas por retificação dos cones epiteliais da epiderme, hiperpigmentação da camada basal da epiderme e acantose com hiperqueratose. De forma semelhante, as alterações dérmicas, além das lesões cicatriciais, não foram diferentes nos grupos pré e pós-tratamento.
Os resultados obtidos no presente estudo corroboram estudos in vitro e a recente pesquisa brasileira in vivo de que o citrato de tamoxifeno a 0,1% tem a capacidade de influenciar mecanismos bioquímicos da cicatrização e, com isso, gerar consequências clínicas benéficas aos portadores de quelóides e CHT12,13,14,15,16.
CONCLUSÃO
O citrato de tamoxifeno a 0,1% apresentou uma evolução clínica positiva, mínimos efeitos colaterais e baixo custo para aplicação tópica, podendo ser uma alternativa de maior viabilidade econômica para pacientes com quelóides de grandes proporções e dificuldade de acesso a outras terapias. Apresenta uma aplicação atraumática, segura e cômoda, o que facilita bastante a adesão do paciente ao tratamento. As alterações histológicas sugerem uma ação de remodelamento do colágeno nessas cicatrizes patológicas, no sentido de maturação e retração das lesões.
São necessários novos estudos, com maior amostragem e melhor compreensão dos mecanismos de ação deste medicamento na patogênese dos processos cicatriciais, para obtenção de conclusões mais abrangentes.
REFERÊNCIAS
1. Wolfram D, Tzankov A, Pülzl P, Piza-Katzer H. Hypertrophic scars and keloids - a review of their pathophysiology, risk factors and therapeutic management. Dermatol Surg. 2009;35(2):171-81.
2. Butler PD, Longaker MT, Yang GP. Current Progress in Keloid Research and Treatment. J Am Coll Surg. 2008;206(4):731-41.
3. Robles DT, Moore E, Draznin M, Berg D. Keloids: pathophysiology and management. Dermatol Online J. 2007;13(3):9.
4. Aarabi S, Longaker MT, Gurtner GC. Hypertrophic scar formation following burns and trauma: new approaches to treatment. PLoS Med. 2007;4(9):e234.
5. Figueiredo JCA, De Oliveira Junior FC, Zampar AG, Mélega JM. Quelóide: fatores de influência prognóstica. Rev Bras Cir Plást. 2008;23(4):274-80.
6. Reis ALN. Principais características das cicatrizes queloidianas. An Bras Dermatol. 1994;69(6):495-7.
7. Mustoe TA, Cooter RD, Gold MH, Hobbs FD, Ramelet AA, Shakespeare PG, et al. International Advisory Panel on Scar Management. International clinical recommendations on scar management. Plast Reconstr Surg. 2002;110(2):560-71.
8. Butler PD, Ly DP, Longaker MT, Yang GP. Use of organotypic co-culture to study keloid biology. Am J Surg. 2008;195(2):144-148.
9. Wang Z, Fong KD, Phan TT, Lim IJ, Longaker MT, Yang GP. Increased transcriptional response to mechanical strain in keloid fibroblasts due to increased focal adhesion complex formation. J Cell Physiol. 2006;206(2):510-7.
10. Clark RA, McCoy GA, Folkvord JM, McPherson JM. TGF-beta 1 stimulates cultured human fibroblasts to proliferate and produce tissue-like fibroplasia: a fibronectin matrix-dependent event. J Cell Physiol. 1997;170(1):69-80.
11. Campaner AB, Ferreira LM, Gragnani A, Bruder JM, Cusick JL, Morgan JR. Upregulation of TGF-beta1 expression may be necessary but is not sufficient for excessive scarring. J Invest Dermatol. 2006;126(5):1168-76.
12. Ruiz RO, Mattar CA, Daguer EEZ, Macena CMG, Ávila DEP. Uso do tamoxifeno no tratamento de quelóides. Rev. Bras. Cir. Plást. 2005;20(4):225-30.
13. Hu D, Zhu X, Xu M, Chen B, Margaret AH, George WC. The inhibitory effect of tamoxifen on human dermal fibroblast-populated collagen lattices. Zhonghua Zheng Xing Wai Ke Za Zhi. 2002;18(3):160-2.
14. Chau D, Mancoll JS, Lee S, Zhao J, Phillips LG, Gittes GK, et al. Tamoxifen downregulates TGF-beta production in keloid fibroblasts. Ann Plast Surg. 1998;40(5):490-3.
15. Mikulec AA, Hanasono MM, Lum J, Kadleck JM, Kita M, Koch RJ. Effect of tamoxifen on transforming growth factor beta1 production by keloid and fetal fibroblasts. Arch Facial Plast Surg. 2001;3(2):111-4.
16. Hu D, Hughes MA, Cherry GW. Topical tamoxifen - a potential therapeutic regime in treating excessive dermal scarring? Br J Plast Surg. 1998;51(6):462-9.
17. Berman B, Viera MH, Amini S, Huo R, Jones IS. Prevention and management of hypertrophic scars and keloids after burns in children. J Craniofac Surg. 2008;19(4):989-1006.
18. Lu F, Gao J, Ogawa R, Hyakusoku H, Ou C. Biological differences between fibroblasts derived from peripheral and central areas of keloid tissues. Plast Reconstr Surg. 2007;120(3):625-30.
19. Al-Attar A, Mess S, Thomassen JM, Kauffman CL, Davison SP. Keloid pathogenesis and treatment. Plast Reconstr Surg. 2006;117(1):286-300.
1. Acadêmico de Medicina da Universidade Federal de Sergipe.
2. Cirurgiã Plástica; Membro Associado da Sociedade Brasileira de Cirurgia Plástica.
3. Doutor em Ciências Médicas pela Universidade Estadual de Campinas; Professor Adjunto da Universidade Federal de Sergipe; chefe do Serviço de Patologia da Universidade Federal de Sergipe.
Trabalho realizado na Universidade Federal de Sergipe, Hospital Universitário, Aracaju, SE.
Programa Institucional de Bolsas de Iniciação Científica (PIBIC/CNPq).
Correspondência para:
Aline Fioravanti Pasquetti
Rua Urquiza Leal, 129 - Bairro Salgado Filho
Aracaju, SE, Brasil - CEP: 49020-490
E-mail: alinefioravanti@yahoo.com.br
Artigo submetido no SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 1/3/2010
Artigo aceito: 22/3/2010


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter