

Original Article - Year 2010 - Volume 25 -
Costa Lima technique in mammary hypertrophy associated with inferior vascular pedicles
Técnica de Costa Lima nas hipertrofias mamárias associada ao retalho de pedículo vascular inferior
ABSTRACT
Introduction: Mammary hypertrophy is common cause of physical and emotional suffering among women. The Costa Lima technique endeavors to treat this abnormality and ease the rising of the mammary areole complex (MAC). Objective: To evaluate the effectiveness of the Costa Lima technique in mammary hypertrophy when there is difficulty with the ascension of the MAC. Methods: Between July 1998 and June 2009, were operated patients with II and III with BMI between 18.5 and 39.9, with an average distance between the point "A" of Pitanguy and the MAC between 6 and 19.5 centimeters. The Pitanguy marking system is used in this technique, amputating the mammary base, by which a trapezoidal sub-areole segment is removed from the superior pole which enjoins a thin areole dermalglandular shred which is easy to cranially mobilize. Results: The greatest incidence of hypertrophy was of third degree (50.85%), eutrophic (42.37%), mostly in the second decade (31.36%), with a 0.86% occurrence rate of deep venous thrombosis, under general anesthesia at 84.75%. The benefit was being able to shape conic breasts in harmony with the trunk, with not difficulties in raising the MAC, which showed partial necrosis in 3.39% of cases. Conclusion: The technique showed itself to be advantageous due to the easy mobilization of the MAC and could be applied in therapeutic surgery.
Keywords: Mammaplasty/methods. Breast/surgery.
RESUMO
Introdução: A hipertrofia mamária é causa comum de sofrimento físico e emocional das mulheres. A técnica de Costa Lima busca tratar esta anormalidade e facilitar a elevação do complexo aréolo-mamilar (CAM). Objetivos: Avaliar a efetividade da técnica de Costa Lima nas hipertrofias mamárias e gigantomastias quando existe dificuldade na ascensão do CAM. Método: Entre julho de 1998 e junho de 2009, foram operadas 118 pacientes com hipertrofias grau II e III, com IMC entre 18,5 e 39,9, com medida da distância entre o ponto "A" de Pitanguy e o CAM entre 6 e 19,5 cm. Nesta técnica é utilizada marcação de Pitanguy, amputando-se a base mamária, sendo retirado do pólo superior um segmento trapezoidal subareolar, que determina um retalho areolado dermoglandular fino, que é mobilizado cranialmente com facilidade. Resultados: A maior incidência de hipertrofias foi de 3º grau (50,85%), eutróficas (42,37%), predominante na segunda década (31,36%), com 0,85% de ocorrência de trombose venosa profunda, sob anestesia geral em 84,75%. O benefício foi conseguir mamas cônicas, em harmonia com o tronco, sem dificuldades em elevar o CAM, com observação de necrose parcial em 3,39% dos casos. Conclusão: A técnica mostrou-se vantajosa pela fácil mobilização do CAM, podendo ser aplicada na terapêutica cirúrgica.
Palavras-chave: Mamoplastia/métodos. Mama/cirurgia.
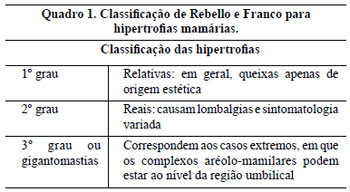
A paciente portadora de gigantomastia, quer seja associada ou não à ptose, além de ser considerada "inadequada" aos conceitos estéticos atuais1, apresenta sintomatologia diretamente relacionada ao tamanho e ao peso das mamas: dor no pescoço e ombros, que frequentemente se apresentam vincados pelas alças dos sutiãs; dor pré-menstrual; hipertrofia da musculatura do trapézio; cifose dorsal com lordose lombar compensatória; alterações tróficas da pele do sulco inframamário por maceração e alterações circulatórias veno-linfáticas causadas pela ptose.
Em vários trabalhos menciona-se Durstan2,3 como iniciador, em 1669, da primeira ressecção por gigantomastia; e a primeira descrição cirúrgica de uma redução mamária estética por hipertrofia se encontra no livro de Dieffenbach (1848), citado por Hinderer4. O pioneirismo de Morestin2-5, em 1903, quando descreveu a transposição aréolo-mamilar e a primeira transposição executada por Villandre3, em 1911, associados ao princípio conservador do anel dérmico periareolar (1930) de Schwarzmann citado por Ferreira et al.2, Hinderer4, entre outros, encorajam dezenas de técnicas de redução mamária (Pitanguy, 1959; Strömbeck, 1960; Skoog, 1963; Mckissock, 1972; Lerner, 1972; Weiner, 1973; Jurado e Goldwin, 1976; Robins, 1977)4 baseadas na manutenção de suporte vascular para o complexo aréolo-mamilar (CAM).
Devido à dificuldade em elevar o CAM nas grandes hipertrofias e gigantomastias, especialmente naquelas onde havia grande ptose, nas mamas com bases largas e naquelas cujo parênquima estava muito aderido à pele, Costa Lima, em 1973, desenvolveu uma técnica aplicada a quase 4 mil casos de hipertrofia mamária com ressecção glandular retro-areolar em forma trapezoidal, que define um retalho, dermoglandular maleável, de pouca espessura e que contém o CAM (Figura 1)6-9. A técnica pode ser empregada nas hipertrofias com ptose, sendo nestes casos mais fácil ainda a sua elevação.

Figura 1 - Publicação do trabalho do Prof. Costa Lima, 1980.
A esta técnica foi associado rotineiramente o retalho de base vascular inferior, o pedículo I descrito por Liacyr Ribeiro10, para manutenção do pólo superior mamário no pós-operatório tardio.
O objetivo deste trabalho foi avaliar a efetividade da técnica de Costa Lima no tratamento das hipertrofias mamárias e gigantomastias.
MÉTODO
Amostra
Estudo longitudinal, retrospectivo no qual foram envolvidas 118 pacientes do sexo feminino, que foram submetidas à redução de hipertrofia mamária pela técnica de Costa Lima, no período de julho de 1998 a junho de 2009.
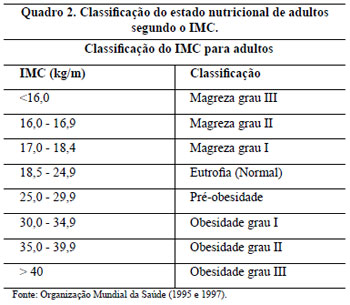
Os critérios de inclusão neste trabalho foram pacientes portadoras de hipertrofia graus 2 e 3 da classificação de Rebello e Franco, 19772-9 (Quadro 1), com medida da distância entre a projeção do sulco inframamário na linha médio-clavicular, o ponto "A" de Pitanguy, e o CAM entre 6 a 19,5 cm, com idades entre 16 e 64 anos e com o Índice de Massa Corporal (IMC)11 ou índice de Quetelet (Quadro 2) entre 18,5 e 39,9.
Os critérios de exclusão criados foram IMC superior a 39,9, portadoras de co-morbidades descompensadas: diabetes, hipertensão e doença pulmonar obstrutiva crônica (DPOC), uso prolongado de esteróides, portadoras de mamas com suspeita de malignidade e de fatores de alto risco para trombose venosa profunda / embolia pulmonar (TVP/EP).
Todas as pacientes foram submetidas à avaliação pré-operatória clínica laboratorial, avaliação cardiológica de risco cirúrgico, radiografia de tórax, espirometria e consulta com a equipe de Pneumologia em casos de DPOC, ultrassonografia mamária e mamografia de alta resolução para maiores de 40 anos12,13 e, quando houve indicação, foi realizada consulta com a equipe de Cirurgia Vascular para avaliação de critérios de risco para TVP/EP14,15.
Foi solicitada às pacientes que estavam em uso de contraceptivos ou em Terapia de Reposição Hormonal (TRH), a suspensão dos medicamentos por 1 mês. Todas assinaram o Termo de Consentimento Informado, bem como se submeteram à consulta pré-anestésica.
Procedimento
A anestesia geral foi utilizada em 100 pacientes e, em outras 18, foi utilizada a anestesia peridural torácica com sedação e o critério de utilização de uma ou de outra coube ao anestesiologista.
Foi utilizado como antibiótico profilático a cefazolina, na dose de 2 g na indução anestésica (cerca de meia hora antes da incisão), repetindo-se 1 g quatro horas após, mantendo-se a dose a cada 6 horas no pós-operatório até o momento da alta no 1o dia de pós-operatório14. A cefazolina foi substituída por ciprofloxacina 400 mg ou clindamicina 600 mg, quando houve relato de alergia à cefalosporinas.
Nas pacientes que apresentavam risco de TVP, conforme orientação da Cirurgia Vascular, foram utilizadas como profilaxia medidas mecânicas (meias elásticas e botas de compressão intermitente) associadas ou não à profilaxia medicamentosa (enoxaparina sódica).
Todas as pacientes foram mantidas com joelhos apoiados sob almofadas e suportes de silicone sob os calcanhares, evitando-se estiramentos e compressões dos feixes vásculo-nervosos, bem como realizado cateterismo vesical de demora com sonda de Folley no 12 por 24 horas. Foram colocadas em decúbito dorsal, em posição semi-sentada, com os braços abertos em cruz, acolchoados por almofadas, para evitar distensões do plexo braquial, e simétricos, para evitar desproporções do tronco.
Foi realizada a antissepsia com clorexidine® degermante a 2%, seguida por solução alcoólica de clorexidine® a 0,5%.
A marcação da pele seguiu a padronização de Pitanguy15-17 (Figura 2), acrescida da marcação do Pedículo I de Liacyr Ribeiro10 (Figura 3).
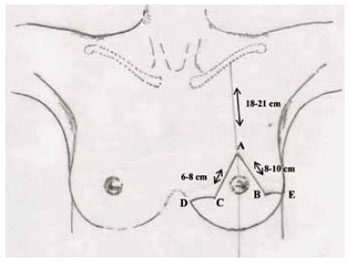
Figura 2 - Marcação clássica de Pitanguy.
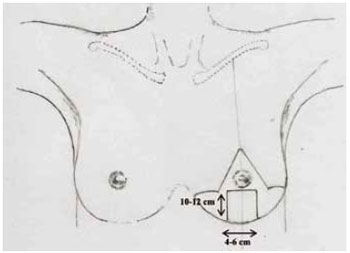
Figura 3 - Marcação do pedículo no 1 de Liacyr Ribeiro.
Foi realizada a marcação das incisões com azul de metileno, utilizando fios de nylon 00 na fúrcula esternal e no apêndice xifóide, para transposição das medidas para a mama contralateral:
1. Iniciou-se marcando a linha médio-clavicular que se continua atravessando o complexo aréolo-mamilar até alcançar o sulco inframamário;
2. Foi marcado o ponto A sobre a linha médio-clavicular mais baixo que a projeção do sulco inframamário, determinando a quantidade de tecido a ser retirado. A distância deste ponto à clavícula é de aproximadamente 18 a 21 cm;
3. Os pontos B e C encontrados por pinçamento bidigital vertical nas bordas medial e lateral do CAM, em uma linha imaginária a 1 cm da borda inferior da aréola, determinam o quanto se pode diminuir da largura do cone mamário;
4. A distância entre A-C foi marcada entre 6 a 8 cm e distância entre A-B de 8 a 10 cm, que podem variar em casos de mamas atípicas e assimétricas;
5. Foi localizado o ponto D, na extremidade interna do sulco inframamário;
6. Foi marcado o ponto E, na extremidade lateral do sulco inframamário;
7. As linhas B-E e C-D são curvas de concavidade para cima;
8. A marcação do CAM foi realizada utilizando-se o areolótomo de maior diâmetro (cerca de 4 cm) com estiramento moderado da pele;
9. Foi marcado também um retalho dérmico de pedículo inferior tipo I de Liacyr Ribeiro, com 4 a 6 cm de largura de base e com 10 a 12 cm de comprimento (Figuras 4 e 5).
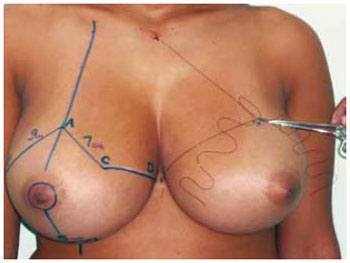
Figura 4 - Marcação clássica de Pitanguy, associada ao pedículo I de Liacyr Ribeiro.
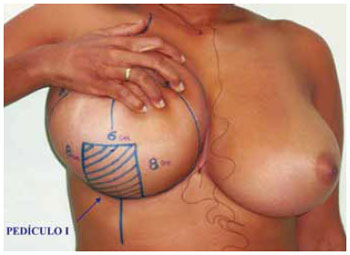
Figura 5 - Visualização da marcação do pedículo I.
Transoperatório
Iniciado o procedimento sob anestesia geral, com a marcação das incisões (Figuras 6 e 7).
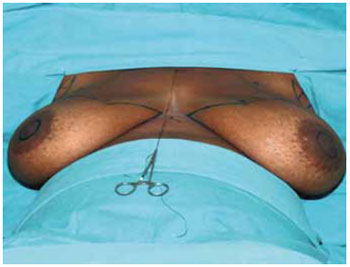
Figura 6 - Marcação de Pitanguy.
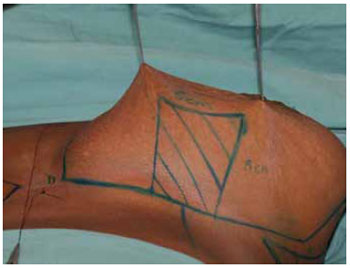
Figura 7 - Marcação do pedículo I de Liacyr Ribeiro.
Realizadas lipoaspiração do prolongamento axilar, com infiltração de soro fisiológico a 0,9% com adrenalina 1:500.000 UI (Figura 8) e a desepitelização periareolar a céu aberto do CAM e do retalho de pedículo inferior (Figura 9).
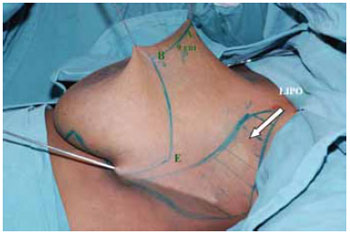
Figura 8 - Marcação completa das incisões e da lipoaspiração e a seta indica a área a ser lipoaspirada.
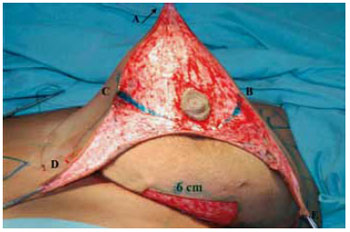
Figura 9 - Desepitelização periareolar e do retalho de pedículo inferior
Principiou-se a ressecção da porção glandular mediana por incisão horizontal a 1 cm da borda do CAM em secção plana e oblíqua para cima, bipartindo a mama atingindo a fáscia peitoral na altura do 2o espaço intercostal (Figura 10).
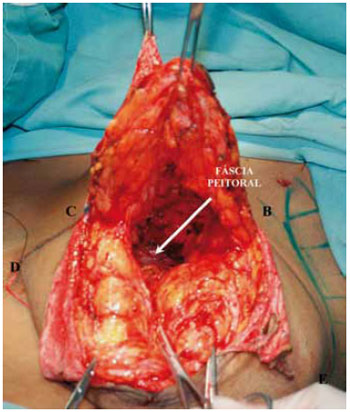
Figura 10 - Plano de dissecção da mama vista frontal. A seta indica a fáscia peitoral.
Complementou-se com as incisões das linhas medial C-D arqueada e biselada até encontrar novamente a fáscia e, a seguir, a incisão lateral B-E também arqueada e biselada, quando se buscou retirar o máximo possível de tecido desta área, inclusive do prolongamento axilar, quando não se utilizou a lipoaspiração. Esta ressecção também encontra a fáscia peitoral (Figuras 11 e 12).

Figura 11 - Descolamento medial.
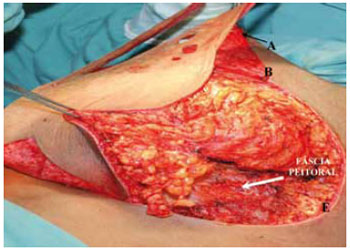
Figura 12 - Descolamento lateral.
Após hemostasia rigorosa, restou completar a bipartição mamária. O pólo inferior foi mantido intacto para ressecção do retalho dérmico no final do procedimento (Figuras 13 e 14).
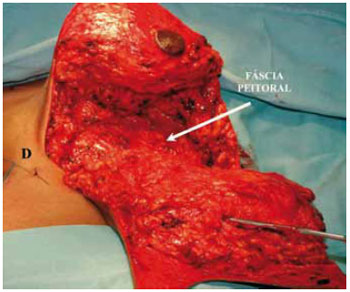
Figura 13 - Bipartição mamária completada.
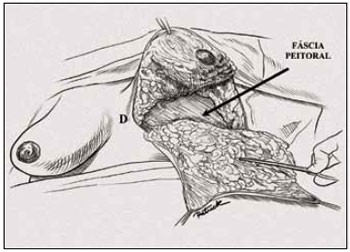
Figura 14 - Ilustração da bipartição mamária completada.
No pólo superior, marcou-se um triângulo de base superior (Figuras 15 e 16). Esse triângulo deu início à confecção de um sólido trapezoidal com sua base superior horizontal rente à região subareolar (Figuras 17 e 18).
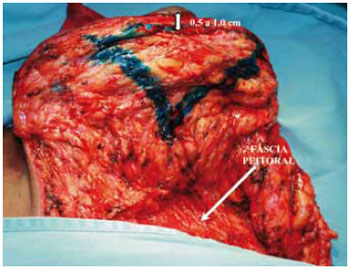
Figura 15 - Marcação da ressecção trapezoidal subareolar. A seta mostra a espessura do retalho.
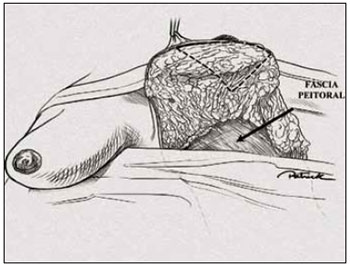
Figura 16 - Ilustração da marcação da ressecção trapezoidal subareolar
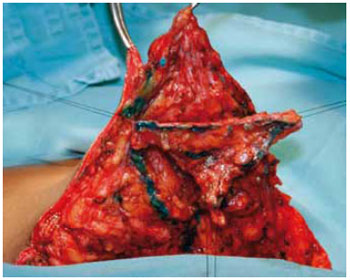
Figura 17 - Retirada do trapézio.
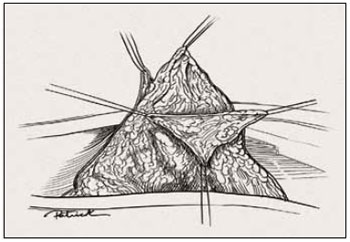
Figura 18 - Ilustração da retirada do trapézio.
A ressecção iniciada com bisturi, ao ultrapassar os ductos galactóforos, foi continuada por dissecção romba com manobra digital. Criou-se um espaço na forma da estrutura trapezoidal, que foi retirada e, ao mesmo tempo, duas colunas dermoglandulares laterais e simétricas (Figuras 19 e 20).
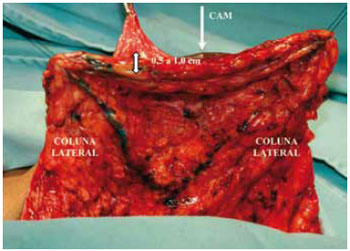
Figura 19 - Espessura do retalho dermoglandular, vista anterior
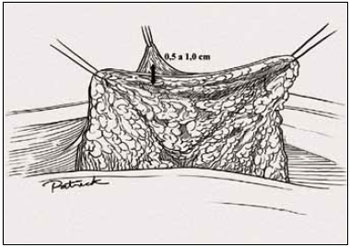
Figura 20 - Ilustração espessura do retalho dermoglandular, vista anterior
Foi mantida uma ponte dermoglandular maleável, com 0,5 a 1 cm de espessura (Figuras 21 a 23).
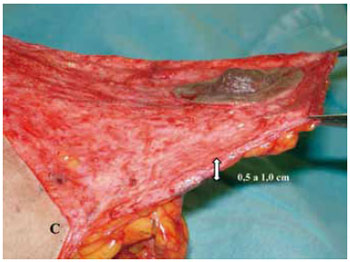
Figura 21 - Espessura do retalho dermoglandular, vista lateral.
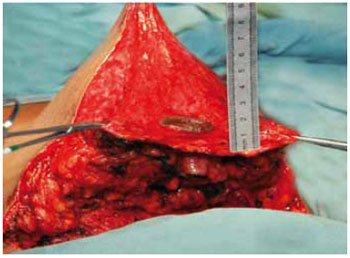
Figura 22 - Espessura do retalho dermoglandular, vista anterior
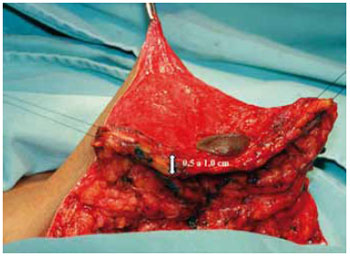
Figura 23 - Espessura do retalho dermoglandular, vista anterior.
Desta maneira, foi diminuída a altura da mama pela retirada da base, e a sua largura pela aproximação das colunas laterais (Figura 24). O CAM permaneceu neste retalho e pode ser fixado provisoriamente ao ponto A, sem qualquer tensão com 1 ponto de nylon 00 (Figuras 25 e 26).
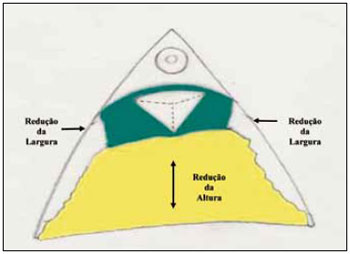
Figura 24 - Ilustração da redução do cone mamário em altura (amarelo) e em largura (verde).
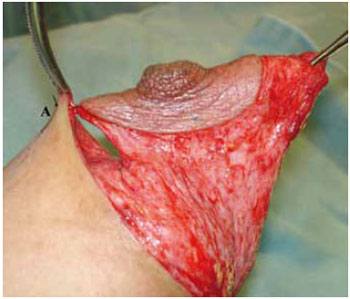
Figura 25 - Fixação provisória do CAM no ponto A, vista lateral.
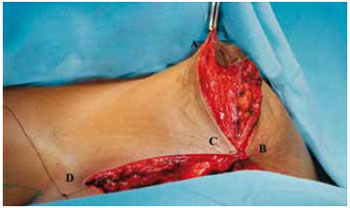
Figura 26 - Fixação provisória do CAM no ponto A, vista anterior.
A aproximação das colunas laterais com 2 ou 3 pontos de nylon 2-0 projetou o CAM e preencheu o espaço retroaréolo-mamilar (Figura 27). O pedículo I, com espessura de 2 a 3 cm, foi fixado por pontos de nylon 00 na altura do 2o espaço intercostal, incisando a derme inferiormente para não tracionar o sulco inframamário (Figura 28).
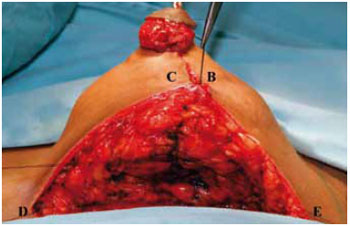
Figura 27 - Sutura das colunas laterais.
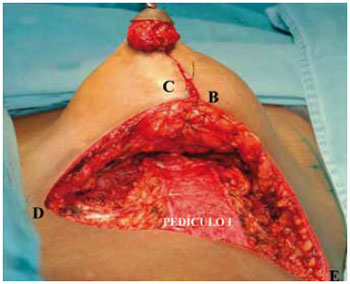
Figura 28 - Retalho de pedículo inferior nº 1 de Liacyr Ribeiro.
O retalho do CAM se mostrou delgado e maleável. O novo cone mamário foi fixado na intersecção da linha médio-clavicular com o sulco inframamário, pela união dos pontos C e B. A sutura de pele vertical a partir deste ponto foi feita com pontos absorvíveis de Monocryl® 4-0 subdérmico, separados com nós invertidos e 5-0 intradérmicos contínuos, medindo entre 4 e 5 cm. As suturas das incisões horizontais foram realizadas da mesma forma que a vertical (Figura 29).
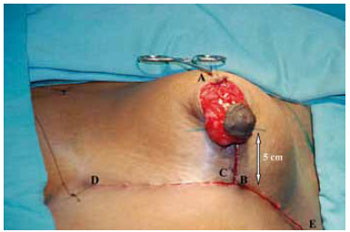
Figura 29 - Retalho do CAM liberado da sua fixação provisória e marcação da altura do pólo inferior.
Estando o CAM posicionado e livre de qualquer tensão, foi decorticada a área receptora da transposição com areolótomo de menor diâmetro, 2,5 ou 3 cm, este é suturado com pontos de Monocryl® 5-0 separados com nós invertido seguidos de sutura contínua intradérmica (Figuras 30 e 31).
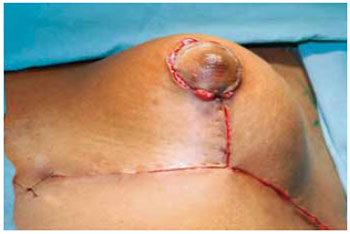
Figura 30 - Complexo aréolo-mamilar posicionado.
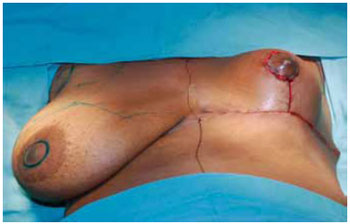
Figura 31 - Grau de ascensão do CAM obtido em relação à mama oposta.
Foi colocado dreno de sucção, mantido por 1 dia ou prolongado por mais 5 dias por ter sido realizada lipoaspiração complementar dos prolongamentos axilares. Foi feito suporte das cicatrizes com trama de Steri-Strips®, que foram cobertas com gazes e imobilizadas com Micropore®.
As pacientes permaneceram no Centro de Recuperação Pós-Anestésica entre 40 minutos e duas horas, a critério do anestesista, e receberam alta hospitalar após 12 horas, se realizado bloqueio peridural, ou após 24 horas, se anestesia geral.
Pós-Operatório
No momento da alta hospitalar, foi colocado o sutiã, usado por 3 meses, e as pacientes foram orientadas a dormir apenas em decúbito dorsal, não dirigir, não fazer exercícios físicos, nem se exporem ao sol neste período. Pediu-se, também, para que mantivessem os braços ao longo do corpo por um mês, evitando movimentos que necessitassem da musculatura peitoral, utilizando apenas os antebraços para suas necessidades diárias.
As pacientes retornaram a partir do 3o dia de pós-operatório para troca de curativos e retirada ou não do dreno, na dependência de sua vazão, e compareceram semanalmente para revisões até completar um mês de cirurgia. Como as suturas foram intradérmicas, estas foram mantidas sob trama de fita adesiva por um ou dois meses. A partir de então, as pacientes compareceram apenas mensalmente até o 6o mês, e receberam orientação para realização de massagens duas vezes ao dia com uma associação de silicone gel com óleo de rosa mosqueta C-Kaderm® ou apenas ácidos graxos essenciais Dersane®. Nesta época foram realizadas fotos pós-operatórias, ultrassonografias de controle e agendamento de reintervenções que se fizeram necessárias no transcorrer do pós-operatório.
RESULTADOS
Avaliação de Qualidade
Três observadores, membros titulares da Sociedade Brasileira de Cirurgia Plástica, avaliaram fotografias de pré e pós-operatório de 70 pacientes, estabelecendo escores, determinando a classificação de ruim, regular, bom e muito bom, para os critérios de forma, tamanho, simetria, ascensão do CAM e aspecto da cicatriz (Quadro 3).
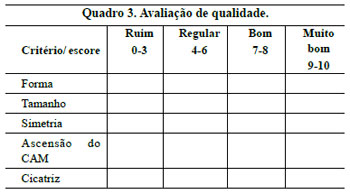
A avaliação dos observadores apurou os resultados demonstrados nas Figuras 32 a 34.
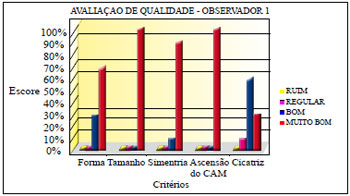
Figura 32 - Avaliação de qualidade do observador 1.
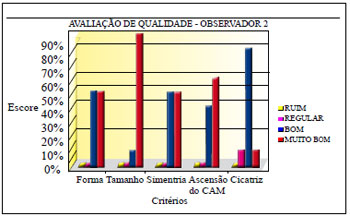
Figura 33 - Avaliação de qualidade do observador 2.
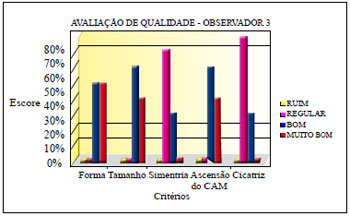
Figura 34 - Avaliação de qualidade do observador 3.
Os resultados são apresentados nas Tabelas 1 a 8 e nas Figuras 35 a 41.
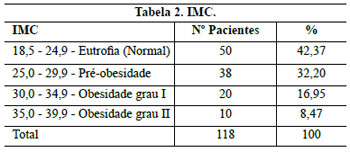
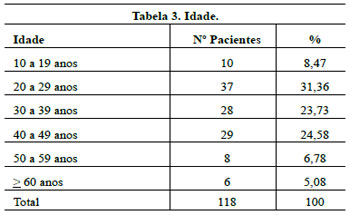
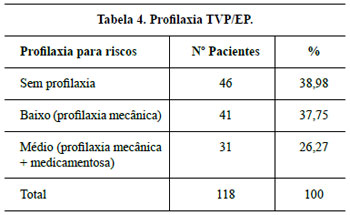
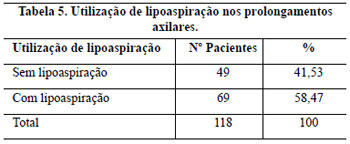
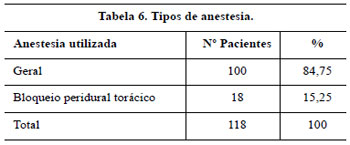
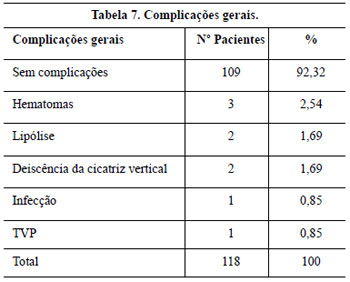
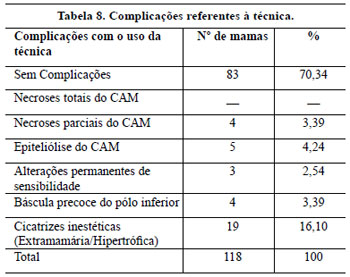
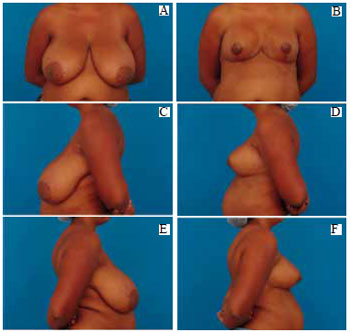
Figura 35 - A: Pré-operatório, vista anterior; B: Pós-operatório (21 dias), vista anterior; C: Pré-operatório, perfil esquerdo; D: Pós-operatório, perfil esquerdo; E: Pré-operatório, perfil direito; F: Pós-operatório, perfil direito.
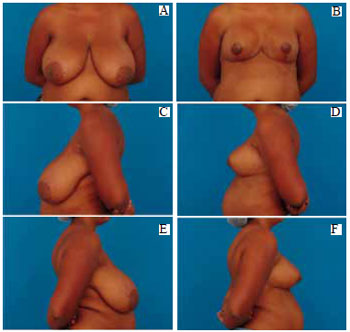
Figura 36 - A: Pré-operatório, vista anterior. B: Pós-operatório de 6 meses) vista anterior; C: Pré-operatório, perfil esquerdo; D: Pós-operatório, perfil esquerdo; E: Pré-operatório, perfil direito; F: Pós-operatório, perfil direito.
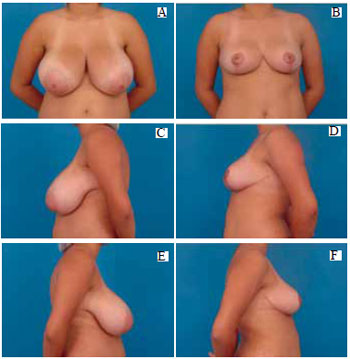
Figura 37 - A: Pré-operatório, vista anterior; B: Pós-operatório de 6 meses, vista anterior; C: Pré-operatório, perfil esquerdo; D: Pós-operatório, perfil esquerdo; E: Pré-operatório, perfil direito; F: Pós-operatório, perfil direito.
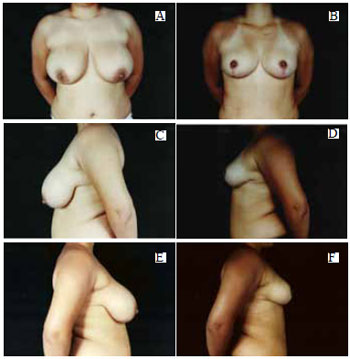
Figura 38 - A: Pré-operatório, vista anterior; B: Pós-operatório de 6 meses, vista anterior; C: Pré-operatório, perfil esquerdo; D: Pós-operatório, perfil esquerdo; E: Pré-operatório, perfil direito; F: Pós-operatório, perfil direito.
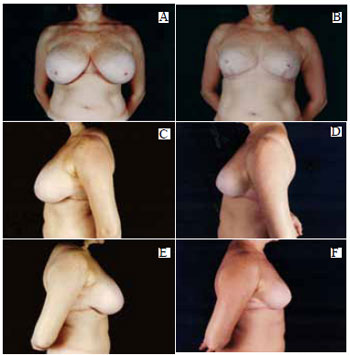
Figura 39 - A: Pré-operatório, vista anterior; B: Pós-operatório de 6 meses, vista anterior; C: Pré-operatório, perfil esquerdo; D: Pós-operatório, perfil esquerdo; E: Pré-operatório, perfil direito; F: Pós-operatório, perfil direito.
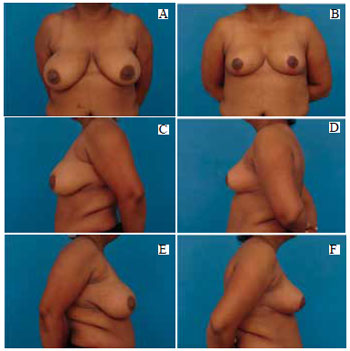
Figura 40 - A: Pré-operatório, vista anterior; B: Pós-operatório de 4 meses, vista anterior; C: Pré-operatório, perfil esquerdo; D: Pós-operatório, perfil esquerdo; E: Pré-operatório, perfil direito; F: Pós-operatório, perfil direito.
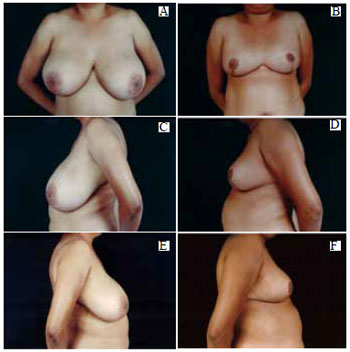
Figura 41 - A: Pré-operatório, vista anterior; B: Pós-operatório de 6 meses, vista anterior; C: Pré-operatório, perfil esquerdo; D: Pós-operatório, perfil esquerdo; E: Pré-operatório, perfil direito; F: Pós-operatório, perfil direito.
DISCUSSÃO
A seleção de pacientes teve um critério amplo para que se pudesse testar a versatilidade da técnica em mamas com bases estreitas e largas, com prolongamentos axilares e com ptoses com variações de distância entre o CAM e ponto A de Pitanguy de até 19,5 cm.
A faixa ampla de IMC que alcança inclusive as obesas de grau II teve como objetivo abranger mamas obesas, em razão da dificuldade que elas apresentam para elevar o CAM.
As pacientes tabagistas não foram excluídas para que se avaliasse a segurança do retalho, mesmo em tecidos mal perfundidos.
A grande variação de idades permitiu o acesso a um maior número de pacientes.
O principal objetivo da terapêutica profilática em pacientes com fatores de risco para TVP foi prevenir a trombogênese acarretada pela estase venosa que a imobilização prolongada que a mamaplastia determina. O aspecto silencioso da TVP e suas complicações é razão por si só da prevenção18,19.
A familiaridade com a marcação de Pitanguy foi o principal facilitador para a utilização da técnica.
O prolongamento axilar esteve presente nas pacientes com sobrepeso, obesidade e nas pós-menopausadas, especialmente se estiveram fazendo reposição hormonal. A utilização da lipoaspiração do prolongamento axilar em planos profundos e superficial é amplamente preconizada por alguns autores1, reduzindo a extensão da cicatriz, preservando vasos, nervos e parênquima mamário. Para Lejour20, confere um amolecimento da mama tornando-a mais fácil de modelar, sendo considerado particularmente útil quando o CAM é levantado em um pedículo longo. Considera, ainda, que a remoção de grandes lipodistrofias nos prolongamentos axilares diminui a tensão sobre as suturas. Para Souza Pinto et al.21, a lipoaspiração superficial determina retração da pele, comprovada pela sua análise histológica, que demonstra a reorganização em paralelo das fibras colágenas22 e as forças de tração resultantes têm direção ântero-posterior e delineiam o contorno mamário final.
A desepitelização a céu aberto foi realizada com a intenção de proteger a integridade do derma, mantendo o plexo circular subdérmico responsável pelo suprimento arterial do CAM17,23-26.
A retirada da base diminuiu a altura do cone mamário. Em casos onde houve necessidade de redução adicional deste cone, foi possível realizar nova amputação das bases das colunas laterais26. As ressecções nos prolongamentos laterais e mediais auxiliaram na redução da largura da mama. Todas foram de fácil execução, contudo, a ressecção do segmento trapezoidal sob o CAM necessitou de uma curva de aprendizado longa até que este retalho dermoglandular fosse executado o mais delgado possível, diminuindo a compressão vascular, com menor déficit de retorno, reduzindo assim o risco de necrose por estase venosa. Esta manobra facilitou sobremaneira a elevação do CAM, especialmente quando a distância marcada entre ele e o ponto A de Pitanguy foi longa.
A união das duas colunas laterais formou um pólo superior avantajado, ocupou o espaço esvaziado e projetou o CAM, evitando sua retração a planos profundos, o que se apresenta em 30% dos casos com a técnica de Strombeck e que, segundo Ramírez27, é um defeito daquela técnica.
A desepitelização do pólo superior para transposição do CAM com areolótomo menor do que o utilizado para incisão na pele da aréola foi realizada para que o excesso de pele na aréola promovesse uma sutura sem alterações da sua forma circular e sem alargamentos cicatriciais causados por tensão exagerada.
Para minimizar a queda progressiva do pólo superior, o auxílio do retalho dérmico de pedículo inferior tipo I de Liacyr Ribeiro10,28 permitiu o seu posicionamento a longo prazo, acomodando sobre ele uma mama leve e já modelada, que foi suturada sem a tensão causada pelo peso no sulco inframamário, evitando alargamentos cicatriciais.
A utilização do dreno de sucção além das 24 horas foi mantida nos casos onde a lipoaspiração se fez necessária.
Costa Lima creditou a Strömbeck29 a aplicação da manobra de Schwartmann à moderna mamaplastia. Strömbeck propôs um retalho dermoglandular bipediculado em alça de cesta e redução horizontal da glândula, conseguindo uma mama de forma aceitável, porém ainda com dificuldade técnica na ascensão do CAM, sendo às vezes necessário seccionar um dos pedículos, ou parcialmente os dois. Acreditava que as complicações vasculares do CAM, principalmente as necroses gordurosas, estavam mais relacionadas à obesidade exógena do que ao volume retirado. As cicatrizes, entretanto, eram extensas e ultrapassavam as extremidades medial e lateral. A técnica de Costa Lima não necessita da ressecção do cilindro glandular supra-aréolar, nem secção parcial do pedículo, o que a torna mais segura do ponto de vista vascular, além de não propiciar qualquer tipo de retração ao CAM. Contudo, não houve diferenças em relação a grandes cicatrizes.
A técnica de Skoog30 é essencialmente o procedimento de Strömbeck, tendo o pedículo medial seccionado, mantendo sua base lateral súpero-externa transportando o CAM num retalho exclusivamente dérmico ao seu sítio ideal por rotação. Silveira Neto também descreve retalho semelhante, porém com o pedículo lateral seccionado. Contudo, em ambas as técnicas maiores, torções determinam dificuldade de retorno venoso4, o que também é observado no retalho de Costa Lima quando este é deixado espesso. Skoog30 realiza uma ressecção em bloco e entre as complicações comuns a esta técnica informa importante báscula tardia, complicação não observada em nosso trabalho.
A técnica de McKissock31,32, indicada nas grandes hipertrofias associadas à ptose, trata-se de um retalho vertical, bipediculado superior e inferiormente, embora o aporte vascular para o CAM seja mais parenquimatoso que subdérmico, assegurado pelas perfurantes intercostais inferiores. As ressecções são mediais e laterais. No seu trabalho com 184 pacientes e 368 mamas, não refere necrose total de CAM, observando, porém, 1,4% de perda parcial, porcentual esse cerca de 58% menor do que obtivemos. Necroses de pele (0,81%), lipólises (1,62%) e hematomas (2,1%) têm incidências baixas, e infecção primária menor ainda (0,27%). Estes índices são semelhantes às duas técnicas. Apresenta índices de hipertrofia cicatricial em 65% das pacientes e báscula tardia em 50% delas, porcentagens maiores que as encontradas na técnica de Costa Lima.
Tendo como precursora a técnica de Kohn (1967), vários autores6 (Ribeiro, 1975; Jurado, 1973; Robbins, 1977; Courtiss, 1977; Reich, 1979 e Georgiade, 1979) executaram trabalhos caracterizados pela transposição do CAM por um retalho dermoglandular de pedículo inferior. Esta técnica vem apresentando cada vez mais adeptos pela segurança da vascularização e manutenção da sensibilidade do CAM, desde que se mantenha um retalho espesso e com base ampla. Jurado33 apresentou, em 1992, estudos estatísticos com 49,5% de complicações com o pedículo inferior no período de 1976 a 1980. Após modificações da técnica a partir de 1980, este índice foi apenas de 6%, enfatizando queixas em relação às cicatrizes.
Pitanguy15-17 pratica uma ressecção glandular em forma de quilha invertida na face posterior da mama, mantendo os pedículos mamários interno e externo, permitindo ressecções muito amplas. Seus estudos evidenciam porcentagens mínimas de complicações, entre elas: sofrimento areolar (1,2%), sofrimento cutâneo (3,6%), hematoma (0,5%), cicatriz inestética (1,4%), uma percentagem menor do que a obtida no nosso trabalho. Com exceção à técnica de Pitanguy, as complicações relacionadas à possibilidade de necrose parciais de porções inferiores da aréola, além de epidermólises parciais ou totais, foram semelhantes às outras técnicas descritas.
Costa Lima, baseado nos estudos de anatomia vascular de Salmon, relatou que, a partir de 1973, devido às dificuldades encontradas para elevar o CAM nas portadoras de grandes hipertrofias e gigantomastias, sobretudo em mamas mais ptosadas, nas mamas de bases largas e nas mamas glandulares, realizou grandes reduções com a ressecção da base mamária, diminuindo assim a altura, associando redução da largura pela retirada dos segmentos laterais e retroareolar, formando um pedículo dérmico de pouca espessura, maleável. Este pedículo eleva o CAM com sua vascularização garantida pelo plexo circular de largura de 2 a 5 cm formado por ramos da artéria mamária interna a partir do QSI e da artéria torácica lateral no QSE e ramos intercostais (70 a 74%), ou por suas variações: plexo em laço (20%) formado predominantemente pela artéria torácica lateral ou o plexo radiado (6%) quando não existe anastomose entre as artérias mamária interna e torácica lateral2,4,17,26, liberando-o com facilidade até seu novo ponto de implantação.
Em quatro pacientes, ocorreu necrose do pólo inferior do CAM (3,39%), que não coincidiu com o tabagismo e foi relacionada à presença de obesidade, o que dificultou a confecção de um pedículo mais fino, especialmente nos primeiros 20 procedimentos realizados, e que se iniciou com congestão e cianose que melhoram gradualmente até resultar em perda de 25 a 30% da semicircunferência do pólo inferior areolar em 1 mês, e após cicatrização por 2a intenção, a deformidade final não foi tão grave quanto inicialmente aparentou, sendo tratada por ressecção em cunha e sutura. Estes CAM se tornaram reduzidos em relação aos contralaterais.
Dos três (2,61%) casos de hematoma apresentados no trabalho, um foi espontâneo e os outros dois ocorreram no grupo das pacientes que fizeram profilaxia medicamentosa. Apresentaram-se no 1o dia de pós-operatório e foram solucionados por drenagem através da abertura de 1 ou 2 pontos de sutura.
As duas (1,69%) deiscências parciais com epidermólise e necrose de pele ocorreram em decorrência de tensão acentuada na linha de sutura, decorrente da retirada cutânea excessiva, sendo que uma delas teve relação com o uso profilaxia por radioterapia para prevenção de quelóides.
Embora não haja consenso na eficácia da profilaxia antibiótica na Cirurgia Plástica34,35, esta foi realizada e o índice de infecção neste trabalho foi de (0,85%).
Os dois casos de lipólise (1,69%), apesar de unilateral, não levaram à assimetria evidente no pós-operatório tardio.
Neste trabalho, o volume das mamas operadas não permitiu que fossem alcançadas cicatrizes reduzidas, objetivo de vários autores1,26,36-40, e em alguns casos, mesmo com o auxílio da lipoaspiração, elas ultrapassaram a linha axilar anterior.
REFERÊNCIAS
1. Levy S, Pereira LHB, Pitombo V. Mammaplasty and scars reduction. Rev Bras Cir. 1992;82(2):53-57.
2. Ferreira LM, Castilho HT, Duarte IS, Andrews JM. Cirurgia estética. In: Ferreira LM, editor. Manual de cirurgia plástica. São Paulo: Atheneu; 1995.p.287-91.
3. Avelar JM, Gameiro CA. Nuevos conceptos en la mastoplastia. In: Avelar JM, Malbec EF, editores. Historia, ciência y arte em cirurgia estética. São Paulo: Editora Hipócrates; 1990.p.550-9.
4. Hinderer UT. Plastias mamarias de reducción. Principios básicos. Tecnicas personales. In: Coiffman F, editor. Cirurgia plástica, reconstructiva y estética. 2ªed. Barcelona: Nasson-Salvat; 1994.p.3350-85.
5. Roa TTR. Mamas: conceptos generales. In: Coiffman F, editor. Cirurgia plástica, reconstructiva y estética. 2ª ed. Barcelona: Masson-Salvat; 1994.p.3291-3.
6. Cunha FI, Carpaneda CA, Pimenta C, Massid R, Matos W, Gama LHP. Mastoplastias: uso do retalho mamário posterior. In: Tournieux AAB, Curi M, editores. Atualização em cirurgia plástica-SBCP. São Paulo: Robe Editorial; 1996.p.325-30.
7. Lima JC. Breast reduction: new method and refinements. In: Ely JF, editor. Transactions of the VII Cong. IPRS-1979. Rio de Janeiro: Cartgraf; 1980.p.518-21.
8. Lima JC. Grandes reduções mamárias: técnica pessoal. In: Tournieux AAB, Curi M, editores. Atualização em cirurgia plástica-SBCP. São Paulo: Robe Editorial; 1996.p.301-9.
9. Franco T. Cirurgia estética da mama. In: Franco T, Franco D, Gonçalves LFF, editores. Princípios de cirurgia plástica. São Paulo: Atheneu; 2002.p.671-97.
10. Ribeiro L. Pedículo I. In: Pedículos em mamoplastia: atlas e texto. Rio de Janeiro: Medsi/Guanabara Koogan; 2005.p.21-48.
11. Organização Mundial de Saúde. In: Obesity: preventing and managing the global epidemic. Genebra:Organização Mundial de Saúde; 1997.
12. Nahas FX, Farah AB, Solia D. Suspicious node found at the time of reduction mammaplasty. Aesthetic Plast Surg. 2002;26(1):54-6
13. Bittencourt RC, Jeziorowski A, Kaimoto CL, Mima WH, Saciloto A, Schultz JIF, et al. Achados histológicos em mamaplastia redutora. Arq Catarin Med. 2007;36(supl.1):59-60.
14. Lima Júnior EM, Furtado IR, Nogueira CH. Cirurgia plástica após gastroplastia redutora: planejamento das cirurgias e técnicas. Rev Soc Bras Cir Plást. 2004;19(2):29-40.
15. Pitanguy I. Breast reduction mammoplasty: surgical technique. In: Pitanguy I. editor. Aesthetic plastic surgery of head and body. Berlin: Spring-Verlag; 1981.p.8-11.
16. Pitanguy I. Tratamiento de las anomalias de la glándula mamaria: tecnicas personales. In: Coiffmann F, editor. Cirurgia plastica reconstructiva y estética. 2ªed. Barcelona: Masson-Salvat; 1994.p.3327-43.
17. Pitanguy I. Breast hypertrophy: contribution to its treatment. Rev Lat Am Cir Plast. 1963;7(3):142-64.
18. Marchi C, Schlup IB, Lima CA, Schlup HA. Avaliação da profilaxia da trombose venosa profunda em um Hospital Geral. J Vasc Bras. 2005;4(2):171-5.
19. Maffei FH, Falleiros AT, Venezian CA, de Franco MF. Incidence and pathological anatomy of pulmonary thromboembolism in autopsies (author's transl). AMB Rev Assoc Med Bras. 1980;26(1):7-10.
20. Lejour M. Mamaplastia vertical para redução mamária e mastopexia. In:Ribeiro RC, Saltz R, editores. Cirurgia da mama estética e reconstrutiva. Rio de Janeiro: Revinter; 2001.p.271-7.
21. Souza Pinto EB, Erazo PJ, Abdalla PCSP et al. Mamaplastia redutora: evolução da técnica pessoal. In: Ribeiro RC, Saltz R, editores. Cirurgia da mama estética e reconstrutiva. Rio de Janeiro: Revinter; 2001.p.241-58.
22. Matsudo PKR. Estudo bioquímico do colágeno. Histórico. Fontes de Origem. In: Anais do Simpósio de Contorno Corporal/BR/Soc. Bras. Cir. Plast,1983.p.92-4.
23. Maliniac J. Arterial blood supply of the breast. Arch Surg. 1943;7:329.
24. Rohen W, Yokochi C. Anatomia humana: atlas fotográfico de anatomia humana sistêmica e regional. Vol. 1. São Paulo: Manole; 1987.p.165-7.
25. Gilles H, McIndoe A. The technique of mammaplasty in conditions of hypertrophy of the breast. Surg Ginec Obst. 1939;68:658-65.
26. Almeida AR. Short-scar reduction mammaplasty. Plast Reconstr Surg. 1991;88(6):1112.
27. Ramirez MA. Mamoplastia reductora por colgajo bipediculado ¾ vertical. In: Coiffman F, editor. Cirurgia plastica, reconstructiva y estética. 2a ed. Barcelona: Masson-Salvat; 1994.p.3396-9.
28. Ribeiro L. Redução mamária. In: Ribeiro L, editor. Cirurgia plástica da mama. Rio de Janeiro: Medsi; 1989.p.185-94.
29. Strombeck JO. Mammaplasty: report of a new technique base don two-pedicle procedure. Br J Plast Surg. 1960;13:79-90.
30. Skoog T. A technique for breast reduction: transposition of the nipple on a cutaneous vascular pedicle. Acta Chir Scand. 1963;126:453-65.
31. McKissock PK. Reduction mammaplasty with a vertical dermal flap. Plast Reconstr Surg. 1972;49(3):245-52.
32. McKissock PK. Reduction mammoplasty and correction of ptosis of the breast. In: Grabb WC, Smith JW, editores. Plastic surgery. Boston: Little, Brown and Company; 1997.p.737-59.
33. Jurado J. Complicações em mamoplastias. In: Tournieux AAB, Curi MM, editores. Atualização em cirurgia plástica-SBCP. São Paulo: Robe Editorial; 1996.p.331-4.
34. Serletti JM, Davenport MS, Herrera HR, Caldwell EH. Efficacy of prophylactic antibiotics in reduction mammoplasty. Ann Plast Surg. 1994;33(5):476-80.
35. Baran CN, Sensöz O, Ulusoy MG. Prophylactics antibiotics in plastic and reconstructive surgery. Plast Reconstr Surg. 1999;103(6):1561-6.
36. Horta de Almeida AR. Mamaplastia com cicatriz lateral, utilizando molde para marcação prévia. Rev Bras Cir. 1991:53-7.
37. Hakme F, Gomes Filho BS, Muller PM, Sjostedt C. Técnica em "L" nas ptoses mamárias com confecção de retalhos cruzados. Rev Bras Cir. 1983;73(2):87-91.
38. Arie G. Una nueva técnica de mastoplastia. Rev Lat Am Cir Plast. 1957;3:22-8.
39. Castro CC, Salema R, Aboudib Jr JH, Calixto CA. Mamaplastia redutora na mulher jovem: análise evolutiva a longo prazo. J Bras Ginecol. 1986;96(9):471-3.
40. Ferreira LM, Freire M, Garcia EB, Sabino Neto M. Mastoplastia redutora. In: Ferreira LM, Shor N, editores. Guia de medicina ambulatorial e hospitalar - UNIFESP - Cirurgia Plástica. São Paulo: Manole; 2007.p.545-51.
1. Cirurgião plástico. Membro titular da Sociedade Brasileira de Cirurgia Plástica.
Trabalho realizado no Hospital Santo Amaro
Fundação José Silveira, Salvador, BA.
Trabalho recebeu menção honrosa do Prêmio Nemer Chidid / Allergan 2009.
Correspondência para:
Ana Carolina Guimarães Rocha
Av. Prof. Magalhães Neto,1541 - sala 8023/8024 - Pituba
Salvador, BA - CEP 41810-012
E-mail: accplastica@gmail.com
Artigo recebido: 27/11/2009
Artigo aceito: 19/1/2010


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter