

Original Article - Year 2007 - Volume 22 -
Histopathologic study of the use of topical heparin in scalded rats burns
ESTUDO HISTOPATOLÓGICO DO USO DE HEPARINA TÓPICA EM QUEIMADURAS POR ESCALDO EM RATOS*
ABSTRACT
Background: Burn studies and non-burn studies using parenteral heparin uncovered heparin effects which were antiinflammatory, neoangiogenic, epithelializing, collagen-regulating, and, in addition to anticoagulating. Use of heparin in burned patients, relieved pain, limited inflammation, resulted in a better evolution and skin results. This present study intend to evaluate these properties through seriated histopathologic analisys of skin treated with topical heparin only. Method: 20 rats with 2nd degree burn scalded by water at 99ºC in the back. Divided into two groups: 1) treated with topical heparin; and 2) treated with 0.9 saline solution. It was utilized diary one topical throw of heparin spray, that have 0.14ml or 1,400 UI. The rats were sacrificed through 2-3 days, and the burned skin sent to histopathologic study. The cross sections were eveluated by a pathologist that did not know which one was from group 1 ou group 2. Results: Heparin group revealed less acute (neutrophil count) and chronical (lymphocyte count) inflamatory process, more intense angiogenesis and less fibroblastic proliferation (measured the thickness from the dermal-epidermal junction) in comparison to the control group with 0.9 saline solution. Conclusion: The use of topical heparin alone improved the treatment of partial-thickness burns, resulted in less inflammatory process (acute and chronic), more neoangiogenesis, and less thick fibroblastic proliferation compared to similar burns treated with saline.
Keywords: Burns. Heparin, administração & dosagem. Rats
RESUMO
Introdução: Muitos estudos com uso da heparina parenteral, entre eles em queimados, demonstraram seus efeitos antiinflamatórios, angiogênico, estimulante de epitelização, modulador de colágeno, sem contar o anticoagulante. Nos queimados, aliviou a dor, limitou a inflamação, melhorando a evolução e o resultado da pele pós-queimadura. Este trabalho visa avaliar estas propriedades por meio de análise histopatológica seriada da pele tratada com heparina apenas por via tópica. Método: Foram avaliados 20 ratos submetidos à queimadura de 2º grau por escaldo com água aquecida a 99ºC no dorso. Divididos em dois grupos: 1) 10 tratados com heparina; e 2) 10 tratados com SF 0,9%. Foi utilizado um jato tópico diário de heparina sódica spray, que apresenta 0,14 ml ou 1.400 UI. Os animais foram sacrificados a cada 2-3 dias e enviada peça da área queimada para estudo histopatológico. As lâminas foram avaliadas por um patologista que desconhecia a qual grupo (1 ou 2) pertencia o corte. Resultados: O grupo 1 (com heparina) apresentou menor processo inflamatório agudo (contagem de neutrófilos) e crônico (contagem de linfócitos), angiogênese mais intensa e menor proliferação fibroblástica (medida espessura a partir da transição derme-epiderme) em relação ao grupo controle com SF 0,9%. Conclusão: A heparina sódica, em seu uso tópico isolado, melhorou o tratamento das queimaduras de acometimento parcial da pele, uma vez que diminuiu o processo inflamatório e a proliferação fibroblástica, com melhor resultado final.
Palavras-chave: Queimaduras. Heparina, administração & dosagem. Ratos
A queimadura é sabidamente um grande problema público de saúde; muito freqüente e de caráter oneroso ao sistema de saúde, uma vez que demanda internações prolongadas, múltiplos procedimentos cirúrgicos e curativos, requerendo equipe multidisciplinar altamente especializada nos casos mais complexos. A queimadura produz dano imediato e irreparável a algumas células; a lesão se estende devido a eventos trombóticos e inflamatórios adjacentes. Por isso, a cura ocorre lentamente e, com freqüência, deixa cicatrizes e contraturas. Inúmeras são as pesquisas já realizadas, tanto no âmbito cirúrgico, como clínico, para obter melhora da evolução e do tratamento, entre elas, o uso da heparina sódica.
A heparina é um glicosaminoglicano encontrado nas granulações secretoras dos mastócitos, sintetizado a partir do ácido D-glicurônico e N-acetil-D-glicosamina, formando polímeros com 100 a 150 dissacarídeos. Cerca de 15 destes se agregam a um núcleo protéico formando uma glicoproteína. Nos mastócitos, esta é quebrada e produz fragmentos polissacarídicos com 20 dissacarídeos; estes são estocados e liberados junto com a histamina1.
A fisiopatologia da queimadura é traduzida, basicamente, no aumento da permeabilidade e edema. Ocorre exposição do colágeno, com conseqüente ativação e liberação de histamina pelos mastócitos, aumentando a permeabilidade vascular, levando ao edema e à hipovolemia. Ocorre, ainda, a ativação da via calicreína (liberando prostaglandinas) e do tromboxane. O Fator de Necrose Tumoral (TNF), por meio da indução de inflamação, aumenta a permeabilidade capilar e migração de leucócitos. Estes eventos são inibidos pela heparina2,3.
A literatura revela inúmeros trabalhos de acompanhamento clínico de pacientes queimados tratados com heparina sódica tópica, apresentando melhores resultados4-6. Outros estudos demonstraram com critérios histológicos os efeitos da heparina no modelo de ratos, porém com o uso parenteral7. O objetivo deste trabalho é observar e descrever as diferenças histopatológicas de evolução do tratamento da queimadura de segundo grau, com o uso isolado de heparina tópica, em comparação com o método tradicional (solução fisiológica 0,9%).
MÉTODO
A proposta dos autores foi o uso de água aquecida (em ebulição), por ser um agente etiológico importante nas estatísticas de queimadura por escaldo, além de apresentar-se como um material de baixo custo e de fácil manuseio7-9. O método de queimadura foi o derrame do líquido sobre o animal, simulando um acidente real por escaldo, como ocorre com humanos.
O fármaco em estudo utilizado foi a heparina sódica, em sua apresentação em spray para uso tópico, veiculada em solução composta por álcool benzílico, cloreto de sódio, polioxietilenoglicol 35, ácido clorídrico, hidróxido de sódio e água destilada; à concentração de 10.000 UI por mililitro (10.000 UI/ml), com um jato equivale a 0,14 ml, ou seja, 1.400 UI.
Para a preparação do líquido de escaldo foram utilizados água destilada, um erlenmayer, uma manta térmica elétrica e um termômetro de laboratório. A água foi aquecida a aproximadamente 99ºC, temperatura esta onde iniciou processo de ebulição no sítio do experimento. Para não haver perda substancial de temperatura que interferisse na metodologia, optou-se por derramar o líquido sobre a cobaia a partir do erlenmayer que se apresentava em aquecimento na manta térmica, ou seja, sem haver transferência de recipientes. Utilizado cerca de 20ml de água destilada a 99ºC em cada animal.
O presente trabalho foi aprovado pelo Comitê de Ética em Pesquisa do Centro de Ciências Médicas e Biológicas da Pontifícia Universidade Católica de São Paulo, para isso foi elaborado um protocolo rigoroso de manuseio dos animais, seguindo as normas preestabelecidas pelo Colégio Brasileiro de Experimentação Animal (COBEA) e o "Guide for the Care and Use of Laboratory Animals". O animal utilizado foi o rato Wistar (Rattus norvegicus albinus) adulto, por ser o mais freqüentemente utilizado, em virtude da facilidade de obtenção, baixo custo de manutenção e alta resistência à infecção. Cada animal foi submetido a anestesia e bloqueio neuromuscular prévio à depilação e à execução da queimadura.
Os fármacos utilizados foram o cloridrato de ketamina (anestésico geral), na dose de 100 mg/kg, e o cloridrato de xylazina (relaxante muscular), na dose de 6 mg/kg. A via de administração foi intramuscular. Em alguns animais, teve que ser administrada empiricamente uma dose um pouco maior, conforme a individualidade no efeito e na metabolização das drogas.
Com os ratos anestesiados, procedia-se à depilação de uma janela de aproximadamente 3 cm x 3 cm, no dorso. Esta foi realizada por meio de tração direta dos pêlos, sem uso de qualquer material de tricotomia para não provocar lesão nas camadas mais externas da epiderme. Cada animal foi, então, submetido a escaldo de 20ml de água fervente (99ºC), na região previamente depilada (dorso). Após a queimadura, cada animal foi alojado em gaiola individual, com água e ração à vontade, e mantido em ambiente adequadamente iluminado, fresco e ventilado em biotério.
Os ratos, no total de 20 (vinte), foram divididos em dois grupos: 10 (dez) formaram o grupo de animais tratados com heparina sódica tópica (grupo 1) e os outros 10 (dez) perfizeram o grupo tratado com soro fisiológico 0,9% (grupo 2), constituindo este o grupo controle. O início do tratamento foi 30 (trinta) minutos após a queimadura. Os animais do grupo 1 foram tratados com um jato tópico diário de heparina sódica e os do grupo 2 com soro fisiológico 0,9%, também uma vez ao dia. Os ratos foram sacrificados em série aos pares (um de cada grupo), conforme tempo de evolução, e a pele da área queimada retirada e encaminhada para análise histopatológica. Considerando como o dia da queimadura o dia 0 (zero), os ratos foram sacrificados nos dias 2, 4, 6, 9, 12, 15, 18, 21, 24, 27. O método de sacrifício dos ratos foi por meio de injeção intramuscular de ketamina em dose letal.
A análise histopatológica das peças foi feita por um médico patologista que desconhecia de qual grupo provinha o corte, se do grupo 1 ou do grupo 2, tendo acesso apenas à informação do tempo de evolução da queimadura. Os critérios de avaliação foram: extensão da área de necrose (em milímetros), infiltrado inflamatório agudo, infiltrado inflamatório crônico, neoformação vascular, proliferação fibroblástica e profundidade da cicatriz. Como a apresentação histológica da queimadura não é regular, cada lâmina foi avaliada pela média de cinco pontos distintos, para se obter o veredicto final de cada uma das mesmas.
RESULTADOS
Foi evidenciado, em todas as lâminas, que as queimaduras foram de segundo grau, com variação de profundidade da necrose entre 0,20mm a 0,35mm a partir da superfície. Os resultados da pesquisa estão descritos, individualizados, na Tabela 1.
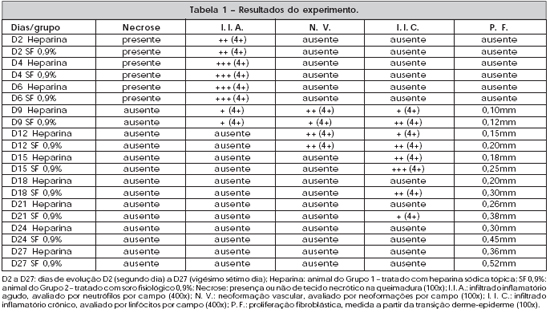
O infiltrado inflamatório agudo do Grupo 2 mostrou-se, no 6º dia, tomando toda a área de necrose; enquanto no Grupo 1 apresentou-se em posição mais basal, como ilustram as Figuras 1 e 2.
Figura 1 - 6º dia com SF 0,9% (aumento de 100x). Neutrófilos ocupando toda área de necrose.
Figura 2 - 6º dia com heparina (aumento de 100x). Neutrófilos iniciando a ocupação da área de necrose.
O processo de angiogênese foi maior no Grupo 1 (Figuras 3 e 4). A reação inflamatória crônica foi menor no Grupo 1 em relação ao controle (Figuras 5 e 6).
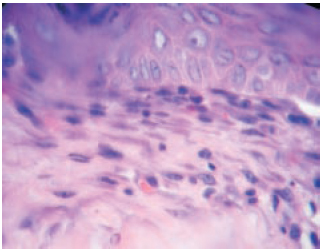
Figura 3 - 9º dia com SF 0,9% (aumento de 400x). Há cerca de 2 a 3 novos vasos (angiogênese) por campo.
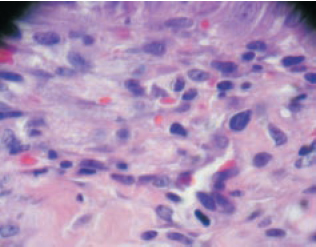
Figura 4 - 9º dia com heparina (aumento de 400x). Há cerca de 5 a 7 novos vasos (angiogênese) por campo.
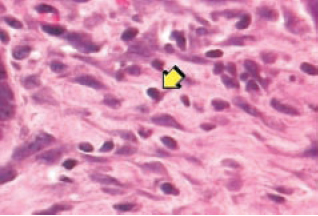
Figura 5 - 21º dia com SF 0,9% - linfócito na seta (aumento de 400x). Há cerca de 20 a 30 linfócitos por campo.
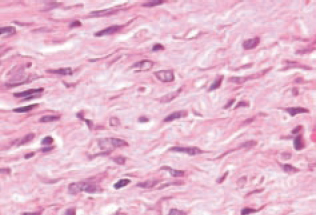
Figura 6 - 21º dia com heparina (aumento de 400x). Não há linfócitos neste corte.
O Grupo1 (heparina) apresentou menor proliferação fibroblástica (medida em espessura no corte histológico) em relação ao Grupo 2 (SF 0,9%), com um p=0,0065 (< 0,05), como mostra a Figura 7. A proliferação fibroblástica no último dia do trabalho (dia 27) pode ser vista nas Figuras 8 e 9.
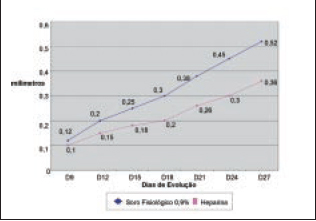
Figura 7 - Proliferação Fibroblástica. Média de espessura nos dias de evolução.
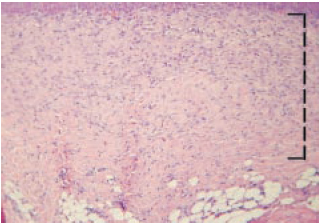
Figura 8 - 27º dia com SF 0,9% (aumento de 100x). A linha tracejada mostra a espessura de proliferação fibroblástica (média neste corte = 0,52mm).
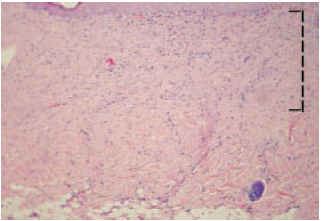
Figura 9 - 27º dia com heparina (aumento de 100x). A linha tracejada mostra a espessura de proliferação fibroblástica (média neste corte = 0,36mm).
Foi identificada uma cicatriz macroscópica no último rato tratado com soro fisiológico, o que não ocorreu no último rato do grupo da heparina (Figuras 10 e 11).
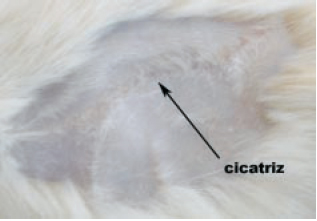
Figura 10 - 27º dia com SF 0,9% (vista macroscópica). Após a tricotomia, foi evidenciada uma cicatriz.
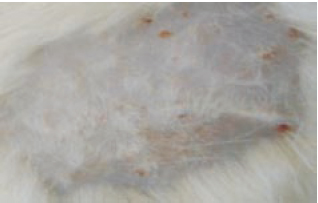
Figura 11 - 27º dia com heparina (vista macroscópica). Não havia cicatriz.
DISCUSSÃO
As vantagens e os benefícios do uso da heparina sódica tópica em queimados já foram bem descritos por inúmeros trabalhos de evolução clínica em humanos4-6. Deve-se salientar, porém, que a literatura mundial é deficiente em pesquisas, apresentando apenas o uso tópico da heparina; sendo sempre associada à via parenteral. Este estudo mostrou, pela avaliação histopatológica, as diferenças entre um grupo de ratos queimados tratado com heparina tópica e outro tratado com soro fisiológico 0,9%. O grupo da heparina mostrou menor processo inflamatório agudo e crônico, processo de neoformação vascular mais rico, e menor proliferação fibroblástica com significância estatística, ou seja, resultados favoráveis com o uso de heparina por 27 dias. A realização de outras pesquisas com cortes seriados mais próximos e acompanhamento por um tempo maior talvez possa contribuir com novos achados.
Como mostra a literatura, não é possível realizar uma queimadura perfeitamente uniforme em todos os animais do estudo8,9. A interpretação dos resultados obtidos neste trabalho deve ser feita considerando-se o desenho e o método de realização do mesmo; e estes são compatíveis com as considerações sobre os efeitos da heparina em queimados já descritos. Quanto à modulação do colágeno encontrada no uso da heparina, esta é uma consideração especial, já que foi medida indiretamente apenas através da proliferação fibroblástica (espessura)10. A melhora da reparação tecidual (ausência de cicatriz no rato com heparina) possivelmente ocorreu em virtude da melhor oxigenação local, devido à atividade trombolítica local, maior neoformação vascular e menor edema (processo inflamatório mais discreto, inibição da liberação de histamina e TNF)2,3. Todos estes achados são compatíveis com o que já há descrito em estudos prévios sobre o uso da heparina em queimados.
CONCLUSÃO
Este trabalho demonstrou, pela avaliação histopatológica, que o uso da heparina sódica tópica isolada melhorou o tratamento de queimaduras de espessura parcial da pele, apresentando menor processo inflamatório (agudo e crônico), angiogênese mais intensa, menor proliferação fibroblástica, com profundidade menor da cicatriz final, com reparação tecidual melhor em relação ao grupo controle.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Majerus PW, Tollefsen DM. Fármacos anticoagulantes, trombolíticos e antiplaquetários. In: Goodman LS, ed. Goodman and Gilman: As bases farmacológicas da terapêutica. 9a ed. Rio de Janeiro: McGraw-Hill Interamericana 1996. p.991-5.
2. Salas A, Sans M, Soriano A, Reverter JC, Anderson DC, Pique JM, et al. Heparin attenuates TNF-alpha induced inflammatory response through a CD11b dependent mechanism. Gut. 2000;47(1):88-96.
3. Peter K, Schwarz M, Conradt C, Nordt T, Moser M, Kubler W, et al. Heparin inhibits ligand binding to the leukocyte integrin Mac-1 (CD11b/CD18). Circulation. 1999;100(14):1533-9.
4. Saliba MJ Jr. Heparin efficacy in burns. II. Human thermal burn treatment with large doses of topical and parenteral heparin. Aerosp Med. 1970;41(11):1302-6.
5. Saliba MJ Jr, Dempsey WC, Kruggel JL. Large burns in humans. Treatment with heparin. JAMA. 1973;225(3):261-9.
6. Reyes A, Astiazaran JA, Chavez CC, Jaramilla F, Saliba MJ Jr. Burns treated with and without heparin: controlled use in a thermal disaster. Ann Burns Fire Disasters. 2001;14(4):183-91.
7. Cen Y, Luo P, Yan X. The effect of heparin on the deep second-degree burn in scalded rats. Zhonghua Shao Shang Za Zhi. 2001;17(3):174-6.
8. Heredero FXS, Hamann C, Martin JMO, Arias CR, Menchero SC. Experimental burn models. Ann Burns Fire Disasters. 1996;9(2):96-7.
9. Meyer TN, Silva AL. A standard burn model using rats. Acta Cir Bras. [periódico na Internet]. 1999 Out [citado 2007 Mar 02] ;14(4). Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0102-86501999000400009&lng-pt&nrm-iso.doi:10.1590/S0102-86501999000400009
10. Ferrao AV, Mason RM. The effect of heparin on cell proliferation and type-I collagen synthesis by adult human dermal fibroblasts. Biochim Biophys Acta 1993;1180(3):225-30.
I. Médico Residente do Serviço de Cirurgia Plástica "Linneu Mattos Silveira" da Pontifícia Universidade Católica de São Paulo.
II. Auxiliar de Ensino da Disciplina de Patologia da Pontifícia Universidade Católica de São Paulo.
III. Professor Titular da Disciplina de Cirurgia Plástica da Pontifícia Universidade Católica de São Paulo; Membro Titular SBCP e Regente do Serviço "Linneu Mattos Silveira".
Correspondência para:
Flávio A. F. Stillitano de Orgaes
Rua Ilda do Amaral Cussiol, 605 - Jd. Isaura
Sorocaba, SP - CEP: 18047-594
Tel: 0xx15 9718-9704
E-mail: flaviostillitano@yahoo.com.br
Trabalho realizado na Pontifícia Universidade Católica de São Paulo, Sorocaba, SP.
Artigo recebido: 22/09/2006
Artigo aprovado: 19/01/2007
* Trabalho vencedor do Prêmio Raul Couto Sucena /TAB 2006, apresentado no 43º Congresso Brasileiro de Cirurgia Plástica, em novembro de 2006.


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter