

Original Article - Year 2009 - Volume 24 -
Método de obtenção do gel de plasma rico em plaquetas autólogo
Methods to obtain autologous platelet-rich plasma gel
RESUMO
Introdução: O plasma rico em plaquetas é uma concentração autóloga de plaquetas em um pequeno volume de plasma. Diversas publicações relatam seus benefícios em estimular a cicatrização, podendo ser especialmente útil em cirurgias plásticas. O objetivo do trabalho foi estabelecer um método barato e eficiente e reprodutivo de preparação do gel de plasma rico em plaquetas para utilização em cirurgia plástica. Método: Foram realizados 63 testes por meio de centrifugação de sangue, variando-se força de centrifugação, tempo de centrifugação e redução do volume plasmático, para determinarmos o método que proporcione maior concentração plaquetária. Realizou-se mais 10 testes para comprovar a reprodutibilidade do método. Estudou-se também a obtenção de trombina autóloga por meio de adição de bicarbonato de cálcio ao plasma pobre em plaquetas. Resultados: O plasma rico em plaquetas de melhor qualidade foi obtido por meio de duas centrifugações, sendo a primeira a 400g por 10 min e a segunda a 800g por 10 min, com uma redução plasmática que permitisse permanecer apenas 10% do volume do sangue total utilizado no seu preparo. Obtiveram-se concentrações plaquetárias em média 570% maior que a do sangue do paciente e os testes foram reprodutíveis. A concentração de trombina foi de 8,55 + 1,25 U NIH/mL (trombina ativa). Conclusão: Uma alta concentração plaquetária pode ser obtida por este protocolo de obtenção do plasma rico em plaquetas e a formação do gel é possível por meio da utilização de trombina autóloga, também obtida pelo protocolo descrito, facilitando sua utilização em cirurgia plástica.
Palavras-chave: Plasma rico em plaquetas. Peptídeos e proteínas de sinalização intercelular. Cicatrização de feridas.
ABSTRACT
Background: Platelet-rich plasma is an autologous concentration of human platelets in a small volume of plasma. The vast majority of publication report a significant enhancement of healing when is used, which could be useful in plastic surgeries. This study aim to establish a low-cost efficient and reproductive method to prepare a platelet-rich plasma gel to be used in plastic surgery. Methods: Sixty three tests were done by blood centrifugation to obtain the platelet-rich plasma. We varied the strength and timing of centrifugation and the amount of the reduction plasma to determining the best quality of the platelet-rich plasma. Ten tests were done check the method's reproducibility. We studied also the obtaining autologous thrombin by the addition of calcium bicarbonate to platelets-poor plasma. Results: The best platelet-rich plasma quality was obtained through two centrifugations, being the first of 400g per 10min and the second of 800g per 10min, with plasma reduction which enabled only 10% of the total volume of blood used in its preparation to remain. Platelet concentrations were obtained on average 570% higher than the blood of the patient and the tests were reproducible. The concentration of thrombin was 8.55 + 1.25) NIH U / mL (active thrombin). Conclusions: The preparation method described in this work gets a good quality of platelet-rich plasma, and the formation of the gel is possible through the use of autologous thrombin, also obtained by the protocol described, facilitating their use in plastic surgery.
Keywords: Platelet-rich plasma. Intercellular signalizing peptides and proteins. Wound healing.
O surgimento do gel de plasma rico em plaquetas, em 1997, está relacionado aos estudos na linha de pesquisa das colas teciduais, mais especificamente ao estudo dos processos de obtenção de cola de fibrina autóloga1,2.
O plasma rico em plaquetas é uma fonte autógena de fatores de crescimento, obtida pelo sequestro e concentração de plaquetas por um gradiente de densidade por meio da centrifugação. Na criação do gel de plaquetas, o sangue venoso autólogo é centrifugado para produzir uma alta concentração de plaquetas em um pequeno volume de plasma, formando o plasma rico em plaquetas. Este é um hemocomponente, que adicionado de trombina e cálcio resulta na ativação das plaquetas e início do processo de coagulação formando o gel de plaquetas, que é rico em fatores de crescimento como o PDGF, TGF-beta, EGF, VEGF e IGF3-6. Este gel, que apresenta propriedades adesivas, hemostáticas e cicatrizantes, tem sido utilizado em diversos procedimentos cirúrgicos por dentistas, ortopedistas, neurocirurgiões e cirurgiões plásticos2,4,5,7-11.
Os trabalhos sobre plasma rico em plaquetas existentes na literatura apresentam uma grande variação na metodologia do seu preparo e nem todos alcançam as mesmas concentrações plaquetárias, algumas sendo insuficientes para melhorar na cicatrização. Por isto, este estudo tem como objetivo desenvolver uma metodologia que obtenha um gel de plasma rico em plaquetas de boa qualidade, totalmente autólogo, inclusive em relação à trombina, e que seja reprodutível.
MÉTODO
Este estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital Universitário Clementino Fraga Filho - UFRJ e registrado na Comissão Nacional de Ética em Pesquisa (protocolo de pesquisa 024/05).
Analisaram-se sete formas de preparação do plasma rico em plaquetas, totalizando 63 testes, variando-se a força de centrifugação (g), o tempo de centrifugação (T) e a quantidade de volume plasmático reduzido, sendo o produto final submetido à dosagem de plaquetas. Realizaram-se mais 10 testes para definir sua reprodutibilidade.
O sangue foi proveniente de bolsas de baixo peso (menor que 300 g), que seriam desprezadas por serem legalmente proibidas para transfusões (RDC 153 / junho de 2004). A centrífuga utilizada na preparação do plasma rico em plaquetas e da trombina autóloga foi a BR 4i® (Jouan). A qualidade do plasma rico em plaquetas obtido em cada teste foi avaliada por contagem automática de plaquetas com auxílio do aparelho Cell - Dyn 3200® (Abbott Diagnostics).
A análise estatística dos resultados obtidos com os testes, nos diversos grupos da primeira etapa do trabalho, foi realizada por meio do coeficiente de correlação intraclasse (ICC). A reprodutibilidade foi avaliada através da variância, do desvio padrão e do coeficiente de variação dos resultados dos testes realizados com amostras de sangue de um mesmo doador.
Processo de obtenção do plasma rico em plaquetas
Acondicionou-se em tubos de 5 ml (tubo A) o sangue contido na bolsa com anticoagulante (CPDA-1), sendo desprezado o restante. Esse sangue foi submetido a uma primeira centrifugação com força variando de acordo com o grupo pertencente (Tabela 1), formando-se duas colunas: uma inferior, vermelha, com as hemácias e outra superior, amarela, com plasma e plaquetas (Figura 1). Entre essas duas colunas existia uma estreita faixa esbranquiçada, chamada de zona de névoa (buffy coat), que continha plaquetas maiores e as células brancas (neutrófilos e basófilos). A coluna superior (plasma e plaquetas) e a zona de névoa (com um pouco hemácias) foram aspiradas com auxílio de seringa de 3 ml com agulha 40 x 12 mm e acondicionadas em outro tubo, de 10 ml (tubo B) (Figura 2). Foi realizada nova centrifugação com a força também variando de acordo com o grupo ao qual pertenceu (Tabela 1), obtendo-se o plasma pobre em plaquetas (PPP) e um botão eritrocítico-plaquetário no fundo do tubo. Retiravam-se dois terços do volume do plasma pobre em plaquetas e as plaquetas foram dispersas, com a agitação do tubo, formando o plasma rico em plaquetas (Figura 2). Foi colhida uma amostra de cada teste para contagem de plaquetas.
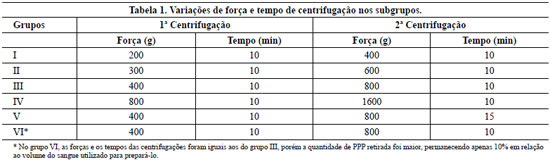
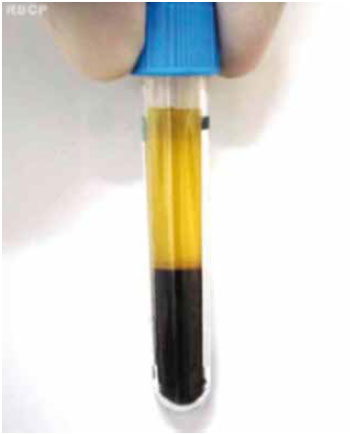
Figura 1 - Detalhe após a primeira centrifugação. A coluna superior de plasma com plaquetas e inferior de plasma com as hemácias; entre elas a zona de névoa. Esta faixa será retirada junto com o plasma com plaquetas para fazer o plasma rico em plaquetas. A coloração avermelhada do plasma rico em plaquetas ocorre porque um pouco de hemácias da porção superior da coluna vermelha é aspirada junto com a "zona de névoa".

Figura 2 - Sequência de tubos. Tubo 1: plasma com plaquetas (e algumas hemácias); Tubo 2: correspondente ao tubo 1 após a segunda centrifugação; Tubo 3: correspondente ao tubo 2 após a retirada do excesso de plasma; Tubo 4: correspondente ao tubo 3 após a dispersão das plaquetas (e algumas hemácias), constituindo o plasma rico em plaquetas.
Na primeira fase do estudo, realizaram-se 38 testes, com 10 bolsas de sangue, variando-se a força de centrifugação e alocando-os em quatro grupos:
Na segunda fase, realizaram-se 10 testes (grupo V) utilizando as forças de centrifugação do grupo da primeira fase que alcançou maiores concentrações plaquetárias, porém aumentando o tempo da segunda centrifugação de 10 para 15 minutos, objetivando observar a influência do tempo de centrifugação na qualidade do plasma rico em plaquetas (Tabela 1).
Na terceira fase, estudou-se a influência da redução do volume plasmático na qualidade do plasma rico em plaquetas. Foram realizados 15 testes (grupo VI) nos quais a quantidade de plasma rico em plaquetas produzido era fixa e igual a 10% do volume do sangue utilizado no seu preparo, ou seja, de 10 ml de sangue produziu-se 1 ml de plasma rico em plaquetas. Estes testes serviram de comparação com os testes anteriores do grupo III, nos quais o tempo e a força de centrifugação eram iguais, mas o volume de plasma rico em plaquetas produzido era maior, pois se retirava menos plasma pobre em plaquetas, correspondendo a um terço do volume do plasma com plaquetas acondicionado no tubo B.
Verificou-se a reprodutibilidade do método por meio de dez testes, com sangue proveniente da mesma bolsa, utilizando-se os melhores parâmetros encontrados nas fases anteriores (melhor força de centrifugação "g", melhor tempo de centrifugação "T" e melhor quantidade de redução do plasma pobre em plaquetas).
Processo de obtenção da trombina autóloga
Coletou-se 0,2 ml da parte superior da coluna de plasma com plaquetas de 6 tubos, após a primeira centrifugação a 400 g por 10 minutos, e acondicionou-se em um tubo de 10 ml. Neste 1,2 ml de plasma foi acrescentado 0,3 ml de gluconato de cálcio a 10% e o tubo foi colocado em banho-maria a 37ºC por 15 minutos, ocorrendo a gelação do plasma. Depois foi submetido a outra centrifugação a 800 g por 10 minutos, que resultou na separação de um líquido claro no tubo (Figura 3). A concentração da trombina existente neste líquido foi medida através de ensaio de atividade amidolítica, utilizando substrato cromogênico específico para a enzima (S-2238). Para o cálculo de sua atividade, foram utilizados os resultados de uma curva-padrão, obtidos com testes feitos com trombina humana purificada.
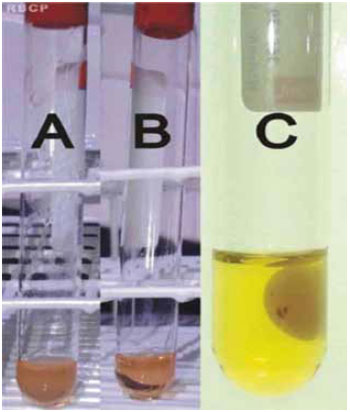
Figura 3 - Preparação da trombina autóloga. A) Plasma com gluconato de cálcio, em estado de gel, após 15 minutos em banho-maria a 37º C; B) Liberação de um líquido claro, após a centrifugação; C) Detalhe mostrando um coágulo branco, retraído, suspenso no líquido claro.
Processo de obtenção do gel de plasma rico em plaquetas
O gel de plasma rico em plaquetas foi obtido por meio da adição da trombina autóloga ao plasma rico em plaquetas em uma proporção de 1:5. Após a mistura, um tempo em torno de 1 minuto foi necessário para que o gel se formasse (Figura 4).
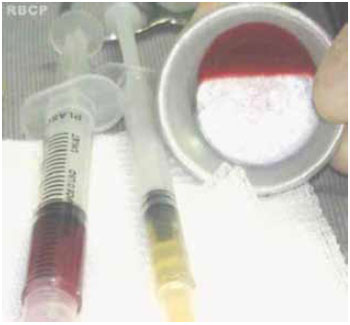
Figura 4 - Seringas com trombina autóloga (amarela) e com plasma rico em plaquetas (vermelha), misturados na proporção 1:5 para formar o gel de plasma rico em plaquetas (na cuba).
RESULTADOS
Variação da força de centrifugação
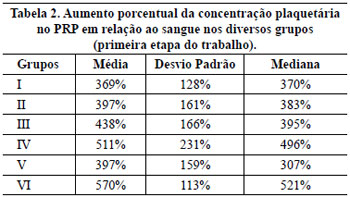
Verificou-se que, quanto maior a força de centrifugação, maior foi a concentração plaquetária. Porém, os testes com o grupo IV foram interrompidos, pois frequentemente os tubos se quebravam durante a segunda centrifugação em alta velocidade. As concentrações de plaquetas ocorreram em ordem crescente do grupo I ao III (Tabela 2). Utilizando-se o coeficiente de correlação intraclasse, observamos que o grupo III não foi concordante com o I (K = 0,43 e p = 0,072), porém foi concordante com o II (K = 0,85 e p = 0,0002). Assim, os valores encontrados no grupo III foram maiores e, em média, estatisticamente diferentes do que os do I, porém similares aos do II. No entanto, considerou-se o grupo III para prosseguirmos, pois seus valores foram maiores que os do grupo II (Tabela 2).
Variação do tempo de centrifugação
Não foi observada diferença significativa entre os grupos III e V, sendo similares em seus resultados quando analisados pelo coeficiente de correlação intraclasse (K = 0,78 e p = 0,001) (Tabela 2).
Variação do volume de plasma rico em plaquetas produzido
Observou-se que no grupo VI a qualidade de plasma rico em plaquetas produzido foi melhor que no III (p = 0,026; t Student para amostras independentes), com aumento, em média, de 132% da concentração plaquetária (Tabela 2).
Reprodutibilidade
Os testes de repetição do método utilizado no grupo VI mostrou um aumento plaquetário em média de 571%, com uma variância de 0,09, um desvio-padrão de 0,3 e um coeficiente de variação de 4,44%, comprovando que é reprodutivo.
Processo de obtenção da trombina autóloga
O resultado através de ensaio de atividade amidolítica, utilizando substrato cromogênico específico para a enzima (S-2238), demonstrou que o líquido era rico em trombina, cuja atividade (trombina ativa) foi de 8,55 + 1,25 U NIH/mL.
Processo de obtenção do gel de plasma rico em plaquetas
O processo de gelação do plasma rico em plaquetas ocorreu em todos os casos, num tempo inferior a um minuto, após a mistura da trombina autóloga ao plasma rico em plaquetas.
DISCUSSÃO
As técnicas iniciais de obtenção de plasma rico em plaquetas, como a primeira utilizada por Marx et al.2, só eram aplicáveis em uma estrutura hospitalar com máquinas de plasmaferese e necessitavam de um técnico especializado para manipulá-las. O procedimento apresentava maior morbidade e necessitava de tecnologia sofisticada. Para simplificar sua obtenção, surgiram aparelhos automatizados que produzem em torno de 7 a 10 ml de plasma rico em plaquetas a partir de 50 a 60 ml de sangue retirados por meio de punção venosa periférica. No entanto, ainda continuavam dispendiosos, com custo em torno de dois mil reais de seus materiais.
A possibilidade de obter plasma rico em plaquetas com custos menores fez surgir alguns métodos artesanais, utilizando tubos de ensaio e uma centrífuga comum, permitindo a preparação do plasma rico em plaquetas com custo muito menor e em ambientes com pouca tecnologia. Porém, estes métodos são trabalhosos e necessitam de aprendizagem por parte de quem irá realizar o procedimento. Devido a isto, está mais sujeito a erros na preparação, prejudicando a qualidade do produto. Os métodos existentes na literatura não alcançam as mesmas concentrações plaquetárias, sendo algumas insuficientes para melhorar a cicatrização3-5. Estes fatores, além de outros discutidos a seguir, podem justificar muito do criticismo a respeito da eficácia do plasma rico em plaquetas.
Em encontros específicos sobre o assunto na área da Saúde, foram divulgados os benefícios e métodos aparentemente simples de preparo do plasma rico em plaquetas. Isto levou muitos dentistas e bioquímicos a anotar velocidade e tempo de centrifugação do sangue para venderem seus serviços, banalizando seu preparo. Assim, produtos com baixa qualidade foram utilizados, sem alcançar os benefícios pretendidos.
É fácil centrifugar um sangue, juntar o plasma com plaquetas ao cálcio e obter um gel. Porém, qual a quantidade de plaquetas presente? Ou seja, qual a qualidade deste gel de plasma rico em plaquetas? Além disto, alguns métodos parecem ser pouco reprodutíveis, pois trabalhos que tentam reproduzir o gel não conseguem com a mesma qualidade do autor inicial5,12. Por isto estudamos um método que obtivesse um plasma rico em plaquetas de boa qualidade e que fosse reprodutível.
Três variáveis importantes que influenciam na qualidade do plasma rico em plaquetas são: força de centrifugação, tempo de centrifugação e redução do volume plasmático13. Por isto, estudaram-se estas variáveis para definir o método que alcança maiores concentrações de plaquetas, sem prolongar muito o tempo de preparo do produto, e conseguindo volumes finais de plasma rico em plaquetas que pudessem ser previstos antes do procedimento.
A força de centrifugação, que é fator importante para a separação dos componentes sanguíneos, devido sua densidade específica, depende da velocidade de centrifugação e do raio da centrífuga, e tem como unidade de medida a força da gravidade (g). Por isto, trabalhos que relatam apenas a velocidade de centrifugação, sem mencionar a centrífuga utilizada ou seu raio, fornecem informações incompletas para reprodução da metodologia, pois uma velocidade de 1500 rpm, por exemplo, irá resultar numa maior força de centrifugação em uma centrífuga de 16 cm de raio do que numa de 12 cm de raio.
Landesberg et al.4 relataram aumento da concentração plaquetária com o aumento da força de centrifugação até 200 g. Após este valor, ocorreu diminuição na concentração plaquetária de 205,7% para 185% ao aumentar a força de centrifugação de 200 g para 250 g. Contrariamente a isso e em concordância com o nosso trabalho anterior13, o aumento da força de centrifugação sempre levou ao aumento na concentração plaquetária. Porém, quando utilizamos uma força de 1600 g, muitos tubos quebraram durante o processo de centrifugação e abandonamos esta técnica. A força de centrifugação que mais concentrou plaquetas no nosso experimento foi de 400 g na primeira centrifugação e 800 g na segunda, alcançando um aumento em média de 438%.
Ao aumentarmos o tempo da segunda centrifugação de 10 para 15 minutos, houve menor aumento na concentração plaquetária (de 438% para 397%), mas sem significância estatística, levando à conclusão de que os valores são similares. Porém, o tempo de preparo do produto deve ser o menor possível, uma vez que é preparado imediatamente antes da cirurgia, ou até mesmo enquanto a cirurgia se inicia. Por isto adotamos em nosso protocolo o tempo de 10 minutos em cada centrifugação.
Avaliando a qualidade do plasma rico em plaquetas segundo a redução do plasma, observamos que ao retirar os dois terços superiores do plasma pobre em plaquetas tivemos uma concentração satisfatória de plaquetas (438%), porém havia uma variação na quantidade do plasma rico em plaquetas produzido. Não era possível dizer qual o volume de plasma rico em plaquetas que seria obtido a partir do volume de sangue retirado do paciente. Assim, modificamos o método fixando o volume de plasma rico em plaquetas que seria produzido como sendo 10% do volume de sangue utilizado para prepará-lo. Embora a quantidade do plasma rico em plaquetas produzido tenha sido menor, esta forma facilitou programar a quantidade de sangue que seria retirado do paciente, pois, se quiséssemos 5 ml de plasma rico em plaquetas, retiraríamos 50 ml de sangue do paciente. Outra vantagem é que a concentração plaquetária alcançada é maior que a anterior, com aproximadamente 30% mais plaquetas do que quando o volume do plasma rico em plaquetas produzido era um terço do volume do plasma com plaquetas retirado após a primeira centrifugação. Assim, conseguimos fornecer um plasma rico em plaquetas de melhor qualidade, com uma concentração plaquetária em média 570% maior que a do sangue do paciente.
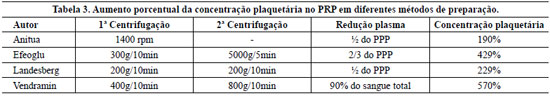
Este método nos permitiu calcular a quantidade de plasma rico em plaquetas que seria preparado e evidenciou uma boa qualidade deste plasma rico em plaquetas, com uma concentração plaquetária em média 6,7 vezes superior à da amostra de sangue, sendo maior que em todos os outros métodos "artesanais" descritos na literatura (Tabela 3) e com valores semelhantes aos das máquinas automatizadas, que alcançam aumentos de 400% a 750% em relação ao sangue5,6,14,15.
O método também se mostrou reprodutível e de fácil aplicação, desde que executado por uma pessoa treinada. Sua preparação demorou cerca de 45 minutos após a coleta do sangue.
Não foi nosso objetivo estudar o aumento da concentração de fatores de crescimento (FC) no plasma rico em plaquetas, uma vez que já foram realizados estudos anteriores comprovando este aumento e que foi proporcional ao aumento da concentração de plaquetas3,5,6,15. Porém, a dosagem da concentração dos FC no plasma rico em plaquetas é importante para comparação com outros métodos, e deverá ser complementada em estudos posteriores.
A ativação das plaquetas e transformação do plasma rico em plaquetas, que está na forma líquida, para a forma de gel pode ser feita por meio da adição de gluconato de cálcio7 ou de trombina13. Quando se utiliza apenas gluconato de cálcio, o processo demora em torno de 10 minutos (ou 5 minutos em banho-maria) para ocorrer, o que pode ser um tempo muito longo para determinadas aplicações do produto. Por outro lado, a utilização de trombina torna este processo muito mais rápido, ocorrendo a gelação do plasma rico em plaquetas 30 a 60 segundos após sua mistura.
Desenvolvemos nosso protocolo de obtenção de um líquido rico em trombina autóloga, em um processo concomitante ao de produção do plasma rico em plaquetas. O plasma retirado após a primeira centrifugação, que é rico em protrombina, recebe pequena quantidade de cálcio (4 partes de plasma para 1 parte de gluconato de cálcio 10%), iniciando o processo de coagulação, que é interrompido parcialmente quando o cálcio acaba (pois o processo de coagulação é dependente de cálcio), fazendo com que se obtenha um líquido rico em trombina.
A concentração de trombina ativa obtida em nosso protocolo foi de 8,55 + 1,25 NIH/mL e, na prática, realizou a gelação do plasma rico em plaquetas em todos os casos, tendo, portanto, uma concentração suficiente para promover o efeito desejado.
CONCLUSÃO
Foi possível estabelecer um método de obtenção do plasma rico em plaquetas e do gel de plasma rico em plaquetas, autólogos, com boa qualidade e reprodutível, utilizando uma centrifuga comum e materiais usualmente presente nos hospitais, como seringas, tubos de ensaio e agulhas. A preparação por meio de duas centrifugações, sendo a primeira a 400g por 10 minutos e a segunda a 800g por 10 minutos, com redução de 90% do plasma, obtém um plasma rico em plaquetas com aumento, em média, de 570% na concentração plaquetária em relação ao sangue.
AGRADECIMENTOS
Agradecemos a Carmen Martins Nogueira, Chefe do Serviço de Hemoterapia do Hospital Universitário Clementino Fraga Filho (UFRJ), e a Mariana Sá Pereira, Professora Adjunta do ICB - Laboratório de Tecido Conjuntivo da Universidade Federal do Rio de Janeiro - UFRJ, pela ajuda no desenvolvimento deste trabalho.
REFERÊNCIAS
1. Green DM, Klink B. Platelet gel as an intraoperatively procured platelet-based alternative to fibrin glue. Plast Reconstr Surg. 1998;101(4):1161-2.
2. Marx RE, Carlson ER, Eichstaedt RM, Schimmele SR, Strauss JE, Georgeff KR. Platelet-rich plasm: growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998;85(6):638-46.
3. Eppley BL, Woodell JE, Higgins J. Platelet quantification and growth factor analysis from platelet-rich plasma: implications for wound healing. Plast Reconstr Surg. 2004;114(6):1502-8.
4. Landesberg R, Roy M, Glickman RS. Quantification of growth factor levels using a simplified method of platelet-rich plasma gel preparation. J Oral Maxillofac Surg. 2000;58(3):297-300.
5. Marx RE. Platelet-rich plasma: evidence to support its use. J Oral Maxillofac Surg. 2004;62(4):489-96.
6. Zimmermann R, Jakubietz R, Jakubietz M, Strasser E, Schlegel A, Wiltfang J, et al. Different preparation methods to obtain platelet components as a source of growth factors for local application. Transfusion. 2001;41(10):1217-24.
7. Almeida ARH, Menezes JA, Araújo GKM, Mafra AVC. Utilização de plasma rico em plaquetas, plasma pobre em plaquetas e enxerto de gordura em ritidoplastias: análise de casos clínicos. Rev Bras Cir Plást. 2008;23(2):82-8.
8. Brown SA, Appelt EA, Lipschitz A, Sorokin ES, Rohrich R. Platelet gel sealant use in rhytidectomy. Plast Reconstr Surg. 2006;118(4):1019-25.
9. Eppley BL, Pietrzak WS, Blanton M. Platelet-rich plasma: a review of biology and applications in plastic surgery. Plast Reconstr Surg. 2006;118(6):147e-59e.
10. Mazzucco L, Medici D, Serra M, Panizza R, Rivara G, Orecchia S, et al. The use of autologous platelet gel to treat difficult-to-heal wounds: a pilot study. Transfusion. 2004;44(7):1013-8.
11. Uebel CO, Silva JB, Cantarelli D, Martins P. The role of platelet plasma growth factors in male pattern baldness surgery. Plast Reconstr Surg. 2006;118(6):1458-66.
12. Pacifici L, Casella F, Maggiore C. Plasma arricchito di piastrine (PRP): metodi di estrazione e potenzialità d'uso. Minerva Stomatol. 2002;51(7-8):341-50.
13. Vendramin FS, Franco D, Nogueira CM, Sá PM, Franco TR. Plasma rico em plaquetas e fatores de crescimento: técnica de obtenção e utilização em cirurgia plástica. Rev Col Bras Cir. 2006;33(1):24-8.
14. Efeoglu C, Akçay YD, Erturk S. A modified method for preparing platelet-rich plasma: an experimental study. J Oral Maxillofac Surg. 2004;62(11):1403-7.
15. Schlegel KA, Donath K, Rupprecht S, Falk S, Zimmermann R, Felszeghy E, et al. De novo bone formation using bovine collagen and platelet-rich plasma. Biomaterials. 2004;25(23):5387-93.
I. Doutor; Professor de Técnica Cirúrgica da Universidade Federal do Pará / Coordenador do Serviço de Cirurgia Plástica do Hospital. Metropolitano (Pará).
II. Doutor; Professor Adjunto de Cirurgia Plástica da Universidade Federal do Rio de Janeiro (UFRJ).
III. Doutorado; Chefe do Serviço de Cirurgia Plástica do Hospital Clementino Fraga Filho - UFRJ.
Trabalho realizado no Hospital Clementino Fraga Filho - UFRJ, Rio de Janeiro, RJ.
Este artigo foi submetido pelo SGP (Sistema de Gestão de Publicações) da RBCP.
Artigo recebido: 11/3/2009
Artigo aceito: 30/5/2009


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter