

Reviw Article - Year 2008 - Volume 23 -
Biomaterials in Craniomaxilofacial Surgery: basic principals and applications - literature revision
Biomateriais em Cirurgia Craniomaxilofacial: princípios básicos e aplicações - revisão de literatura
ABSTRACT
The biomaterials have a lot of due or applications. Their use needs the knowledge of its proprieties and receptor characteristics. This is a review of the biomaterials use in Craniomaxillofacial Surgery, emphasizing the definition, classes/types and proprieties.
Keywords: Biocompatible materials. Craniofacial abnormalities/surgery. Bone substitutes. Biomedical and dental materials.
RESUMO
Na Medicina, os biomateriais possuem múltiplas aplicações ou finalidades. Seu uso necessita do conhecimento das propriedades do material e das características de seu sítio receptor. Este trabalho promove uma revisão do uso dos biomateriais na Cirurgia Craniomaxilofacial, enfatizando sua definição, classes/tipos e propriedades.
Palavras-chave: Materiais biocompatíveis. Anormalidades craniofaciais/cirurgia. Substitutos ósseos. Materiais biomédicos e odontológicos.
Biomateriais são materiais de origem biológica ou sintética utilizados para confecção de implantes, aparelhos ou sistemas que estarão em contato com sistemas biológicos e tecidos vivos com objetivo de reparar perdas teciduais e restaurar funções comprometidas por processos degenerativos ou traumatismos.
Além dos processos de envelhecimento naturais e de afecções do organismo que culminam com perdas funcionais, o ser humano alcançou uma capacidade enorme para esmagar, mutilar, quebrar e desfigurar o corpo por meio do uso de veículos automotores, armas, ferramentas e de práticas esportivas1.
De forma mais abrangente, diversos autores definem biomateriais como qualquer material não-vivo utilizado em Medicina com o propósito de interagir com um sistema vivo. Este conceito é complementado com a definição de biocompatibilidade, que é a capacidade do material desempenhar sua função com uma resposta apropriada do tecido hospedeiro2.
PROPRIEDADES DOS BIOMATERIAIS
O conhecimento de alguns princípios básicos sobre a ciência que estuda os materiais e suas aplicações é fundamental para a compreensão dos mecanismos que regem a relação entre os implantes e o tecido hospedeiro. Estes princípios são baseados na interface entre a estrutura interna do material, as técnicas para o seu processamento e suas propriedades.
A estrutura interna de um material possui níveis de organização que vão desde os átomos, ligados em seus arranjos espaciais em escala nanométrica, até o nível da macroestrutura em escala milimétrica. O arranjo espacial dos átomos e as ligações entre eles determinam o tipo de material formado - metais, cerâmicas e polímeros. Esta estrutura, que pode ser ordenada formando uma estrutura cristalina ou desordenada configurando estrutura amorfa não-cristalina, determina o comportamento de cada material. Por meio de técnicas de análise, como a espectroscopia de infravermelho e a microscopia óptica ou eletrônica, é possível identificar fases distintas relacionadas à microestrutura dos materiais.
As fases determinadas pela orientação dos átomos podem afetar diretamente as propriedades mecânicas dos materiais3.
O processamento de materiais envolve métodos utilizados para sua fabricação e estabelecimento de sua forma/estrutura final. Os métodos podem ser variados, envolvendo processos térmicos, químicos e mecânicos. Metais, por exemplo, são obtidos em forma de lingotes metálicos a partir do minério de origem e são submetidos a processos de conformação, laminação, forjamento, usinagem e tratamento térmico para obtenção de forma3.
As propriedades mecânicas de cada material e como ele se comporta quando submetido a uma força aplicada determinam a sua resistência, que pode ser mensurada pelo módulo de elasticidade, dureza e capacidade de deformação (ductibilidade).
Algumas características dos ensaios mais freqüentemente realizados podem ser descritas3:
O conhecimento destes princípios básicos e dos termos adequados para nomeá-los, bem como as propriedades dos materiais que estamos utilizando, é o primeiro passo para lidarmos com implantes de biomateriais diversos na prática clínica. A indicação da utilização de um implante e o êxito do procedimento dependem deste conhecimento.
RESPOSTAS TECIDUAIS E POROSIDADE
O sucesso do implante depende da resposta tecidual do sítio receptor e do tipo de interface e adesão que ocorre entre implante e tecido vivo do hospedeiro. Qualquer material implantado em um organismo vivo estimula alguma reação. Existem quatro tipos de respostas teciduais a implantes4:
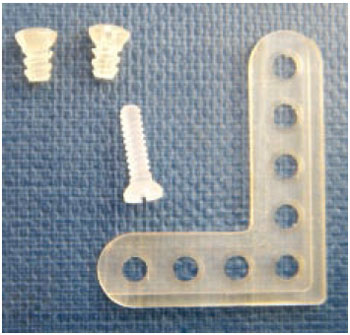
Figura 1 - Placas de sistema absorvível - copolímero lacticoglicólico 82-18% utilizadas em cirurgia craniofacial.
A adesão do material ao sítio receptor tem grande importância no desempenho do implante em longo prazo, pois a presença de movimentos entre o implante e a cápsula que o envolve é mecanismo reconhecido como responsável pela falha e perda de próteses e órteses4 (Figura 2).
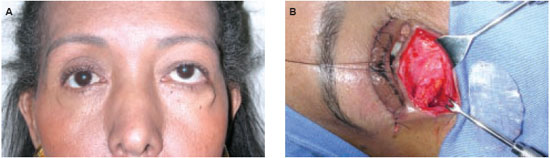
Figura 2 - A: Migração de implante de silicone em soalho orbitário provocando distopia ocular - após 15 anos do tratamento de fratura de soalho orbitário. B: remoção cirúrgica do implante de silicone.
A presença de poros na superfície dos materiais aumenta a área de contato com o tecido receptor, além de favorecer a invasão tissular para dentro do implante. Esta migração celular a partir da superfície de contato aumenta a adesividade do implante, melhorando a vascularização no local e minimizando riscos de infecção ou colonização bacteriana. Estudos experimentais comparativos que utilizaram implantes com porosidades diferentes demonstraram que aqueles que possuíam poros entre 50-100 micrômetros apresentaram maior resistência a processos infecciosos. Outro fator ressaltado foi a interconectividade entre os poros que é tão importante quanto o tamanho dos mesmos5. O crescimento tecidual, a invasão tissular para dentro do implante e a interface implante- hospedeiro vão promover estabilidade e aumentar a resistência do implante4.
A resistência de um material pode diminuir devido à porosidade, que aumenta a exposição do implante a ações do meio biológico. Porém, esta porosidade promove formação de interface de adesão chamada de bioatividade. Esta interface possui propriedades mecânicas que estabilizam o implante no local receptor, formando um complexo integrado entre implante e tecido hospedeiro4. Esta propriedade responsável pela biocompatibilidade dos biomateriais é fundamental para o desempenho adequado das funções de determinados implantes, bem como para o êxito dos procedimentos que os utilizam.
BIOMATERIAIS NA CIRURGIA CRANIOMAXILOFACIAL
Os principais biomateriais aplicados na cirurgia craniomaxilofacial podem ser divididos em três classes:
Os metais
Os metais são amplamente utilizados em próteses e como elementos estruturais na estabilização de fraturas ósseas. São placas, miniplacas e parafusos utilizados para osteossínteses. Destacam-se pela excelente resistência mecânica associada à capacidade de deformação e elevada tenacidade, além da facilidade de fabricação e baixo custo. A maioria dos elementos metálicos, como ferro, cromo, cobalto, níquel, titânio e suas ligas usadas na confecção de implantes, é bem tolerada pelo organismo vivo, fazendo desses materiais a principal escolha para tratamento de fraturas ósseas. A tolerância a carregamento mecânico é requisito para sua utilização e sistemas têm sido desenvolvidos com o objetivo de minimizar alterações ósseas causadas pela diferença na distribuição de tensões em regiões submetidas a osteossínteses6. Dentre os biomateriais metálicos, os aços inoxidáveis, principalmente os austeníticos do tipo 316L (ASTM F138), ligas Co-Cr-Mo (ASTM F75, F799), Co-Ni-Cr- Mo (ASTM F562), titânio puro e Ti-6Al-4V (ASTM F67 e F136) são os mais usados.
As osteossínteses do esqueleto facial são realizadas utilizando sistemas apropriados, com dimensões reduzidas e perfil baixo, evitando proeminências inestéticas em tecidos moles, suprajacentes ao implante. Permitem a fixação e o contato dos fragmentos ósseos, condição fundamental para a cicatrização óssea, além da devolução do contorno ósseo e da função acometida pelo traumatismo6,7 (Figura 3).
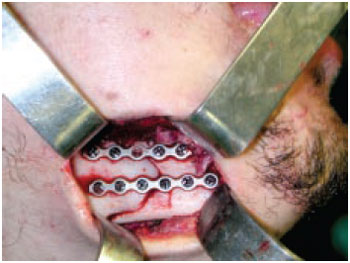
Figura 3 - Miniplaca de titânio sistema 2,0 mm estabilizando fratura de mandíbula.
Quando ocorre necessidade de preenchimento e substituição de arcabouço ósseo facial, com objetivo de devolução volumétrica ou de contorno facial para projeção de partes moles, os implantes devem ter volume. Dentre os mais utilizados estão os polímeros (destacando o polietileno poroso de alta densidade) e as biocerâmicas (hidroxiapatita, biovidro)8.
As cerâmicas
As cerâmicas (incluem os vidros e vitro-cerâmicas) englobam uma gama enorme de composições não-metálicas/inorgânicas, com aplicações médicas e odontológicas. Este grupo de materiais apresenta algumas características peculiares relacionadas a sua estrutura e propriedades que permitem a sua utilização para substituição de tecidos mais rígidos, como osso e conjuntivo fibroso4.
As cerâmicas e biovidros em contato com sistemas vivos promovem reação na superfície do implante, produzindo camada de hidroxiapatita, formada por cristais de cálcio e fósforo que também são presentes na fase mineral do tecido ósseo. Esta capacidade se apresenta como grande vantagem nas possibilidades de êxito de implantes confeccionados a partir destes materiais pela interface contínua com o tecido hospedeiro, promovendo maior adesão.
Os tipos de adesão entre tecido e implante de biocerâmicas são9:
Os materiais cerâmicos não possuem propriedade de deformação plástica presente nos metais, por isto possuem baixa tenacidade a fraturas, o que os torna frágeis e pouco indicados para o uso em regiões submetidas a tensões elevadas. No processamento das cerâmicas podem ocorrer pontos de concentração de tensões, causando microtrincas que ao se submeterem à tração podem se propagar devido à baixa tenacidade deste material. Os materiais cerâmicos são frágeis e a fratura é o mecanismo mais comum de falha destes materiais9 (Figura 4).
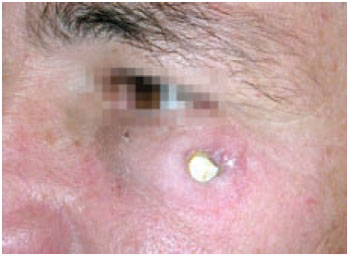
Figura 4 - Exposição de implante de hidroxiapatita em região zigomática após 17 anos do tratamento de fratura de complexo zigomático maxilar.
Cerâmicas não têm boa capacidade de se deformar sob ação de uma força. Esta propriedade é considerada fator limitante para o uso de implantes cerâmicos quando o objetivo é restauração de forma e contorno. Os materiais cerâmicos não permitem esta maleabilidade para obtenção de forma mais adaptável. Modelos prontos obtidos a partir de técnicas de prototipagem são considerados a solução para esta limitação, porém seu custo é elevado e mesmo o implante no formato adequado pode precisar de algum ajuste para melhor adaptação ao sítio receptor10.
Pesquisas com materiais cerâmicos vêm sendo desenvolvidas com o objetivo de solucionar estes problemas e buscar materiais mais resistentes e com maior tenacidade. Os principais recursos utilizados são o controle das técnicas de processamento e o desenvolvimento de compósitos em matriz metálica ou polimérica9.
Os polímeros
Os polímeros são representados por um extenso grupo de materiais que apresentam caráter macromolecular. Apresentam baixa densidade, pequena resistência à temperatura e baixa condutividade elétrica e térmica.
Alguns polímeros naturais, como celulose, algodão e seda, são utilizados em aplicações biomédicas desde o início da civilização. Os polímeros sintéticos vêm sendo utilizados desde 1950, e os mais conhecidos em aplicações biomédicas são: polimetilmetacrilato, polietileno e poliuretano. Possuem propriedades térmicas que os dividem em termoplásticos, ou seja, sofrem deformação a partir da aplicação de pressão sob temperaturas mais elevadas (polietileno, polipropileno, polimetilmetacrilato, politetrafluoretileno, poliamidas) ou termorrígidos que não podem ser reprocessados facilmente, uma vez adquirida a forma final (borrachas vulcanizadas, hidrogéis, resinas epoxídicas e fenólicas)11.
Em relação ao comportamento mecânico, os polímeros apresentam alta ductibilidade, ou seja, são capazes de sofrer deformação plástica para absorver a energia de um impacto antes de ocorrer a fratura do material. Esta propriedade é influenciada pela temperatura e pelo tempo11,12. Os polímeros podem apresentar comportamentos diversos de acordo com a temperatura e o tempo em que estão implantados. As propriedades mecânicas permitem a sua utilização para substituição de tecidos moles ou rígidos como osso, observadas as questões relacionadas a tensões no sítio receptor. Estes materiais podem ser projetados e programados a partir da organização da sua estrutura macromolecular, permitindo a obtenção de comportamentos diferentes para aplicações específicas11.
As reações que o implante promove no sítio receptor permitem fixação morfológica com invasão tissular de fibroblastos para o interior do implante a partir de sua superfície porosa (poros maiores que 100 a 200 micrômetros). Estudo histológico destes implantes, realizado por meio de biópsia, demonstrou presença de neoformação vascular madura e invasão tissular no implante, em até 8 mm da sua espessura, caracterizada pela presença de fibroblastos com deposição lamelar de colágeno na superfície13.
Estudos utilizando o polietileno poroso de alta densidade demonstraram tais resultados, caracterizando a interface entre o polímero e o tecido vivo com fixação morfológica através dos poros14-16.
A possibilidade de trabalhar ou moldar o implante para obtenção de forma mais adequada ao sítio de implantação é importante na escolha de um implante para reconstrução do esqueleto facial e foi bem documentada nos estudos iniciais de Rubin17 com o polietileno, que registrou as vantagens deste biomaterial comparando a dificuldade de moldar enxertos ósseos e cartilaginosos na reconstrução de várias unidades do esqueleto facial.
Vários autores demonstraram, nesta época, a preocupação em se obter um material que apresentasse características de biocompatibilidade aliadas à possibilidade de esculpir, moldar e ajustar o implante ao local de implantação. Esta característica permite resultados estéticos e funcionais melhores, além de menor incidência de complicações relacionadas a migrações de implantes, micromovimentos causando reações inflamatórias e até mesmo infecção, com extrusão e perda do implante15-17.
O polietileno poroso de alta densidade é excelente material para confecção de implantes faciais pela sua propriedade termoplástica que permite trabalhar, esculpir e moldar o implante durante o procedimento, proporcionando a melhor adaptação ao sítio receptor (Figura 5).

Figura 5 - Implantes de polietileno poroso para ângulo de mandíbula e mento - utilizados para projeção anterior da região mentoniana e melhoria do contorno na região de ângulo mandibular.
A combinação de dois ou mais materiais de classes diferentes, denominados compósitos, permite obtenção de melhor performance, pois as propriedades individuais de cada um podem ser somadas, ampliando as possibilidades de utilização do implante. Esta tem sido importante estratégia na elaboração de implantes mais biocompatíveis e com menor incidência de falhas18,19.
Os compósitos
O objetivo principal de produzir um compósito é a obtenção de um sistema com propriedades superiores às dos componentes unitários19. Compósitos bioativos envolvem geralmente a matriz - que confere propriedades mecânicas, físicas e químicas ao implante - e uma fase bioativa - que assegura a interação favorável entre implante e tecido vivo através da interface, adesão e proliferação celular20. Atualmente existem muitas pesquisas com biomateriais com composições e concentrações diversas, permitindo maior especificidade na indicação de utilização dos mesmos. Um exemplo importante é o tecido ósseo. O osso é um compósito natural constituído por interfaces entre a fase mineral e a fase celular. Esta interface microestrutural apatita-colágeno é a base para o desenvolvimento de compósitos com objetivo de substituir tecido ósseo. Compósitos de matriz polimérica (proporciona ductibilidade e outras propriedades necessárias à substituição óssea), contendo partículas de componente bioativo (promove a adesão e proliferação celular a partir da superfície do implante) apresentam- se como escolha natural para substituir osso19.
A busca por equilíbrio entre propriedades: porosidade, ductibilidade, tenacidade e fragilidade são fundamentais em biomateriais utilizados para a reconstrução do esqueleto facial, onde a fixação e adaptação ao sítio receptor estão diretamente relacionadas a melhores resultados.
PERDAS E INSUCESSO DOS IMPLANTES
Estudos que avaliam insucesso e perdas de implantes de biomateriais enumeram alguns aspectos responsáveis por tais perdas:
O insucesso dos implantes é caracterizado por reações inflamatórias, infecciosas, deterioração funcional do órgão ou do local de implantação, migrações e extrusões com exposição total ou parcial do material implantado.
Atualmente, as taxas de sucesso com a utilização de biomateriais nas áreas de Medicina e Odontologia são elevadas, em torno de 95%, o que encoraja o cirurgião e o próprio paciente a buscar esta tecnologia para o tratamento de determinadas afecções1.
A confiabilidade de sistemas compostos por biomateriais vem sendo aprimorada cada vez mais a partir de pesquisas que objetivam investigar as reações e interface entre implantes e tecidos, a previsão de desempenho em longo prazo, a utilização de matrizes bioativas e suas mais diversas reações. A colaboração interdisciplinar entre as áreas de interesse da Medicina, Odontologia e Engenharia são de extrema importância dentro deste contexto de investigação científica e busca de novas tecnologias.
CONCLUSÃO
Não existe um único biomaterial que pode ser utilizado para múltiplas aplicações ou finalidades. O conhecimento prévio das propriedades de cada material, assim como das funções executadas e das condições do local que irá receber o implante, é fundamental no processo de escolha de um implante - fator determinante no êxito da intervenção cirúrgica.
REFERÊNCIAS
1. Hench L. Biomateriais: uma introdução. In: Oréfice RL, Magalhães MM, Mansur HS, eds. Biomateriais: fundamentos e aplicações. Rio de Janeiro:Cultura Médica;2006. p.1-7.
2. Ratner BD, Hoffman AS, Schoen FJ, Lemons JE. Biomaterials science: a multidisciplinary endeavor. In: Ratner BD, Hoffman AS, Schoen FJ, Lemons JE, eds. Biomaterials science: an introduction to materials in medicine. Londres:Elsevier Academic Press;2004. p.1-9.
3. Pereira MM. Conceitos básicos de ciência dos materiais. In: Oréfice RL, Magalhães MM, Mansur HS, eds. Biomateriais: fundamentos e aplicações. Rio de Janeiro:Cultura Médica;2006. p.13-37.
4. Hench LL, Best S. Ceramics, glasses and glass-ceramics. In: Ratner BD, Hoffman AS, Schoen FJ, Lemons JE, eds. Biomaterials science: an introduction to materials in medicine. Londres: Elsevier Academic Press;2004. p.153-70.
5. Sclafani AP, Thomas JR, Cox AJ, Cooper MH. Clinical and histologic response of subcutaneous expanded polytetrafluoroethylene (Gore-tex) and porous high-density polyethylene (Medpor) implants to acute and early infection. Arch Otolaryngol Head Neck Surg. 1997;123(3):328-36.
6. Pereira MM, Buono VTL, Zavaglia CAC. Materiais metálicos: ciência e aplicação como biomateriais. In: Oréfice RL, Magalhães MM, Mansur HS, eds. Biomateriais: fundamentos e aplicações. Rio de Janeiro:Cultura Médica;2006. p.41-58.
7. Kawamoo HK. What are your considerations in the selection of implant material in maxillofacial surgery? Ann Plast Surg. 1981;7(6):501-4.
8. Ousterhout DK, Stelnicki EJ. Plastic surgery's plastics. Clin Plast Surg. 1996;23(1):183-90.
9. Pereira MM, Vasconcelos WL, Zavaglia CAC. Materiais cerâmicos - ciência e aplicação como biomateriais. In: Oréfice RL, Magalhães MM, Mansur HS, eds. Biomateriais: fundamentos e aplicações. Rio de Janeiro:Cultura Médica; 2006. p. 61-81.
10. Taub PJ, Rudkin GH, Clearihue WJ III, Miller TA. Prefabricated alloplastic implants for cranial defects. Plast Reconstr Surg. 2003;111(3):1233-40.
11. Oréfice RL. Materiais poliméricos - ciência e aplicação como biomateriais. In: Oréfice RL, Magalhães MM, Mansur HS, eds. Biomateriais: fundamentos e aplicações. Rio de Janeiro:Cultura Médica;2006. p.87-155.
12. Cooper SL, Visser SA, Hergenrother RW, Lamba NMK. Polymers in biomaterials science. In: Ratner BD, Hoffman AS, Schoen FJ, Lemons JE, eds. Biomaterials science: an introduction to materials in medicine. Londres:Elsevier Academic Press;2004. p.67-79.
13. Wellisz T, Kanel G, Anooshian RV. Characteristics of tissue response to Medpor porous polyethylene implants in the human facial skeleton. J Long Term Effects of Medical Implants. 1993; 3(3):223-35.
14. Spector M, Flemming WR, Kreutner A. Bone growth into porous high-density polyethylene. J Biomed Mater Res. 1976;10(4):595-603.
15. Golshani S, Zhou ZY, Gade P. Applications of medpor porous polyethylene in facial bone augmentation. Am J Cosmetic Surg. 1994;11(2):105-9.
16. Yaremchuk MJ. Facial skeletal reconstruction using porous polyethylene implants. Plast Reconstr Surg. 2003;111(6):1818-27.
17. Rubin LR. Polyethylene as a bone and cartilage substitute: a 32 year retrospective. In: Biomaterials in reconstructive surgery. St Louis:CV Mosby;1983. p.477-93.
18. Hoffman AS. Classes of materials used in medicine - Introduction. In: Ratner BD, Hoffman AS, Schoen FJ, Lemons JE, eds. Biomaterials science: an introduction to materials in medicine. Londres:Elsevier Academic Press;2004. p.67-79.
19. Wang M. Developing bioactive composite materials for tissue replacement. Biomaterials. 2003;24(13):2133-51.
20. Rea SM, Brooks RA, Schneider A, Best SM, Bonfield W. Osteoblast-like cell response to bioactive composites - surface topography and composition effects. J Biomed Mater Res B Appl Biomater. 2004;70(2):250-61.
I. Membro Titular da Sociedade Brasileira de Cirurgia Plástica. Membro Titular da Sociedade Brasileira de Cirurgia Craniomaxilofacial. Coordenadora da Residência Médica de Cirurgia Plástica do Hospital Universitário São José (HUSJ). Aluna da pós-graduação - doutorado da Faculdade de Medicina da Universidade Federal de Minas Gerais.
II. Membro Especialista da Sociedade Brasileira de Cirurgia Plástica. Preceptor da Residência Médica de Cirurgia Plástica do Hospital Universitário São José (HUSJ).
Correspondência para:
Clarissa Leite Turrer
Alameda Monviso, 22
Vila Alpina - Nova Lima. MG
CEP: 34000-000
Fone (31) 9301-0840/ 3581-1641
E-mail: clarturrer@uol.com
Trabalho realizado no Serviço de Cirurgia Plástica Estética e Reconstrutora do Hospital Universitário São José (HUSJ) - Faculdade de Ciências Médicas de Minas Gerais (FCMMG), Belo Horizonte, MG.
Artigo recebido: 07/11/2007 Artigo aceito: 04/02/2008


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter