

Case Report - Year 2025 - Volume 40Issue 1
Linfoma anaplásico de células grandes associado a implante mamário: Um relato de caso
Breast Implant-Associated Anaplastic Large Cell Lymphoma: A Case Report
RESUMO
O linfoma anaplásico de células grandes associado a implante mamário (BIA-ALCL, do inglês breast implant-associated anaplastic large cell lymphoma) é um distúrbio ainda pouco descrito na literatura; porém, o número de casos está crescendo rapidamente. Dos casos que foram publicados até agora, poucos são de pacientes brasileiras. Apresentamos um caso tratado no Instituto Nacional de Câncer (INCA) com ênfase no seguimento realizado pela cirurgia plástica, que incluiu lipoenxertias seriadas para restauração do volume mamário sem uso de novos implantes. O prognóstico do BIAALCL associado a implantes mamários é geralmente favorável, desde que diagnosticado e tratado precocemente. Este relato visa contribuir para o reconhecimento e abordagem dessa doença na prática da cirurgia plástica.
Palavras-chave: aloenxertos; cirurgia plástica; implante mamário; linfoma anaplásico de células grandes; mama
ABSTRACT
Although breast implant-associated anaplastic large cell lymphoma (BIA-ALCL) is a disorder still sparsely described in the literature, the number of reported cases is rising rapidly. Few of the cases published to date involve Brazilian patients.We present a case treated at Instituto Nacional de Câncer (INCA) with an emphasis on the plastic surgery follow-up, which included serial fat-grafting procedures to restore breast volume without new implants. The prognosis of BIA-ALCL is often favorable, provided its diagnosis and treatment are accomplished early. The present report aims to contribute to the recognition and management of this condition in plastic surgery practices.
Keywords: allografts; plastic surgery; anaplastic large-cell lymphoma; breast implants; breast
Introdução
O linfoma anaplásico de grandes células associado a implante mamário (BIA-ALCL, do inglês breast implant-associated anaplastic large cell lymphoma) é um linfoma T com o primeiro caso relatado em 1997.1 Até 30 de junho de 2024, um total de 1.380 casos foram descritos no mundo.2 A epidemiologia do BIA-ALCL apresenta limitações devido à falta de dados sobre a prevalência de usuárias de implantes, tipos de próteses utilizadas e eventos adversos associados, dificultando a estimativa de incidência e risco. Até o momento, praticamente todos os casos descritos estão relacionados a implantes texturizados, com tempo médio de manifestação de 8 a 9 anos após o implante. O diagnóstico baseia-se na clínica, que pode incluir efusão tardia, massa, aumento de volume, dor, e erupção ou úlcera cutânea, confirmado por citologia e imunofenotipagem do seroma e/ou imunohistoquímica (IHQ).3
Objetivo
Relatar um caso clínico de BIA-ALCL, evidenciando o processo de diagnóstico, tratamento cirúrgico (explante e capsulectomia) e seguimento oncológico, além de demonstrar a estratégia reconstrutiva adotada (lipoenxertia mamária) e ressaltar a importância do reconhecimento precoce desta entidade visando um melhor prognóstico.
Materiais e Métodos
Trata-se de um estudo observacional descritivo, na forma de relato de caso, realizado no Instituto Nacional de Câncer (INCA), Rio de Janeiro, RJ. As informações foram coletadas por meio de:
Revisão de prontuário da paciente, incluindo dados clínicos, cirúrgicos e exames complementares (imagem e histopatologia).
Observação direta da evolução clínica nos períodos prée pós-operatório.
Revisão bibliográfica em bases de dados como Public Medical Database (PubMed), Scientific Electronic Library Online (SciELO) e Google Scholar, utilizando descritores em português e inglês (BIA-ALCL, breast implants e anaplastic large cell lymphoma).
Termo de Consentimento Livre e Esclarecido obtido para uso de imagens e divulgação das informações clínicas de forma anônima.
O estudo obteve aprovação pelo Comitê de Ética da instituição sob o número de parecer: 7.515.140.
Não foi aplicado método de amostragem, pois se trata de um único caso, descrito em profundidade para ilustrar a apresentação clínica, o tratamento e o seguimento oncológico.
Resultados
Relato de Caso
Paciente de 45 anos, HIV positivo em tratamento com terapia antirretroviral no esquema dolutegravir, darunavir e ritonavir, sem demais comorbidades, com história de mamoplastia de aumento em 2014. Refere aumento súbito do tamanho da mama direita, indolor, com início em agosto de 2021. Foi realizada uma punção aspirativa por agulha fina de seroma da mama direita, com laudo de células acentuadamente atípicas, de linhagem linfoide com amostra positiva para malignidade.
Após discussão de caso em conjunto com a equipe de mastologia, em março de 2022, foi deliberado explante bilateral com capsulectomia para diagnóstico histopatológico.
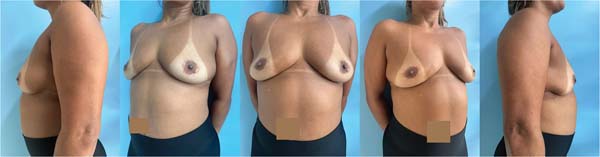
Ao exame físico, em março de 2022, apresentava mama direita discretamente maior que a esquerda, próteses mamárias sem contratura, ausência de nódulos palpáveis, além de linfonodo fibroelástico na axila direita (►Fig. 1).
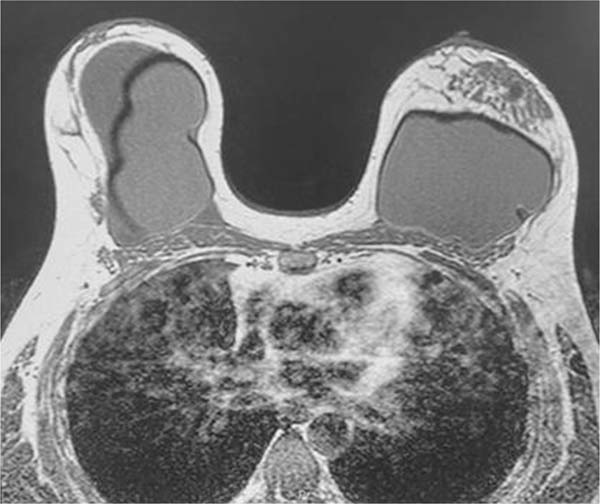
Na ressonância magnética, apresentava volumosa coleção intracapsular na mama direita, com conteúdo heterogêneo, associado a realce e espessamento do invólucro e da cápsula fibrosa, compatível com processo inflamatório e contratura capsular, não podendo desconsiderar a possibilidade de BIA-ALCL. O Sistema de Relatórios e Dados de Imagiologia Mamária (Breast Imaging-Reporting and Data System [BIRADS], em inglês) foi classificado como 4 (►Fig. 2).
O procedimento cirúrgico ocorreu no dia 02/05/2022 e envolveu a retirada da prótese (texturizada) com capsulectomia total, com boa evolução no pós-operatório imediato (►Fig. 3).
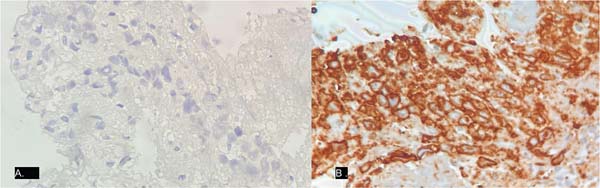
O estudo histopatológico da peça (►Figs. 4-5) revelouo seguinte laudo: “linfoma de grandes células anaplásicas associado a implante mamário. As células revestem a cápsula. Ausência de infiltração capsular ou formação de massa sólida. Reação giganto-histiocitária do tipo corpo estranho associada. A IHQ apontou positividade para CD30, CD4, CD3, CD2, granzima B e negatividade para ALK, CD20, CD8.”

A paciente teve uma evolução pós-operatória adequada e seguiu assistida pelas equipes da oncologia e hematologia do INCA, em acompanhamento com exames de sangue e imagem (tomografia por emissão de pósitrons-tomografia computadorizada, PET-CT, do inglês positron-emission tomography- computed tomography) sem evidência de doença em atividade ou necessidade de terapia adjuvante até o momento.
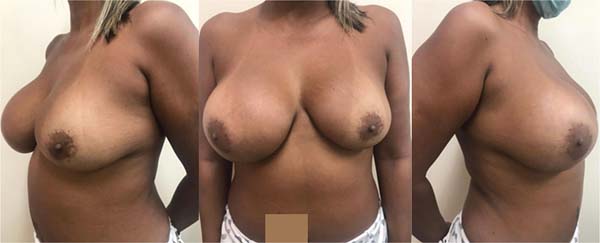
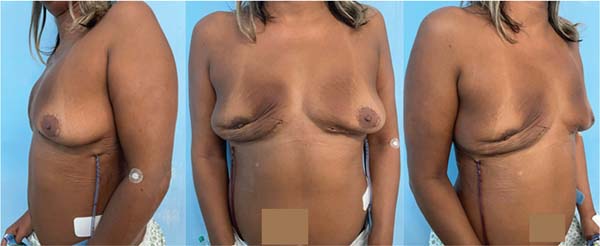
Após recuperação pós-operatória, a equipe da cirurgia plástica do INCA deliberou múltiplas sessões de lipoenxertia seriadas à paciente objetivando aumento do volume mamário. A paciente não desejava ser submetida a uma cirurgia de mastopexia nem desejava ficar cicatrizes grandes.
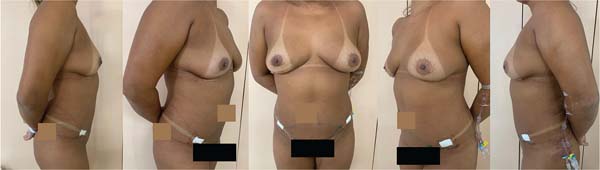
A primeira sessão de lipoenxertia foi realizada em setembro de 2023, e a segunda sessão foi realizada no início de dezembro de 2024 (►Figs. 6-7).
A paciente encontra-se satisfeita com o volume mamário obtido pós-lipoenxertias, em seguimento com as clínicas da oncologia, mastologia, hematologia e cirurgia plástica, sem evidência de novas lesões.
Discussão
Estima-se que mais de dois milhões de mulheres brasileiras tenham implantes mamários, sendo o Brasil o segundo maior mercado do mundo. No entanto, há poucas notificações de casos de BIA-ALCL.4
A etiologia não é bem definida, porém um dos processos mais considerados na literatura para o desenvolvimento do BIA-ALCL seria a contaminação bacteriana das próteses de superfície áspera/microtexturizada ou o atrito causado por essa superfície, culminando em uma resposta imunológica persistente e posterior desenvolvimento do linfoma. A teoria do desenvolvimento do câncer de uma infecção se sustenta por vários exemplos, como Helicobacter pylori, vírus de Epstein Barr, entre outros agentes que podem levar ao desenvolvimento de uma neoplasia.5 Além disso, não há relatos de casos na era pré-implantes texturizados, mesmo quando os fluidos de silicone migraram para os tecidos circundantes e produziram granulomas.6
Na maioria dos casos, o BIA-ALCL se manifesta por um seroma tardio, que ocorre de 7 a 10 anos após a cirurgia de implante. Portanto, o surgimento de seroma após um ano ou mais da cirurgia de implante e que não pode ser justificado por traumas deve ser considerado como suspeito para a doença.
Em cerca de 10 a 40% das pacientes diagnosticadas com esse linfoma, ocorre o desenvolvimento de massa e manifestações cutâneas, contratura capsular e linfadenopatia.7 A paciente do estudo apresentou como única alteração evidenciada o aumento súbito da mama direita.
O diagnóstico é baseado em exames de imagem e na análise citológica, IHQ e imunofenotípica do seroma, que se baseia na presença de células grandes de citoplasma eosinofílico apresentando pleomorfismo. No exame de IHQ, o padrão é de expressão da proteína CD30 e ausência de expressão da proteína de translocação quinase de linfoma anaplásico (anaplastic lymphoma kinase, ALK, em inglês) .8
A ultrassonografia é indicada como primeiro exame, seguida pela punção do fluido do seroma, para que seja submetido à imunocitoquímica e à análise citopatológica. A tomografia computadorizada e a ressonância magnética também podem ser incluídas no protocolo, caso os achados da ultrassonografia sejam indefinidos.
Nos casos mais raros, em que há presença de massa ao invés de um fluido (líquido), é necessária a análise anatomopatológica, para que sejam analisados fragmentos oriundos de massa capsular e pele. Em alguns casos, é feita a análise anatomopatológica de linfonodos suspeitos para a detecção de possíveis metástases. Nesse caso não foram evidenciados quaisquer sinais de doença extramamária.
O tratamento consiste basicamente na cirurgia de remoção dos implantes mamários e da cápsula. O protocolo da National Comprehensive Cancer Network (NCCN) recomenda que os cirurgiões plásticos tenham a confirmação do diagnóstico de ALCL antes de submeter a pacienteà cirurgia.4 Outro ponto importante preconizado é que seja feita a remoção dos dois implantes e cápsulas, já que existem casos descritos de aparecimento na outra mama, sendo que não é recomendada a substituição por implantes texturizados.9,10 Margens típicas utilizadas na cirurgia tradicional do câncer de mama não são necessárias. Após a excisão completa da cápsula e implantes, recomenda-se exames de vigilância a cada 3 a 6 meses e exames de imagem periódicos com tomografia de tórax, abdome e pelve ou PET-CT a cada 6 meses, durante os primeiros 2 anos. Se a excisão completa não for tecnicamente viável ou se a anatomopatologia cirúrgica revelar excisão incompleta ou capsulectomia parcial, a radioterapia local costuma ser empregada comoterapia adjuvante, na ausência de doença sistêmica.11Nos casos mais avançados, a paciente deve ser acompanhada por um oncologista que pode submetê-la a uma linfadenectomia, sendo que a quimioterapia e a radioterapia também podem ser alternativas de tratamento.
A doença é considerada de bom prognóstico, sendo a remoção total da cápsula um fator determinante para a cura. É de suma importância também que haja um plano pré-operatório e tratamento adequados com o objetivo de impedir a progressão desse linfoma. As notificações de morte de pacientes com BIA-ALCL estão associadas ao diagnóstico tardio ou a formas mais agressivas da doença, incluindo casos com nódulos tumorais, comprometimento dos linfonodos, envolvimento bilateral das mamas e infiltração na cápsula.
A reconstrução mamária após o tratamento do BIA-ALCL é viável e pode ser considerada em pacientes adequadamente selecionados. A decisão quanto ao momento e ao método da reconstrução depende da extensão da doença no período do diagnóstico, da completude da excisão cirúrgica e das preferências e fatores de risco da paciente. As possibilidades de reconstrução incluem colocação de implantes lisos, mastopexia, retalhos autólogos e enxertia de gordura.10
A paciente em questão foi submetida à retirada das próteses e capsulectomia bilateral. As duas unidades eram próteses redondas, texturizadas, em posição subglandular. Após a cirurgia, a paciente seguiu em acompanhamento pelas equipes de hematologia e oncologia do INCA, sem indicação de terapia adjuvante até o momento, e encontrase satisfeita com a proposta realizada pela equipe de cirurgia plástica.
Conclusão
Face ao exposto, concluímos que o BIA-ALCL é uma doença relativamente nova, mas de grande relevância, que necessita de cada vez mais consciência dos pacientes e da comunidade médica para que seu conhecimento, diagnóstico e tratamento sejam mais eficazes.
REFERENCES
1. Groth AK, Clemens MW, Graf R, Sebastião AP, Azambuja AP, Louveira MH, et al. Breast Implant-Associated Anaplastic Large-Cell Lymphoma in Brazil: What Are We Missing? Plast Reconstr Surg 2022;150(05):970e-978e. Doi: 10.1097/PRS. 0000000000009652
2. United States Food and Drug Administration (FDA). Medical Device Reports of Breast Implant-Associated Anaplastic Large Cell Lymphoma. Silver Spring, MA: FDA; 2024 [cited 2025 Mar 22]. Available from: https://www.fda.gov/medical-devices/breast-implants/medical-device-reports-breast-implant-associated-anaplastic-large-cell-lymphoma
3. Batista BN, Garicochea B, Aguilar VLN, Carvalho FM, Millan LS, Fraga MFP et al. Relato de caso de linfoma anaplásico de células grandes associado a implante mamário em paciente brasileira. Rev Bras Cir Plástica 2017;32(Suppl 3):445-449 Doi: 10.5935/ 2177-1235.2017RBCP0073
4. Clemens MW, Jacobsen ED, Horwitz SM. 2019 NCCN Consensus Guidelines on the Diagnosis and Treatment of Breast Implant- Associated Anaplastic Large Cell Lymphoma (BIA-ALCL). Aesthet Surg J 2019;39(Suppl 1):S3-S13. Doi: 10.1093/asj/sjy331
5. Keech JA Jr, Creech BJ. Anaplastic T-cell lymphoma in proximity to a saline-filled breast implant. Plast Reconstr Surg 1997;100(02): 554-555. Doi: 10.1097/00006534-199708000-00065
6. Brody GS, Deapen D, Taylor CR, Pinter-Brown L, House-Lightner SR, Andersen JS, et al. Anaplastic large cell lymphoma occurring in women with breast implants: analysis of 173 cases. Plast Reconstr Surg 2015;135(03):695-705. Doi: 10.1097/PRS. 0000000000001033
7. Groth AK, Graf R. Breast Implant-Associated Anaplastic Large Cell Lymphoma (BIA-ALCL) and the Textured Breast Implant Crisis. Aesthetic Plast Surg 2020;44(01):1-12. Doi: 10.1007/s00266-019-01521-3
8. Klassen AF, Cano SJ, Grotting JC, Baker SB, Carruthers J, Carruthers A, et al. FACE-Q Eye Module for Measuring Patient-Reported Outcomes Following Cosmetic Eye Treatments. JAMA Facial Plast Surg 2017;19(01):7-14. Doi: 10.1001/jamafacial.2016.1018
9. National Comprehensive Cancer Network (NCCN). NCCN Guidelines: T-Cell Lymphomas. Plymouth Meeting, PA: NCNN; 2024 Available from: https://www.nccn.org/professionals/physician_gls/pdf/t-cell.pdf
10. Lamaris GA, Butler CE, Deva AK, Miranda RN, Hunt KK Connell T, et al. Breast Reconstruction Following Breast Implant-Associated Anaplastic Large Cell Lymphoma. Plast Reconstr Surg 2019;143(3S A Review of Breast Implant-Associated Anaplastic Large Cell Lymphoma):51S-58S. Doi: 10.1097/ PRS.0000000000005569/
11. Leberfinger AN, Behar BJ, Williams NC, Rakszawski KL, Potochny JD, Mackay DR, Ravnic DJ. Breast implant-associated anaplastic large cell lymphoma: A systematic review. JAMA Surg 2017;152 (12):1161-1168. Doi: 10.1001/jamasurg.2017.4026
1. Divisão de Cirurgia Plástica, Instituto Nacional de Câncer, Rio de Janeiro, RJ,
Brasil
2. Divisão de Patologia, Instituto Nacional de Câncer, Rio de Janeiro, RJ, Brasil
Endereço para correspondência Dunia Verona, Divisão de Cirurgia Plástica, Instituto Nacional de Câncer, Rio de Janeiro, RJ, Brazil (e-mail: veronadunia@gmail.com duniaverona@hotmail.com).
Article received: March 28, 2025.
Article accepted: July 14, 2025.
Conflito de Interesses
Os autores não têm conflito de interesses a declarar.










 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter