

Reviw Article - Year 2007 - Volume 22 -
Ischemia and reperfusion of tissues
ISQUEMIA E REPERFUSÃO DE TECIDOS
ABSTRACT
The viability of tissues after a surgical aggression is a great challenge for surgeons. The ischemia leads to the blockage of blood flow in peripherical tissues, which is known as noreflow phenomenon. This vascular event is progressive, leading to formation of thrombus in microcirculation, platelet aggregation and cell and tissue swelling. The progression of this phenomenon leads to irreversibility of the injuries and necrosis of tissue. The present paper reviewed the main factors responsible for this phenomenon, its physiopathology and therapeutic possibilities.
Keywords: Ischemia. Reperfusion. Reperfusion injury
RESUMO
A viabilidade dos tecidos após uma agressão cirúrgica é um grande desafio para os cirurgiões. A isquemia leva à obstrução do fluxo sanguíneo para os tecidos periféricos, o que é conhecido pelo fenômeno de não reperfusão. Esta obstrução tem caráter progressivo, com a formação de trombos na microcirculação, agregação plaquetária, edema celular e tecidual. A progressão deste fenômeno leva à irreversibilidade das lesões e morte do tecido. O presente trabalho faz uma revisão dos principais fatores responsáveis por este fenômeno, sua fisiopatologia e possibilidades de tratamento.
Palavras-chave: Isquemia. Reperfusão. Traumatismo por reperfusão
O tempo de isquemia a que um retalho é submetido é inversamente proporcional à sua sobrevivência e à probabilidade de reversão do quadro desfavorável.
A sobrevivência de retalhos ou segmentos reimplantados depende da prevenção dos efeitos deletérios da isquemia. A isquemia pode ser definida como situação de fluxo sangüíneo arterial insuficiente às necessidades metabólicas teciduais. Os tecidos de retalhos transplantados ou membros reimplantados têm diferentes resistências à isquemia ao tempo submetido, excluindose o tecido nervoso, o tecido muscular esquelético é o menos tolerante à isquemia, sendo o primeiro tecido a apresentar sofrimento. As conseqüências anatômicas, metabólicas e fisiopatológicas da isquemia foram intensamente investigadas desde a década de setenta, e permanecem em foco até os dias de hoje. Quanto maior o tempo de isquemia, pior o prognóstico. Um tecido pode tolerar até um período máximo de isquemia e ainda sobreviver, o que é caracterizado como tempo crítico de isquemia.
MODELOS EXPERIMENTAIS
Da década de 70 até os dias atuais, este tema vem despertando o interesse de vários pesquisadores nacionais que por meio do desenvolvimento de modelos experimentais procuram entender melhor a fisiopatologia do processo isquêmico em órgãos e tecidos.
O interesse pelos aspectos limitantes da isquemia e reperfusão levou Ferreira e Leão, em 1977, a proporem um modelo experimental de reimplante de membro após amputação completa em ratos. Estudaram a perfusão do membro com solução salina, dextran, heparina e solução de Collins (solução balanceada utilizada no transplante renal) após um período de isquemia de 1 a 2 horas, não sendo observadas diferenças na vitalidade dos membros reimplantados. A isquemia e reperfusão do revestimento cutâneo foram estudadas nas décadas de 80 e 90. Gemperli, em 1985, estudou a sobrevivência de retalhos epigástricos em ratos após ligadura dos elementos do pedículo vascular (artéria ou veia) e observou que o aporte sanguíneo arterial e a drenagem venosa são indispensáveis para a sobrevivência do retalho até o quinto dia de pós-operatório. Fontana, em 1992, estudou o efeito da N2- mercaptopropionilglicina (antioxidante) em modelo de oclusão arterial e venosa de retalhos epigástricos e observou efeito protetor deste fármaco nestas situações. Prada, em 1998, utilizou o mesmo modelo de isquemia de retalho epigástrico em ratos para estudar o efeito do alopurinol, superóxido dismutase e terapia com oxigênio hiperbárico. Obteve aumento da sobrevivência dos retalhos, sugerindo um efeito protetor com estes tratamentos1.
Em 2000, Cunha et al. estudaram modelo de amputação subtotal, com preservação de vasos e nervos para o estudo da isquemia e reperfusão de membros (Figuras 1 a 5). O efeito dos fármacos trombolíticos (estreptoquinase e rt-PA), anticoagulantes (heparina), antioxidantes (alopurinol e superóxido dismutase) e antiagregantes plaquetários (dipiridamol e inibidores da glicoproteína IIb-IIIa) foi testado após 6h de isquemia de membro e observou-se um papel protetor com aumento da sobrevivência dos membros para todos os tratamentos2-6.

Figura 1 - Modelo de amputação subtotal do membro posterior direito de rato com preservação de vasos e nervos.
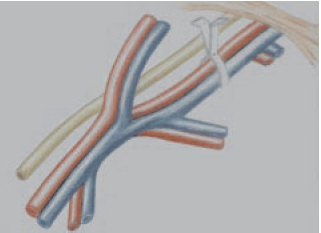
Figura 2 - Representação da aplicação do clipe vascular no feixe vascular femoral evitando o nervo femoral.
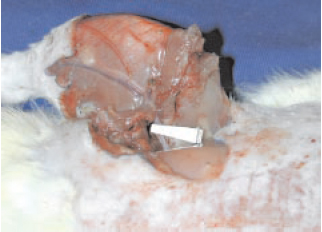
Figura 3 - Modelo de isquemia do membro. Clipe vascular aplicado em vasos femorais.
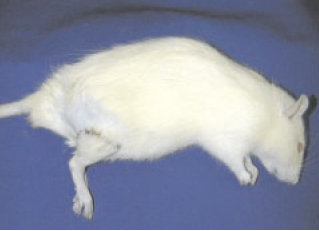
Figura 4 - Evolução para membro viável sem áreas de necrose de pele e com crescimento de pelos no 7º dia de pós-operatório.
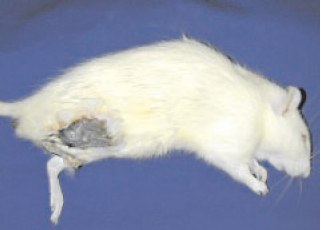
Figura 5 - Evolução para membro não viável no 7º dia de pós-operatório do modelo de isquemia.
FENÔMENO DE NÃO REPERFUSÃO ("NO-REFLOW PHENOMENON")
O tecido isquêmico continua sendo um verdadeiro desafio para o cirurgião. Além da permeabilidade das anastomoses microcirúrgicas, a circulação distal e periférica é igualmente importante para a viabilidade dos retalhos microcirúrgicos e membros amputados. A isquemia leva à obstrução do fluxo sanguíneo para os tecidos periféricos, o que é conhecido como fenômeno de não reperfusão. Esta obstrução tem caráter progressivo, com formação de trombos na microcirculação, agregação plaquetária, edema celular e tecidual. A progressão deste fenômeno leva à irreversibilidade das lesões teciduais e morte do membro ou retalho microcirúrgico5,6.
Ames et al., em 1968, descreveram o fenômeno de não reperfusão pela primeira vez. Eles observaram que o fluxo cerebral em coelhos não se restabelecia após longos períodos de isquemia, porque se seguiam alterações significativas na microcirculação com interferência no fluxo sanguíneo normal para as células cerebrais1. O fenômeno foi posteriormente confirmado em outros modelos de isquemia cerebral e demonstrado em outros órgãos, incluindo o revestimento cutâneo, músculo esquelético, rim e coração. Embora pareça claro que as anormalidades ocorrem em nível de microcirculação, o mecanismo exato do fenômeno da não reperfusão ainda não está completamente esclarecido7.
O fenômeno de não reperfusão inclui alterações na motricidade vascular, edema celular e intersticial, trombose vascular, infiltração leucocitária, produção de radicais livres do oxigênio, agregação plaquetária e atividade metabólica.
MOTRICIDADE VASCULAR
As vasoconstricções arteriolares e aberturas de "shuntings" artério-venosos ocorrem em extremidades reimplantadas e podem contribuir para a formação de áreas com pouco ou nenhum fluxo sanguíneo após reperfusão. A vasoconstricção arteriolar ocorre imediatamente após isquemia, seguida de abertura de "shuntings" arterio-venosos. O bloqueio simpático após isquemia em modelo de membro isolado leva ao aumento do fluxo arterial e perfusão do membro. Este efeito é provavelmente secundário à diminuição do espasmo arteriolar, pois não foi observada diferença no número de "shuntings" artériovenosos após o bloqueio.
EDEMA CELULAR E INTERSTICIAL
O exame microscópico de células cardíacas em áreas de não reperfusão demonstra edema celular e intersticial intensos com compressão vascular que, por vezes, obstruem a luz do vaso. Este fato explica o benefício obtido com a utilização de drogas que reduzem o edema tecidual, como a dexametasona e manitol, no fenômeno de não reperfusão. Whitney et al., em 1997, testaram a administração do fator liberador de corticotropina ("CRF") em um modelo de isquemia e reperfusão em reimplante de membro em ratos e evidenciaram redução do edema tecidual do membro após isquemia2.
TROMBOSE DA MICROCIRCULAÇÃO
Chaint et al., em 1978, sugeriram que estase, perda de fluido intravascular, meio ácido e exposição de colágeno da subíntima conseqüente à lesão endotelial poderiam resultar em trombose após o reimplante. A presença de microtrombos e a alteração do sistema fibrinolítico em vasos submetidos à isquemia prolongada são fatores contribuintes no processo de não reperfusão2. Drogas fibrinolíticas são utilizadas na microcirurgia para a prevenção de trombose em anastomoses. Dentre elas, podemos citar a uroquinase, heparina, prostaglandina E1, estreptoquinase, heparina de baixo peso molecular, "recombinant tissue plasminogen activator (rt-PA)" e fondaparinux, fazendo parte de vários protocolos de estudos. Chung et al., em 2006, mostraram em seu estudo as vantagens do uso da fondaparinux em relação ao uso da heparina de baixo peso molecular em tecidos congestos. A fondaparinux é uma das primeiras drogas anticoagulantes sintéticas que se liga seletivamente e potencializa a ação da antitrombina III, que inibe especificamente o fator X ativado na cascata da coagulação, ao passo que outros anticoagulantes (heparina) se ligam a vários fatores da cascata da coagulação. Isto faz com que a fondaparinux potencialmente elimine o risco da trombocitopenia induzida por anticorpos8.
INFILTRAÇÃO LEUCOCITÁRIA
A adesão leucocitária parece desempenhar importante função no fenômeno de não reperfusão. O acúmulo de leucócitos pode desempenhar um papel no fenômeno de não reperfusão por meio da formação de obstruções mecânicas por acúmulo intravascular ou produção de radicais livres de oxigênio. A interação entre leucócitos e células endoteliais é mediada por um grupo de glicoproteínas: P-selectina, E-selectina e L-selectina. Em fases precoces da lesão por isquemia, a P-selectina está expressa na superfície das células endoteliais. Em fases mais tardias, a P-selectina é substituída pela E-selectina e esta passa a interagir com as plaquetas que expressam a L-selectina. A administração de anticorpos monoclonais EL-246, que bloqueiam as E-selectinas e Lselectinas, aumenta a sobrevivência tecidual após isquemia e reperfusão. A fucoidina, inibidora do acúmulo de leucócitos, foi testada em modelo de retalho epigástrico em ratos após 6 horas de isquemia, sendo observado um aumento da sobrevivência dos retalhos2.
Estudos mais recentes mostram o benefício do uso do propofol como um potencial inibidor da ativação leucocitária, propriedade antioxidante e modulador de neutrófilos, aumentado a sobrevida de retalhos em ratos9.
RADICAIS LIVRES DE OXIGÊNIO
Os radicais livres de oxigênio também desempenham importante papel na patogênese da lesão tecidual após reperfusão. Resultados promissores na lesão tecidual após isquemia foram obtidos com o uso de agentes antioxidantes e similares em diferentes tecidos. Estes resultados sugerem possível benefício na prevenção dos efeitos da isquemia tecidual. Os radicais superóxido e hidroxila, metabólitos do oxigênio extremamente reativos, são formados em situações de isquemia e reperfusão. Podem causar lesão na membrana celular diretamente, por meio da peroxidação lipídica ou da degradação do colágeno intracelular. Estes radicais livres derivados do oxigênio podem desempenhar um importante papel na etiologia microvascular do fenômeno de não reperfusão, por meio da lesão citotóxica direta no endotélio vascular.
A enzima superóxido dismutase é um agente antioxidante endógeno que converte radicais livres do oxigênio em peróxido de hidrogênio. A utilização de camundongos transgênicos com produção aumentada de superóxido dismutase aumenta a sobrevivência de retalhos epigástricos submetidos à isquemia e, em camundongos com supressão do gene da superóxido dismutase, a sobrevivência é reduzida10.
O fármaco alopurinol atua como inibidor da enzima xantina oxidase, que exerce importante papel na formação de radicais livres durante a reperfusão. O alopurinol não permite a conversão das hipoxantinas derivadas do ATP em ácido úrico, reação onde o O2 é transformado em O2-. Os efeitos benéficos do alopurinol, superóxido dismutase10, oxigênio hiperbárico11-14 e outros agentes antioxidantes (glutationa15), em modelos de isquemia e reperfusão, foram descritos. O oxigênio hiperbárico aumenta a tolerância de retalhos cutâneos à isquemia, por meio do aumento da oxigenação tecidual, redução da agregação plaquetária, estímulo à angiogênese e crescimento capilar.
A terapia com oxigênio hiperbárico foi estudada por Cunha et al.4, em 2002, em modelo de amputação subtotal de membro (músculo) submetido a isquemia de 6 horas. Observaram piora na taxa de sobrevivência dos membros isquêmicos após o tratamento com o oxigênio hiperbárico, sugerindo não possuir o mesmo papel protetor evidenciado na isquemia do revestimento cutâneo como citado anteriormente e na oclusão venosa de membros, como observado por Cunha et al.4. O tempo de 6 horas é crítico para a sobrevivência muscular e a terapia com oxigênio hiperbárico poderia aumentar a isquemia por vasoconstricção e favorecer a produção de radicais livres do oxigênio, aumentando a lesão tecidual2,3,5.
AGREGAÇÃO PLAQUETÁRIA
Evidências sugerem a participação das plaquetas na patogênese do fenômeno da reperfusão. A isquemia leva à ativação e ao acúmulo de plaquetas na parede vascular da microcirculação, minutos após a reperfusão, indicando que a plaqueta é uma das primeiras células a surgir no sítio da lesão. As plaquetas ativadas geram radicais livres e liberam mediadores pró-inflamatórios, como tromboxano A2, leucotrienos, serotonina e fator de crescimento derivado do endotélio. Estudos recentes têm mostrado benefícios com o uso do fator de crescimento de endotélio, ativando a angiogênese e assim promovendo melhora na microcirculação tecidual16-18.
Algumas substâncias secretadas pelas plaquetas podem levar à vasoconstrição e redução do fluxo sanguíneo capilar. As plaquetas têm o potencial de modular as respostas leucocitárias e, de certa forma, uma vez ativadas, quando aderidas às células endoteliais após isquemia, podendo agravar a lesão endotelial ao contribuir para a ativação e recrutamento de leucócitos para o sítio da lesão.
Não se conhece a exata função das plaquetas no fenômeno de não reperfusão, em particular o seu comportamento in vivo e os mecanismos moleculares envolvidos. As plaquetas carregam várias moléculas de adesão necessárias para as interações intercelulares, como P-selectina e várias integrinas, como as glicoproteínas Ib e IIb/IIIa. As glicoproteínas Ib são essenciais para a adesão plaquetária à matriz subendotelial, formando ligações com o fator de von Willebrand (fvW). As glicoproteínas IIb/IIIa, por meio de ligações com o fibrinogênio, formam as adesões entre as plaquetas, promovendo a agregação plaquetária. A P-selectina parece desempenhar importante papel no acúmulo das plaquetas na microcirculação após isquemia. O efeito deletério das plaquetas na reperfusão depende diretamente da sua ativação com a expressão da P-selectina.
Os antiagregantes têm sido utilizados clinicamente em síndromes trombóticas e na microcirurgia. O dextran, inicialmente introduzido em 1944 como expansor plasmático, tem efeito antiagregante plaquetário muito bem documentado e tem sido amplamente utilizado na prática clínica. A sua utilização, em modelo de trombose vascular com inversão de segmento de artéria femoral em coelhos, aumentou a taxa de permeabilidade vascular, reduziu a agregação plaquetária e depósitos de fibrina à microscopia eletrônica1.
Os antagonistas da glicoproteína IIb/IIIa são mais potentes que a aspirina na inibição da função plaquetária e redução dos eventos vasculares trombóticos, em modelos animais e estudos clínicos em angioplastia coronariana. Kuo et al.19, em 2002, estudaram o efeito do abciximab, anticorpos monoclonais murinos anti-glicoproteína IIb/IIIa, em modelo de isquemia no retalho cutâneo epigástrico em ratos. Observaram redução da agregação plaquetária induzida por adenosina-difosfato (ADP) e aumento da viabilidade final dos retalhos com redução da expressão da P-selectina nas plaquetas sanguíneas, indicando redução da ativação e adesão plaquetária.
Cunha1, em 2003, avaliou o efeito dos inibidores da glicoproteína IIb/IIIa (abciximab e tirofiban) na viabilidade dos membros, num modelo experimental de amputação subtotal de membro em ratos submetidos a isquemia quente e verificou que estas drogas elevaram a taxa de viabilidade dos membros submetidos a isquemia de 6 horas de 30% (grupo sem tratamento) para 77,78% (grupo tratado com abciximab) e 80,95% (grupo tratado com tirofiban).
ATIVIDADE METABÓLICA
A hipotermia tem sido considerada fator fundamental na manutenção da viabilidade do tecido isquêmico. Vários autores têm demonstrado que a preservação de membros isquêmicos em hipotermia prolonga a viabilidade do músculo esquelético isquêmico e diminui a incidência da síndrome de reperfusão pós-operatória. O mecanismo proposto para os efeitos benéficos da hipotermia no tecido em anóxia é a redução da atividade metabólica celular, conservando as reservas energéticas críticas e mantendo o mínimo de substâncias tóxicas. A hipotermia também desempenha funções benéficas durante a fase de reperfusão. Quando aplicada ao tecido muscular na fase inicial da reperfusão, leva ao aumento da viabilidade tecidual com redução do infiltrado neutrofílico e possível redução do potencial oxidativo20.
CONCLUSÃO
A isquemia e reperfusão envolvem a ativação de diversos mecanismos, compondo uma complexa rede de acontecimentos que constituem o fenômeno de não reperfusão. A atuação em diversas etapas destes acontecimentos poderia reduzir a lesão tecidual e evitar a perda do membro ou retalho isquêmico.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Cunha MS. Efeito de inibidores da glicoproteína IIb/IIIa em modelo de amputação subtotal de membro submetido a isquemia quente: estudo experimental em ratos [Tese de doutorado]. São Paulo:Universidade de São Paulo, Faculdade de Medicina;2003. 84p.
2. Silva JCF, Simão DT, Lima LG, Cunha MS, Wada A, Nakamoto H, et al. Modelo experimental de reimplante de membro após isquemia quente em ratos e efeito da estreptoquinase, alopurinol e terapia com oxigênio hiperbárico. Rev Med. (São Paulo)2001;80(2/4):78-88.
3. Cunha MS, Silva JC, Nakamoto HA, Fels KW, Ferreira MC. Estreptoquinase e oxigênio hiperbárico em congestão após reimplante de membro. Rev Assoc Med Bras. 2007;53(1):29-33.
4. Cunha MS, Silva JCF, Nakamoto HA, Fels KW, Ferreira MC. Oclusão venosa em reimplante de membro: um modelo experimental em ratos. Rev Soc Bras Cir Plást. 2005;20(3):155-9.
5. Cunha MS, Silva JCF, Nakamoto HA, Simão DT, Ferreira MC. Efeito do alopurinol e terapia com oxigênio hiperbárico em modelo de reimplante de membro após isquemia quente em ratos. Rev Col Bras Cir. 2005;32(2):64-8.
6. Cunha MS, Silva JC, Nakamoto HA, Ferreira MC. Study of warm ischemia followed by reperfusion on a lower limb model in rats: effect of allopurinol and streptokinase. Clinics. 2005;60(3):213-20.
7. Ozkan O, Coskunfirat OK, Dogan O, Ozgentas HE. A reverse-flow composite flap in the rat. J Plast Reconstr Aesthet Surg. 2007;60(5):556-62.
8. Chung TL, Holton LH 3rd, Silverman RP. The effect of fondaparinux versus enoxaparin in the survival of a congested skin flap in a rabbit model. Ann Plast Surg. 2006;56(3):312-5.
9. Tyney TR, Shahbazian R, Nakashima J, Kane S, Sian K, Yamaguchi KT. Propofol improves skin flap survival in a rat model: correlating reduction in flap-induced neutrophil activity. Ann Plast Surg. 2004;53(3):273-7.
10. Klein MB, Chan PH, Chang J. Protective effects of superoxide dismutase against ischemia-reperfusion injury: development and application of a transgenic animal model. Plast Reconstr Surg. 2003;111(1):251-7.
11. Ulkur E, Karagoz H, Ergun O, Celikoz B, Yildiz S, Yildirim S. The effect of hyperbaric oxygen therapy on the delay procedure. Plast Reconstr Surg. 2007;119(1):86-94.
12. Friedman HI, Fitzmaurice M, Lefaivre JF, Vecchiolla T, Clarke D. An evidence-based appraisal of the use of hyperbaric oxygen on flaps and grafts. Plast Reconstr Surg. 2006;117(7 suppl):175S-92.
13. Richards L, Lineaweaver WC, Stile F, Zhang J, Zhang F. Effect of hyperbaric oxygen therapy on the tubed pedicle flap survival in a rat model. Ann Plast Surg. 2003;50(1):51-6.
14. Hong JP, Kwon H, Chung YK, Jung SH. The effect of hyperbaric oxygen on ischemia-reperfusion injury: an experimental study in a rat musculocutaneous flap. Ann Plast Surg. 2003;51(5):478-87.
15. Kopal C, Deveci M, Ozturk S, Sengezer M. Effects of topical glutathione treatment in rat ischemic wound model. Ann Plast Surg. 2007;58(4):449-55.
16. Zhang F, Brooks D, Chen W, Mustain W, Chen MB, Lineaweaver C. Improvement of venous flap survival by application of vascular endothelial growth factor in a rat model. Ann Plast Surg. 2006;56(6):670-3.
17. Erdmann D, Sweis R, Wong MS, Niklason LE, Laney TV, Levin LS, et al. Vascular endothelial growth factor expression in pig latissimus dorsi myocutaneous flaps after ischemia reperfusion injury. Plast Reconstr Surg. 2003;111(2):775-80.
18. Meirer R, Huemer GM, Oehlbauer M, Wanner S, Piza- Katzer H, Kamelger FS. Comparison of the effectiveness of gene therapy with vascular endothelial growth factor or shock wave therapy to reduce ischaemic necrosis in an epigastric skin flap model in rats. J Plast Reconstr Aesthet Surg. 2007;60(3):266-71.
19. Kuo YR, Jeng SF, Wang FS, Huang HC, Wei FC, Yang KD. Platelet glycoprotein IIb/IIIa receptor antagonist (abciximab) inhibited platelet activation and promoted skin flap survival after ischemia/reperfusion injury. J Surg Res. 2002;107(1):50-5.
20. Mowlavi A, Neumeister MW, Wilhelmi BD, Song YH, Suchy H, Russel RC. Local hypothermia during early reperfusion protects skeletal muscle from ischemia-reperfusion injury. Plast Reconstr Surg. 2003;111(1):242-50.
I. Professor Doutor da Disciplina de Cirurgia Plástica da Faculdade de Medicina da UFBA. Coordenador do Serviço de Cirurgia Plástica do Hospital Universitário Prof. Edgard Santos da Faculdade de Medicina da Universidade Federal da Bahia, Titular da SBCP, CBC e SBQ.
II. Médico Residente do Serviço de Cirurgia Plástica da UFBA.
Correspondência para:
Marcelo Sacramento Cunha
Rua João das Botas, 89 - Apto 601
Canela, Salvador - BA - Brasil - CEP: 40110-160
Tel: 0xx71-3328-4884 - Fax: 0xx71 3328-7781
E-mail: cunha.ms@pop.com.br
Trabalho realizado na Disciplina de Cirurgia Plástica da Faculdade de Medicina da Universidade Federal da Bahia - UFBA e Serviço de Cirurgia Plástica do Hospital Universitário Prof. Edgard Santos - UFBA, Salvador, BA.
Artigo recebido: 17/05/2007
Artigo aprovado: 07/08/2007


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter