

35ª Jornada Sul Brasileira de Cirurgia Plástica - Year 2019 - Volume 34 - (Suppl.1)
Escobar syndrome - rare and attenuated form of multiple pterygium syndrome
Síndrome de Escobar - forma rara e atenuada da síndrome do pterígio múltiplo
ABSTRACT
The Escobar syndrome is the attenuated form of multiple pterygium syndrome. The main symptoms are: delayed growth or short stature, neck pterygium, arms, legs and genital anomalies, congenital heart problems, besides decrease in muscle mass. Children support is interdisciplinary and directed to deformities found. In spite of this, the syndrome is rare and there are few studies about it; plastic surgery is the main part of the surgical treatment for this patients and can support a greater physic and motor development of this children.
'Keywords: Plastic surgery; Medical genetics; Interdisciplinary communication
RESUMO
A síndrome de Escobar é a forma atenuada da síndrome do pterígio múltiplo. As características clínicas dessa síndrome incluem: retardo do crescimento ou baixa estatura, pterígio do pescoço, axila, antecubital, região poplítea e intercrural. Múltiplas contraturas articulares (artrogriposes), sindactilia e campodactilia dos dedos, escoliose e cifoescoliose, fusão de vértebras cervicais, deformidades dos pés, anomalias genitais, defeitos cardíacos congênitos, além de redução da massa muscular também já foram relatados. O manejo dessas crianças é multidisciplinar e diretamente relacionado às deformidades encontradas. Apesar da síndrome de Escobar ser rara e ainda pouco estudada na literatura, o cirurgião plástico destaca-se no manejo cirúrgico desses pacientes, podendo, por meio de seu arsenal cirúrgico, propiciar um maior desenvolvimento físico e motor desses pacientes.
Palavras-chave: Cirurgia plástica; Genética médica; Comunicação interdisciplinar
INTRODUÇÃO
Existem duas formas diferentes da síndrome do pterígio múltiplo, as quais são diferenciadas pela sua gravidade clínica. A forma letal é tipicamente fatal no segundo ou terceiro trimestre de gestação. Se a criança nascer, será natimorta ou morrerá no período neonatal precoce. Hipoplasia pulmonar é considerada a principal causa primária de mortalidade nesses casos3. Neonatos com a forma letal da síndrome dos pterígios múltiplos, que é menos comum, geralmente tem fendas labiopalatinas, grandes higromas císticos, edema fetal progressivo (hidropisia fetal) ou hipoplasia pulmonar, e acabam falecendo na metade da gestação4. Já a síndrome de Escobar é a forma atenuada da síndrome do pterígio múltiplo. Nesses pacientes, contraturas articulares geralmente afetam o pescoço, dedos, braços, cintura dorso e joelhos3. A síndrome dos pterígios múltiplos foi descrita pela primeira vez por Matolcsy na década de 80 e, após, seu espectro fenotípico foi discutido em vários relatos3 mas essa síndrome foi descrita mais precisamente em 1978 por Escobar, e então sua forma não letal passou a ser conhecida como síndrome de Escobar. Sua prevalência é desconhecida, mas sabe-se que é muito rara. A síndrome de escobar é uma entidade muito rara, em meados dos anos 80 haviam sido descritos menos de 25 casos e em 2010 haviam sido descritos cerca de 100 casos a nível mundial5. A síndrome de Escobar é usualmente diagnosticada intraútero no ultrassom fetal e após confirmada no período neonatal4. A transmissão genética dessa síndrome é geralmente autossômica recessiva, embora herança autossômica dominante ligada ao X também já tenha sido descrita1.
OBJETIVO
Revisão da literatura a respeito dessa síndrome rara e descrição de um caso clínico em acompanhamento no Hospital Santo Antônio da Santa Casa de Misericórdia de Porto Alegre.
MÉTODO
A revisão bibliográfica foi realizada na base de dados PubMed, Scielo e Bireme. Foram seguidas as normas de Atlanta para pesquisa com seres humanos e as normas do Comitê de Ética da Universidade Federal de Ciências da Saúde de Porto Alegre. Além disso, foi aplicado um termo de consentimento, sendo a paciente e familiares cientes e de acordo com o estudo.
RESULTADOS
Relato de caso
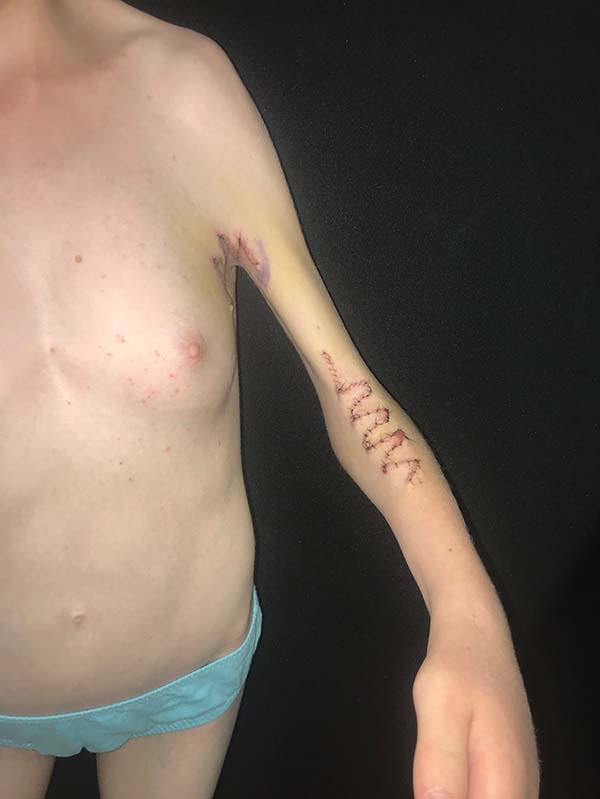
Paciente gerada por casal não consanguíneo, mãe com 35 anos na época, G2P2 e pai com 36 anos. Fez pré-natal corretamente, nega comorbidades e exposição teratogênica na gestação. Paciente nasceu de termo, pesando 2.550 g, no interior do Rio Grande do Sul. Ao nascer, diagnosticadas bridas cervicais axilares e cubitais, além de deformidades ortopédicas, sendo então encaminhada imediatamente ao Hospital Nossa Senhora da Conceição de Porto Alegre para investigação. Realizou cariótipo XX, sem alterações e diversos exames, sendo avaliada pela genética desse hospital que diagnosticou síndrome de Escobar. A paciente foi submetida a cirurgia torácica aos 4 meses e correção de pés e retrações nas pernas ainda nos primeiros meses de vida. Em 2012 realizou a primeira zetaplastia em axila D, apresentando melhora importante da mobilidade, associada a tratamento com fisioterapia. Em 2017 foi submetida a correção da escoliose com colocação de placas e 18 pinos na artrodese. Agora com 15 anos, foi submetida a zetaplastias em axila e região cubital, a fim de permitir maior amplitude de movimento e desse modo facilitar seu desenvolvimento neuropsicomotor.
DISCUSSÃO
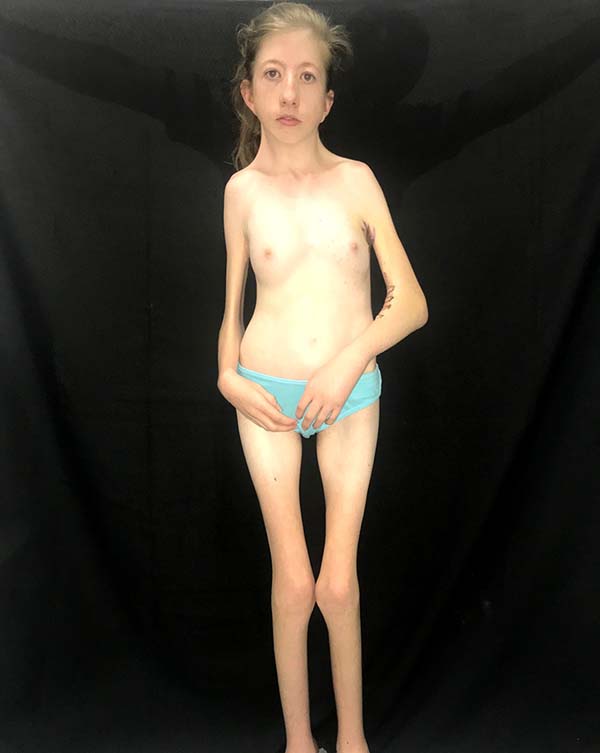
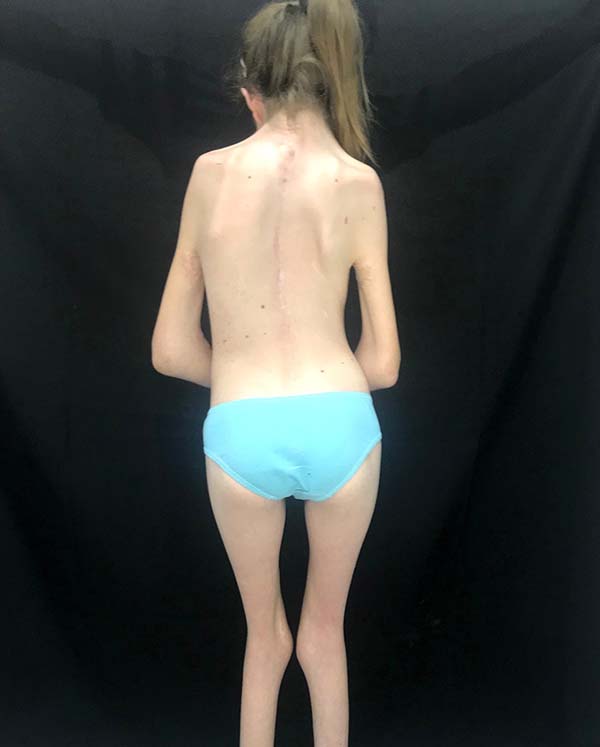
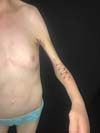
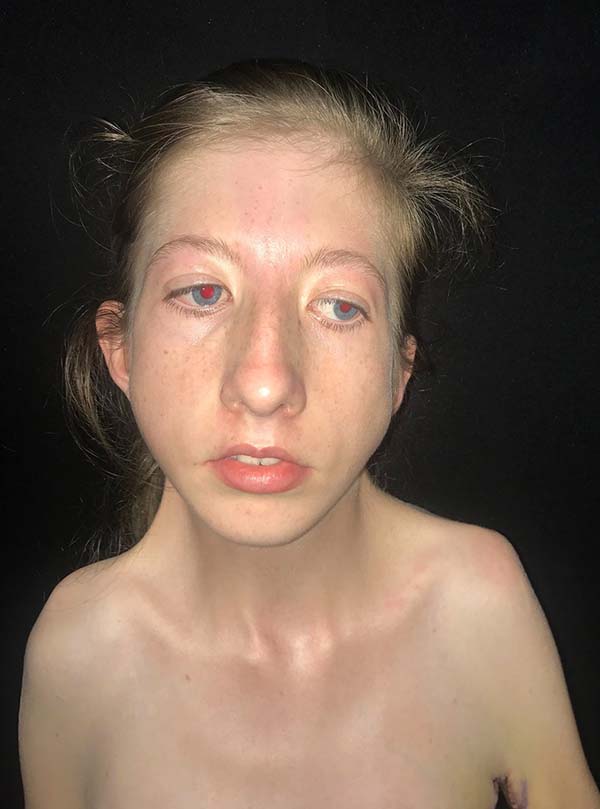
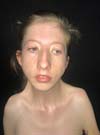
As características clínicas dessa síndrome incluem retardo do crescimento ou baixa estatura, pterígio do pescoço, axila, antecubital, região poplítea e intercrural. Múltiplas contraturas articulares (artrogriposes), sindactilia e campodactilia dos dedos, escoliose e cifoescoliose, fusão de vértebras cervicais, deformidades dos pés, anomalias genitais, defeitos cardíacos congênitos e redução da massa muscular também já foram relatados1 (Figura 1). Defeitos cardíacos congênitos são encontrados em aproximadamente 25% dos pacientes8, enquanto retardo mental não tem sido considerado parte dessa desordem. Entretanto, 6,7% dos pacientes se apresentaram com essa complicação7. A intensa contração da pele e musculatura causada pela inserção de pterígios do pescoço na base da mandíbula alteram o padrão de crescimento facial na síndrome de Escobar e podem levar a alterações craniofaciais severas, as quais limitam a abertura e mobilidade bucal. Como esses pacientes necessitam de múltiplas cirurgias para reparo das deformidades diagnosticadas, por exemplo fenda palatina, bridas e deformidades ortopédicas, uma via aérea difícil deve ser investigada e prevista1 (Figura 3). Durante a avalição pré-operatória, fatores que dificultam a via aérea como micrognatia, anquiloglossia, restrição da abertura bucal, bridas cervicais e fenda palatina devem ser avaliadas para decidir por um ótimo plano de manejo da via aérea. O manejo da via aérea desses pacientes torna-se mais difícil à medida que a criança fica mais velha devido ao aumento da deformidade da via aérea causada pelo pterígio e contraturas. Embora o manejo da via aérea na maioria das síndromes congênitas se torna mais fácil a medida que a criança cresce, ocorre o contrário na síndrome dos múltiplos pterígios3.
Apesar de Escobar, em 1978, ter afirmado suspeitar do padrão de herança autossômico dominante, a maioria dos relatos concordam que possivelmente se trata de um padrão de herança autossômico recessivo ou então ligado ao X. Além disso, na grande maioria dos casos relatados, os pacientes apresentavam a mutação no gene CHRNG mas sem alterações cromossômicas; os cariótipos desses pacientes eram normais. Entretanto, um estudo descreve um caso de alteração cariotípica típica de Klinefelter, porém com fenótipo característico de síndrome de Escobar8. A análise cromossômica revelou um cariótipo não mosaico XXY. Interessante que o paciente não apresentava as principais características clínicas de Klinefelter. As características tipicamente associadas em pacientes com Klinefelter são alta estatura com proporções corporais eunucas, hipogenitálias, déficits de aprendizagem e problemas de linguagem; enquanto uma baixa estatura é frequentemente vista na síndrome do pterígio múltiplo, e apenas raramente vista em pacientes com síndrome de Klinefelter8. A mutação mais comum na síndrome do pterígio múltiplo neonatal está no gene CHRNG, que está envolvido na formação da subunidade gama do receptor de acetilcolina. A forma letal pode estar também associada com essa mutação genética. Esse receptor de acetilcolina é essencial na sinalização entre as células musculares, que são necessárias para o movimento. Essa mutação causa acinesia fetal, resultando na formação de pterígio (bridas) e contraturas congênitas das articulações3. Mutação no gene CHRNG leva à redução do movimento fetal em períodos sensíveis do desenvolvimento fetal geralmente por volta de 33 semanas, quando esse gene é expresso. Mutação autossômica recessiva significa que ambos, mãe e pai, carregam um dos genes mudados para síndrome do pterígio múltiplo. Para gestações futuras, o feto tem 25% de chance de ser afetado, 50% chance de ser carreador do gene mutado e 25% de chance de ser normal4.
No diagnóstico diferencial deve-se tomar cuidado para distinguir a síndorme do pterígio múltiplo da hipoplasia femoral, síndromes faciais raras, síndrome de Noonan, síndrome de Turner, síndrome de Leopard, displasia craniotarsocarpal e sequência de acinesia fetal8. O manejo dessas crianças é multidisciplinar e diretamente relacionado às deformidades encontradas4. Mais comumente essas crianças necessitam de pediatras, geneticistas e ortopedistas na abordagem das deformidades articulares comumente presentes como pé torto congênito, escoliose e artrogripose, eventualmente cirurgia torácica se presente pectus excavatum; porém, comumente serão referenciadas ao cirurgião plástico para abordagem das alterações cutâneas ou craniofaciais que são comumente identificadas (Figura 2). O cirurgião plástico destaca-se na abordagem desses pacientes no tratamento de fendas palatinas, se presentes, e na abordagem das bridas articulares, por meio de zetaplastias, retalhos de pele e expansores cutâneos, possibilitando alongamento da pele nessas regiões de modo a permitir uma maior amplitude de movimento, a fim de possibilitar um maior desenvolvimento motor e habilidades nesses pacientes (Figura 4). Associado ao tratamento cirúrgico, essas crianças precisarão de fisioterapia intensa e terapia ocupacional para o manejo do maior desenvolvimento motor4.
O aumento da preocupação com a síndrome do pterígio múltiplo pode levar ao diagnóstico precoce, que permite um tratamento mais efetivo e aconselhamento genético desses pacientes. Apesar da síndrome do pterígio múltiplo ser muito rara, é importante realizar uma análise cariotípica a fim de excluir anormalidades cromossômicas8 e pesquisa da mutação do gene CHRNG. Na abordagem cirúrgica desse paciente, a equipe cirúrgica assistente e a equipe de anestesia deverão estar preparada para prever e manejar via aérea difícil comumente encontrada nesses pacientes.
CONCLUSÃO
Apesar da síndrome de Escobar ser rara e ainda pouco estudada na literatura, o cirurgião plástico destaca-se no manejo cirúrgico desses pacientes, podendo, por meio de seu arsenal terapêutico, propiciar um maior desenvolvimento físico e motor desses pacientes. Além disso, pode auxiliar no diagnóstico das deformidades e correto encaminhamento desses pacientes aos profissionais adequados, para que essas crianças tenham todo suporte e possam tornar-se independentes e desenvolvidas.
REFERÊNCIAS
1. Marques FBC, de Morais LS, et al. Cleft Palate Craniofac J; 2019 jan 17.
2. Hasegawa A, Hanaoka M, et al. J Med Ultrason. 2017 jul; 44(3):271-3.
3. Sethi P, Bhatia PK, et al. Saudi J Anaesth. 2016 jul-set; 10(3):350-2. PMID: 27375397
4. Bissinger RL, Koch FR. Adv Neonat Care. 14(1):24-9.
5. Camarena CA, Vernis AM, et al. Rev Mex Ortop Ped. 2010; 12(1):59-62.
7. Escobar V, Weaver D. J Med Genet. 1978; 15:35-42.
8. Nur BG, Altiok-Clark O, et al. Turk J Pediatr. 2013; 55:559-63.
1. Universidade Federal de Ciências da Saúde de
Porto Alegre, Porto Alegre, RS, Brasil.
2. Santa Casa de Misericórdia de Porto Alegre,
Porto Alegre, RS, Brasil.
Endereço Autor: Caroline Battisti Rua Professor Annes Dias,135 - Centro Histórico,Porto Alegre, RS, Brasil CEP 90040-001 E-mail: caroline.battisti@hotmail.com



 Read in Portuguese
Read in Portuguese
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter