
Original Article - Year 2007 - Volume 22 -
Animal model of keloids using genetically modified fibroblasts
MODELO ANIMAL DE QUELÓIDE UTILIZANDO FIBROBLASTOS MODIFICADOS GENETICAMENTE
ABSTRACT
Introduction: There is little understanding of the molecular mechanisms leading to the formation of keloids or hypertrophic scars, nor is there an adequate animal model for their study, as they occur only in humans. A leading theory proposes that upregulation of TGF-B leads to the formation of these scars. Objective: To create an animal model of keloid using genetically modified cells encoding TGF-B.
Methods: Normal human dermal fibroblasts were genetically modified to overexpress TGF-B as either the wild type latent molecule or as a mutant active molecule. The transfected fibroblasts and controls were implanted intradermally into athymic mice and fibrotic tissue formation by these cells was analyzed at various time points by histology and immunostaining. Results: After intradermal injection into athymic mice, only those fibroblasts expressing active TGF-B formed "keloid-like" nodules containing collagen and fibronectin. These structures persisted longer microscopically than implants of control fibroblasts or fibroblasts overexpressing latent TGF-B, but eventually regressed. Conclusions: The injection of transfected fibroblasts encoding TGF-B led to formation of keloid-like nodules in athymic mice skin. TGF-B needs to be in the active form to produce the fibrotic nodules.
Keywords: Keloid. Models, animal. Fibroblasts. Fibroblast growth factors
RESUMO
Introdução: Existe pouco entendimento a respeito dos mecanismos moleculares que levam à formação dos quelóides e cicatrizes hipertróficas, assim como não existe um modelo animal adequado para seu estudo, visto que só ocorrem em humanos. A teoria mais aceita propõe que um aumento na regulação do TGF-B leva à formação dessas cicatrizes. Objetivo: Criar um modelo animal de quelóide utilizando células geneticamente modificadas codificando o TGF-B. Método: Fibroblastos dérmicos humanos foram geneticamente modificados para aumentarem a expressão de TGF-B na forma selvagem ou latente ou na forma mutante ou ativa. Os fibroblastos transfectados foram transplantados intradermicamente em camundongos atímicos, e a formação de tecido fibroso analisada em diferentes intervalos de tempo por meio de histologia e imunohistoquímica. Resultados: Após a injeção intradérmica nos camundongos atímicos, apenas os fibroblastos expressando a forma ativa do TGF-B formaram nódulos "quelóide-like", contendo colágeno e fibronectina. Estas estruturas persistiram microscopicamente por mais tempo que os implantes dos fibroblastos controle e os expressando a forma latente do TGF-B. Conclusões: A injeção de fibroblastos transfectados codificando o TGF-B levou à formação de nódulos semelhantes ao quelóide na pele de camundongos atímicos. O TGF-B precisa estar em sua forma ativa para produzir os nódulos fibróticos.
Palavras-chave: Quelóide. Modelos animais. Fibroblastos. Fatores de crescimento de fibroblastos
A fibrose durante o processo de cicatrização da pele se apresenta clinicamente como quelóide e cicatriz hipertrófica. O quelóide é a forma mais exuberante desse processo e se desenvolve exclusivamente em humanos. Apesar das inúmeras opções terapêuticas, como corticóides, radiação, laser, cirurgias e interferon, a recorrência do quelóide é freqüente, variando de 40 a 100%1.
Existe pouco entendimento sobre os mecanismos moleculares que levam à formação dos quelóides e cicatrizes hipertróficas, assim como há falta de um modelo animal adequado para seu estudo, visto que eles só se desenvolvem em humanos. Teorias recentes propõem que o aumento na expressão do Fator de Crescimento Transformante beta 1 (TGF-B), leva ao aumento da proliferação celular e à síntese de matriz excessiva2-5. Ele é uma das principais citoquinas que estimulam a produção de colágeno e de outros componentes da matriz extracelular, assim como também a proliferação celular.
Devido à inexistência de um modelo animal para o estudo da etiologia do quelóide e da cicatriz hipertrófica, a maioria dos estudos tem sido realizada em culturas de células e tecidos dessas lesões, mostrando um aumento da expressão do TGF-B. Por este motivo, este estudo teve por objetivo avaliar diretamente o papel do aumento da produção de TGF-B na formação do quelóide. Para tanto, foi utilizado um modelo de implante de fibroblastos dérmicos humanos, modificados geneticamente para aumentar a produção de TGF-B, em camundongos atímicos e avaliada a formação de tecido queloideano na pele.
MÉTODO
Modificação genética
A modificação genética foi realizada em fibroblastos dérmicos humanos obtidos de postectomias de recém-nascidos, utilizando-se dois vetores retrovirais que codificavam o TGF- b1, conforme descrito anteriormente6 (Aprovado pelo Comitê de Ética do Hospital). O primeiro retrovírus codificava o TGF-ß1 na sua forma selvagem, em forma não ativada, que é a forma produzida e secretada normalmente pelas células humanas. O segundo retrovírus codificava o TGF-ß1 em uma forma mutante, já em sua forma ativa. As células modificadas geneticamente foram avaliadas quanto à produção do fator de crescimento por meio do método de ELISA.
Preparação e Implante das Células Modificadas Geneticamente
Foram utilizados camundongos atímicos da linhagem Tac:Cr: (MCr)-Fox1nu, machos, entre 5 e 6 semanas de vida. Todos os procedimentos foram aprovados pelo Comitê de Ética Animal e seguidas as normas do Guia para Cuidado e Uso de Animais de Laboratório, do National Institute of Health (NIH) dos EUA.
Os fibroblastos não modificados e os modificados geneticamente foram expandidos em cultura. Foram implantadas 1 x 106 células em 0,1 ml de DMEM (meio de Eagle modificado por Dulbecco) em seringas de 1 ml com agulhas de 28-gauge, em cada ponto. Foram utilizados 28 animais, sendo cada injetado com duplicatas de cada grupo de células e do controle do veículo de injeção. Os animais foram sacrificados pela inalação de gás carbônico após 3, 7, 10, 14, 21, 28 e 56 dias da injeção. Para cada dia de estudo, foram sacrificados 4 animais. A pele do dorso de cada animal foi incisada em sua espessura total ao redor do grupo das áreas injetadas com as células.
Histologia e Imunohistoquímica
Uma das áreas dissecadas de cada grupo de cada animal foi fixada em formalina a 10% e corada com hematoxilinaeosina. A outra peça foi embebida em meio para corte, Tissue- Tek e congelada a -80oC, para realização de imunohistoquímica para avaliar a constituição dos nódulos formados pelas células do grupo ativo. Para a avaliação da presença das células humanas, os cortes foram encubados com anticorpo monoclonal de camundongo antivimentina. Para avaliação da constituição do tecido dos nódulos formados, foram utilizados um anticorpo anticolágeno do tipo I humano e antifibronectina, fração IST-9.
RESULTADOS
Achados macroscópicos
Três dias após o implante, as células do grupo latente e ativo formaram nódulos macroscópicos que eram visíveis tanto no lado interno quanto externo da pele. Após 7, 10 e 14 dias do implante, os nódulos eram evidentes apenas nas células do grupo ativo, e pareciam estar contraídos e com consistência mais firme. Após 21 dias, os nódulos não eram evidentes macroscopicamente em nenhum grupo celular. Notava-se, também, intensa vascularização no grupo ativo, no primeiro dia de sacrifício que se seguiu nos dias 7 e 10 (Figura 1).
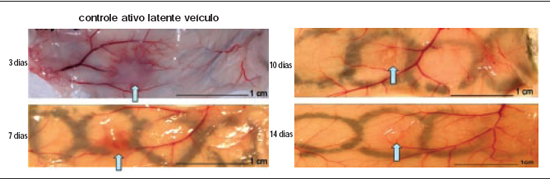
Figura 1 - Aspecto macroscópico da face interna da pele de espessura total do dorso dos camundongos, evidenciando as áreas injetadas com os grupos de células em estudo. As flechas indicam a formação de nódulos.
Achados histológicos
Com 3 e 7 dias de implante, as áreas dos 3 grupos de células puderam ser identificadas, contendo grande número de células e pouca organização tecidual. A presença de vasos sanguíneos era mais importante no grupo ativo. A partir do décimo dia, foi difícil identificar com certeza as áreas injetadas das células controle e do grupo latente, ao contrário das células do grupo ativo, que formaram nódulos distintos, mais evidentes com 14 dias. O nódulo também estava "encapsulado" por tecido conectivo. Os nódulos formados pelas células ativas persistiram até 28 dias, mas diminuíram consideravelmente em tamanho. Com 56 dias de implante, nenhum nódulo foi evidenciado tanto macro quanto microscopicamente, nos 3 grupos celulares (Figura 2).
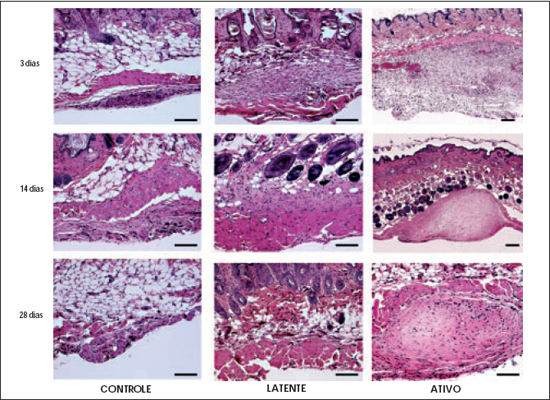
Figura 2 - Microscopia óptica. Cortes corados com hematoxilina-eosina após injeção intradérmica das células dos 3 grupos, em diferentes dias. Barra: µ.
Imunohistoquímica
A histoquímica confirmou que, em todos os dias de sacrifício, para todos os grupos, havia presença de células humanas, sendo que as células controle e do grupo latente estavam em menor número do que as do grupo ativo (Figura 3). As células do grupo ativo, por sua vez, estavam geralmente confinadas em um nódulo, entremeadas por um tecido conectivo bem visível, nos dias 10, 14 e 21 após o implante. Com a reação imunohistoquímica notou-se que a produção de colágeno estava presente nos nódulos formados pelo grupo ativo e foi maior onde existia maior concentração de células humanas (Figura 4). Também em cortes seriados do grupo ativo, onde a formação do nódulo era evidente, avaliou-se a presença de fibronectina fração IST-9. Notou-se uma distribuição homogênea por todo nódulo, não havendo relação com a localização das células. A fibronectina era muito mais abundante que o colágeno do tipo I (Figura 5).
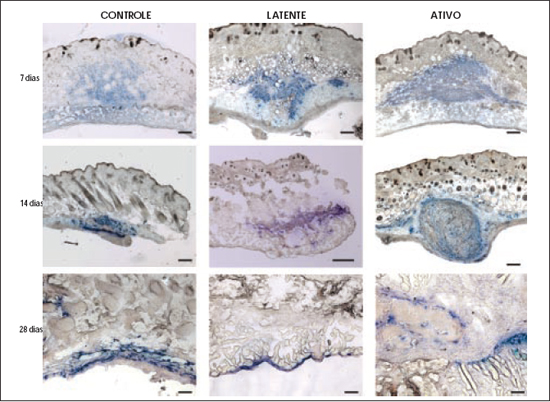
Figura 2 - Microscopia óptica. Cortes corados com hematoxilina-eosina após injeção intradérmica das células dos 3 grupos, em diferentes dias. Barra: µ.
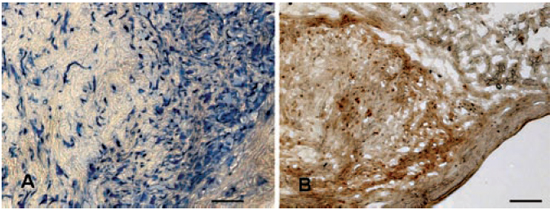
Figura 4 - Cortes frescos congelados avaliados por meio de imunohistoquímica. À esquerda, um corte testado para vimentina humana e corado com TMB. As células humanas são coradas em azul. À direita, corte seriado avaliado para colágeno do tipo I humano e corado com DAB. A coloração amarronzada corresponde ao colágeno (microscopia óptica comum). Barra: µ.
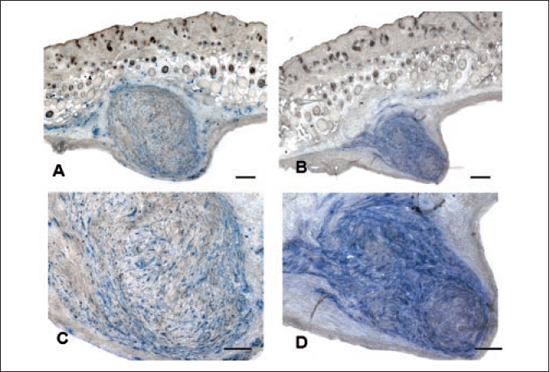
Figura 5 - Cortes frescos congelados avaliados por meio de imunohistoquímica. À esquerda (A e C), cortes testados para vimentina humana e corados com TMB. As células humanas são coradas em azul. À direita (B e D), cortes seriados avaliados para fibronectina IST- 9 humana e corado com TMB. Todo tecido corado em azul corresponde à fibronectina (microscopia óptica comum). Barra: µ.
DISCUSSÃO
O estudo in vivo da fibrose durante a cicatrização, principalmente do quelóide, com modelos animais ainda está muito limitado, devido a estas afecções se desenvolverem apenas em humanos. Os modelos animais existentes são poucos e limitados ao implante de fragmentos de quelóide no subcutâneo de camundongos. Estes estudos avaliaram, principalmente, a integração e a vascularização dos tecidos queloideanos implantados, e não seu mecanismo de formação7-11.
Quando injetados intradermicamente nos camundongos atímicos, a organização tecidual dos fibroblastos do grupo ativo foi muito distinta, formando nódulos macroscopicamente evidentes, que persistiram por até 14 dias macroscopicamente e, até 28 dias, microscopicamente. Outra característica interessante nos nódulos do grupo ativo foi a intensa vascularização evidenciada com 3 e 7 dias, que foi confirmada na microscopia. Este efeito pode ter relação com a ação de angiogênese estimulada pelo TGF-B in vivo12.
Além da vascularização, os nódulos do grupo ativo contraíram após 10 dias, formando nódulos esféricos bem evidentes, e que na macroscopia sugeriam estar encapsulados por tecido conectivo. O nódulo poderia estar encapsulado por tecido conectivo reacional do camundongo, ou matriz extracelular formada pelas células do nódulo. Ou, ainda, o TGF-B produzido pelas células poderia ter estimulado tanto as células exteriores ao nódulo a expressar a actina a e levar à contração dos nódulos, quanto às próprias células humanas transfectadas, assim como evidenciado por Desmoulière et al.13.
Todas estas características têm similaridades com a histologia de quelóides e cicatrizes hipertróficas, embora essas lesões sejam por vezes confundidas, existindo grande semelhança na histologia. O quelóide é caracterizado pela presença de espirais de bandas de colágeno espesso e hialinizado, ou colágeno queloideano, com substância fundamental mucinosa com poucos fibroblastos; cicatrizes hipertróficas são caracterizadas por estruturas nodulares com fibras colágenas finas organizadas randomicamente14,15.
Estes dados demonstram que o aumento na expressão do TGF-B é necessário, mas não foi suficiente para manter a formação da fibrose. Isto é em parte embasado no fato que apenas os fibroblastos expressando o TGF-B na forma ativa formaram nódulos semelhantes ao quelóide. No ambiente da cicatriz, devem estar presentes também sinais que ativem o TGF-B latente, normalmente produzido pelas células. A formação dessas cicatrizes é, provavelmente, um processo com vários passos.
O maior entendimento dos eventos moleculares e celulares que levam à formação dessas cicatrizes poderá ajudar na prevenção e em novos métodos de tratamento. As modificações genéticas usadas dão uma nova dimensão e permitem que estas células possam ser usadas no tratamento de doenças hereditárias, produzindo ou inibindo fatores de crescimento para modular o processo de cicatrização, como também liberarem proteínas terapêuticas sistemicamente.
CONCLUSÕES
Este modelo tem como vantagem poder definir as estruturas dos tecidos que são comuns tanto ao quelóide quanto a cicatrizes hipertróficas. Também pode ser utilizado em modelos de fibrose em outros órgãos e tecidos. Pode ainda ajudar a definir o papel de genes e citoquinas específicos e os caminhos e mecanismos de sinalização, ao contrário da maioria dos estudos que utiliza o tecido fibroso já formado, ou a cultura de células desses tecidos, e mostrar apenas o que está alterado.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Niessen FB, Spauwen PH, Schalkwijk J, Kon M. On the nature of hypertrophic scars and keloids: a review. Plast Reconstr Surg.1999;104(5):1435-58.
2. Younai S, Nichter LS, Wellisz T, Reinisch J, Nimni ME, Tuan TL. Modulation of collagen synthesis by transforming growth factor-beta in keloid and hypertrophic scar fibroblasts. Ann Plast Surg. 1994;33(2):148-51.
3. Tredget EE, Shankowsky HA, Pannu R, Nedelec B, Iwashina T, Ghahary A, et al. Transforming growth factorbeta in thermally injured patients with hypertrophic scars: effects of interferon alpha-2b. Plast Reconstr Surg.1998;102(5):1317-30.
4. Lee TY, Chin GS, Kim WJ, Chau D, Gittes GK, Longaker MT. Expression of transforming growth factor beta 1, 2, and 3 proteins in keloids. Ann Plast Surg. 1999;43(2):179-84.
5. Wang R, Ghahary A, Shen Q, Scott PG, Roy K, Tredget EE. Hypertrophic scar tissues and fibroblasts produce more transforming growth factor-beta1 mRNA and protein than normal skin and cells. Wound Repair Regen. 2000;8(2):128-37.
6. Paek HJ, Campaner AB, Kim JL, Aaron RK, Ciombor DM, Morgan JR, et al. In vitro characterization of TGF-beta1 release from genetically modified fibroblasts in Ca(2+)- alginate microcapsules. ASAIO J. 2005;51(4):379-84.
7. Shetlar MR, Shetlar CL, Hendricks L, Kischer CW. The use of athymic nude mice for the study of human keloids. Proc Soc Exp Biol Med. 1985;179(4):549-52.
8. Estrem SA, Domayer M, Bardach J, Cram AE. Implantation of human keloid into athymic mice. Laryngoscope. 1987;97(10):1214-8.
9. Kischer CW, Pindur J, Shetlar MR, Shetlar CL. Implants of hypertrophic scars and keloids into the nude (athymic) mouse: viability and morphology. J Trauma. 1989; 29(5):672-7.
10. Hillmer MP, MacLeod SM. Experimental keloid scar models: a review of methodological issues. J Cutan Med Surg. 2002;6(4):354-9.
11. Hochman B, Vilas-Bôas FC, Mariano M, Ferreira LM. Keloid heterograft in the hamster (Mesocricetus auratus) cheek pouch. Acta Cir Bras. 2005;20(3):200-12.
12. Roberts AB, Sporn MB. Transforming growth factor. In: Clark RAF, editor. The molecular and cellular biology of wound repair. 2nd ed. New York:Plenum Press;1996. p.275- 308.
13. Desmoulière A, Geinoz A, Gabbiani F, Gabbiani G. Transforming growth factor-beta 1 induces alphasmooth muscle actin expression in granulation tissue myofibroblasts and in quiescent and growing cultured fibroblasts. J Cell Biol. 1993;122(1):103-11.
14. Ehrlich HP, Desmoulière A, Diegelmann RF, Cohen IK, Compton CC, Garner WL, et al. Morphological and immunochemical differences between keloid and hypertrophic scars. Am J Pathol. 1994;145(1):105-13.
15. Lee JY, Yang CC, Chao SC, Wong TW. Histopathological differential diagnosis of keloid and hypertrophic scar. Am J Dermatopathol. 2004;26(5):379-84.
I. Doutora pela Disciplina de Cirurgia Plástica da UNIFESP.
II. Professor afiliado da Disciplina de Cirurgia Plástica da UNIFESP.
III. PhD Assistant Professor Brown University, USA.
IV. Professora Titular da Disciplina de Cirurgia Plástica da UNIFESP.
Correspondência para:
Anelisa B. Campaner
Disciplina de Cirurgia Plástica UNIFESP
Rua Napoleão de Barros, 715 - 4º andar - Vila Clementino
São Paulo, SP - CEP 04024-002.
Tel.: (0xx11) 5576-4118. Fax: (0xx11) 5571-6579
Trabalho realizado na Disciplina de Cirurgia Plástica da Universidade Federal de São Paulo UNIFESP-EPM, São Paulo, SP.
Artigo recebido: 13/03/2007
Artigo aprovado: 21/06/2007


 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter