

Case Report - Year 2024 - Volume 39 -
Síndrome de Morel-Lavallée: Relato de caso tratado com sucesso em hospital secundário
Morel-Lavallée Syndrome: Report of a case successfully treated in a secondary hospital
RESUMO
A lesão de Morel-Lavallée é descrita como uma lesão de partes moles secundária a um trauma com cisalhamento da pele e tecido celular subcutâneo contra a fáscia muscular sem perda de continuidade da pele. O diagnóstico é confirmado com auxílio de exames de imagem, sendo a ressonância magnética o exame mais específico. O tratamento é multimodal, dependendo de variadas técnicas cirúrgicas, antibióticos e medidas de ressuscitação e suporte. Homem de 36 anos, vítima de politrauma, evolui com lesão complexa no membro inferior e sepse, necessitando de abordagens cirúrgicas variadas e tratamento de suporte clínico. Avaliamos a importância das várias estratégias empregadas, momento oportuno e impacto no desfecho do paciente. Concluímos que o manejo da síndrome de Morel-Lavallée é complexo, mas pode ser realizado em hospital secundário.
Palavras-chave: Traumatismo múltiplo; Lesões dos tecidos moles; Procedimentos de cirurgia plástica; Desenluvamentos cutâneos; Transplante de pele.
ABSTRACT
The Morel-Lavallée injury is described as a soft tissue injury secondary to trauma with the shearing of the skin and subcutaneous cellular tissue against the muscular fascia without loss of skin continuity. The diagnosis is confirmed with the aid of imaging exams, with magnetic resonance imaging being the most specific exam. Treatment is multimodal, depending on a variety of surgical techniques, antibiotics, and resuscitation and supportive measures. A 36-yearold man, victim of multiple traumas, developed a complex injury to the lower limb and sepsis, requiring varied surgical approaches and clinical supportive treatment. We evaluate the importance of the various strategies employed, timing, and impact on patient outcomes. We conclude that the management of Morel- Lavallée syndrome is complex but can be performed in a secondary hospital.
Keywords: Multiple trauma; Soft tissue injuries; Plastic surgery procedures; Degloving injuries; Skin transplantation.
INTRODUÇÃO
A lesão de Morel-Lavallée (LML) é uma condição rara e potencialmente grave, caracterizada por um acúmulo de fluido e tecido necrótico entre a pele e a fáscia muscular subjacente, causado por uma força de cisalhamento. Embora seja um evento incomum, é importante reconhecer os sinais e sintomas da lesão para diagnóstico e tratamento precoces.
A lesão é frequentemente associada a traumas de alta energia, como acidentes automobilísticos, quedas ou lesões esportivas, e afeta mais comumente áreas de protuberância óssea, como coxas, quadril e região lombar¹. Por ser uma lesão incomum, há poucos dados estatísticos sobre sua prevalência, sendo estipulada uma razão aproximada de 2:1 em homens em relação a mulheres, provavelmente pelo maior número de casos de politraumas em homens2, além de uma prevalência de 8,3% da lesão no contexto de trauma pélvico3.
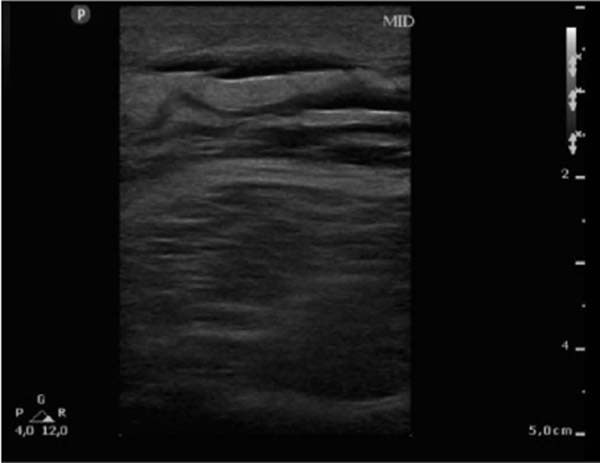
O diagnóstico preciso da LML é crucial para um tratamento adequado e prevenção de complicações. O diagnóstico é tipicamente realizado por meio de exame físico, história clínica e exames de imagem, como ultrassonografia (USG) e ressonância magnética (RM). A USG pode revelar uma imagem anecoica em meio a uma massa hiperecoica, enquanto a RM pode apresentar uma lesão homogênea hiperdensa, localizada anteriormente à camada muscular e posterior à hipoderme. No entanto, é importante ressaltar que os achados de imagem não são específicos, e devem ser considerados juntamente com a história clínica e exame físico para um diagnóstico correto4.
OBJETIVO
Este artigo tem como objetivo relatar um caso de sucesso no tratamento da lesão de Morel-Lavallée em um hospital secundário, destacando a abordagem cirúrgica realizada e os resultados alcançados.
RELATO DE CASO
Homem de 36 anos com história de queda de moto em alta velocidade com lesão exclusiva de membro inferior direito apresentando apenas escoriações no joelho direito, procura atendimento no médico Hospital São Luiz Gonzaga, em São Paulo-SP após 3 dias do acidente, com o aparecimento de edema local, calafrios e sinais flogísticos. Paciente tabagista, sem outros antecedentes relevantes.
Realizada USG de membro inferior direito, evidenciando pele íntegra com tecido celular subcutâneo espessado e de aspecto heterogêneo por todo o membro inferior direito (Figura 1), além de uma tomografia computadorizada (TC) evidenciando as mesmas alterações (Figura 2).
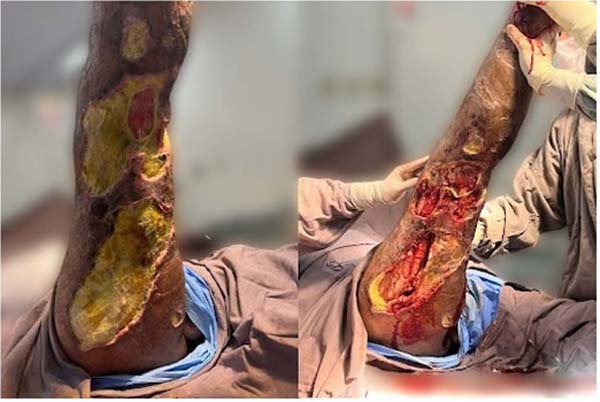
Logo no início da internação, houve piora do quadro, apresentando febre, náusea e aumento do edema e necrose tecidual, com necessidade de antibioticoterapia guiada por hemocultura (piperacilina/tazobactam + oxacilina) associada a escarectomia e desbridamento do tecido desvitalizado no centro cirúrgico após 4 dias de internação e novamente após 19 dias (Figura 3).
Na quarta semana, foi repetido o desbridamento do tecido desvitalizado em centro cirúrgico sob raquianestesia, associando desta vez um curativo a vácuo na lesão por 48 horas, sem sucesso na estabilização do quadro infeccioso local. Optou-se pelo escalonamento da antibioticoterapia para meropenem e polimixina B por 13 dias em conjunto com a lavagem e troca de curativo simples diária, associada a novo desbridamento do tecido desvitalizado e infeccionado semanalmente por duas semanas.
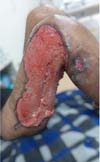
Na sexta semana, com controle do quadro infeccioso, foi realizada sutura com inversão das bordas, sutura elástica nos tecidos viáveis na coxa (Figura 4) e desbridamento nos demais tecidos lesionados (Figuras 5 e 6), com retirada da sutura elástica após 7 dias. Os níveis de hemoglobina foram mantidos acima de 10 g/dl durante todo o tratamento, com suporte transfusional de 9 concentrados de hemácias no total.
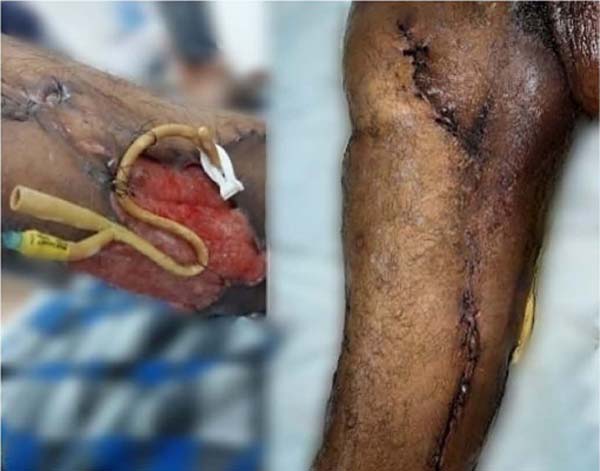
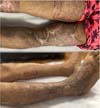
Com o sucesso na redução do leito cruento da lesão, foi programada troca de curativo a cada 3 dias com sulfadiazina de prata e novo desbridamento em centro cirúrgico semanal. Na nona semana, foi realizada enxertia de pele parcial em tornozelo e dorso do pé direito com área doadora de coxa esquerda, seguida de enxerto de pele parcial na coxa direita após mais duas semanas devido ao não fechamento total da lesão após a sutura elástica devido à dimensão da lesão (Figura 7).
Durante a internação, foi realizada fisioterapia motora em dias alternados visando a manutenção da funcionalidade do membro inferior. O paciente apresentou resolução total do quadro após 3 meses, com manutenção da internação por mais um mês para realização de fisioterapia por razões sociais, recebendo alta após 4 meses de internação, deambulando sem auxílio, com o enxerto integrado sem deiscência (Figura 8).
DISCUSSÃO
O tratamento da LML é altamente individualizado, levando em consideração a extensão da lesão, a presença de complicações associadas e a resposta do paciente ao tratamento inicial. As opções terapêuticas podem variar desde abordagens conservadoras até intervenções mais invasivas, dependendo da gravidade e da evolução da lesão.
Em lesões de menor gravidade, a drenagem do fluido acumulado é frequentemente realizada por meio de aspiração percutânea guiada por imagem ou uso de drenos fechados, visando a remoção do líquido e o estabelecimento de um ambiente propício à cicatrização. O desbridamento cirúrgico é uma opção terapêutica mais invasiva que pode ser indicada em casos de tecido necrótico extenso, presença de abscessos ou infecção persistente. A remoção completa do tecido desvitalizado e contaminado é essencial para promover a cicatrização adequada e evitar complicações infecciosas subsequentes5, 6.
O caso relatado ilustra bem essa abordagem terapêutica. O paciente sofreu o trauma, apresentando apenas escoriações no joelho direito inicialmente, mas evolui com edema local, sinais flogísticos e febre após três dias. A ultrassonografia e a tomografia computadorizada confirmaram o diagnóstico de LML. O paciente evoluiu para sepse, necessitando de antibioticoterapia direcionada e múltiplos desbridamentos cirúrgicos para remover o tecido necrosado. Durante a internação, a complexidade do manejo incluiu a utilização de curativos a vácuo, troca de antibióticos e repetidos desbridamentos, demonstrando a importância de uma abordagem agressiva, individualizada e multimodal para casos complicados.
Após o desbridamento cirúrgico, o uso de curativos a vácuo desempenha um papel fundamental na estabilização da lesão e progressão para tecido de granulação. Esses curativos ajudam a reduzir a formação de seroma, promovem a aderência dos tecidos, minimizam o risco de infecção secundária e favorecem a cicatrização por segunda intenção7.
Em situações mais graves, em que há envolvimento significativo do tecido muscular subjacente, a cirurgia pode ser necessária para a remoção do tecido necrótico e para a reparação das lesões musculares8. Nesses casos, a reconstrução tecidual pode ser realizada por meio de enxertos de pele, retalhos musculares ou técnicas de fechamento primário, dependendo da extensão da lesão e das características do paciente9, 10. Esses procedimentos visam restabelecer a integridade estrutural e funcional da região afetada, permitindo a recuperação adequada da função muscular.
O tratamento do nosso paciente incluiu várias dessas estratégias, culminando em enxertos de pele e sutura elástica para a recuperação funcional. A fisioterapia foi essencial para a reabilitação, permitindo que o paciente recuperasse a funcionalidade completa do membro afetado. O processo de recuperação foi prolongado, com alta hospitalar após quatro meses de internação, destacando a necessidade de um manejo multidisciplinar e prolongado para otimizar os resultados clínicos.
CONCLUSÃO
O caso apresentado ressalta a importância crucial do diagnóstico rápido e do manejo cirúrgico precoce na lesão de Morel-Lavallée. A prontidão na identificação desse tipo de lesão é fundamental para evitar complicações graves e favorecer uma recuperação mais eficaz.
A intervenção cirúrgica com o desbridamento dos tecidos desvitalizados em ambiente cirúrgico emerge como um elemento-chave para limitar o avanço da lesão, prevenir infecções secundárias e promover a cicatrização saudável, com posterior aplicação de enxertos de pele parciais conforme necessário.
Além disso, a abordagem multidisciplinar é um aspecto vital desse processo, evidenciado pela colaboração estreita com uma equipe de fisioterapia motora. A integração de estratégias de reabilitação desde as fases iniciais do tratamento é fundamental para otimizar a função motora e acelerar a recuperação do paciente.
REFERÊNCIAS
1. Palacio EP, Stasi GGD, Lima EHRT, Mizobuchi RR, Durigam Júnior A, Galbiatti JA. Resultados do tratamento cirúrgico da lesão de Morel-Lavallée. Rev Bras Ortop. 2015;50(2):148-52.
2. Dodwad SN, Niedermeier SR, Yu E, Ferguson TA, Klineberg EO, Khan SN. The Morel-Lavallée lesion revisited: management in spinopelvic dissociation. Spine J. 2015;15(6):e45-51.
3. Nickerson TP Zielinski MD, Jenkins DH, Schiller HJ. The Mayo Clinic experience with Morel-Lavallée lesions: establishment of a practice management guideline. J Trauma Acute Care Surg. 2014;76(2):493-7.
4. van Gennip S, van Bokhoven SC, van den Eede E. Pain at the knee: the Morel-Lavallée lesion, a case series. Clin J Sport Med. 2012;22(2):163-6. DOI: 10.1097/JSM.0b013e318246ee33
5. Singh R, Rymer B, Youssef B, Lim J. The Morel-Lavallée lesion and its management: A review of the literature. J Orthop. 2018;15(4):917-21. DOI: 10.1016/j.jor.2018.08.032
6. Greenhill D, Haydel C, Rehman S. Management of the Morel-Lavallée Lesion. Orthop Clin North Am. 2016;47(1):115-25. DOI: 10.1016/j.ocl.2015.08.012
7. Camargo PAB, Bertanha M, Moura R, Jaldin RG, Yoshida RA, Pimenta REF et al. Uso de curativo a vácuo como terapia adjuvante na cicatrização de sítio cirúrgico infectado. J Vasc Bras. 2016;15(4):312-6.
8. Nakajima T, Tada K, Nakada M, Matsuta M, Tsuchiya H. Two Cases of Morel-Lavallée Lesion Which Resulted in a Wide Skin Necrosis from a Small Laceration. Case Rep Orthop. 2020;2020:5292937. DOI: 10.1155/2020/5292937
9. Monte ALR. Tratamento das lesões por desenluvamento cutâneo traumático. Rev Bras Cir Plást. 2012;27(3 Suppl.1):89.
10. Badjate DM, Jain D, Phansopkar P, Wadhokar OC. A Physical Therapy Rehabilitative Approach in Improving Activities of Daily Living in a Patient With Morel-Lavallée Syndrome: A Case Report. Cureus. 2022;14(9):e29523. DOI: 10.7759/cureus.29523
1. Santa Casa de Misericórdia de São Paulo, São Paulo, SP Brasil
2. Hospital São Luiz Gonzaga, São Paulo, SP Brasil
Autor correspondente: Bruno Losi Zacharias R. Dr. Cesário Mota Júnior, 112, Vila Buarque, São Paulo, SP Brasil. CEP: 01221-010. E-mail: bruno_zaka@hotmail.com
Artigo submetido: 16/03/2024.
Artigo aceito: 27/07/2024.
Conflitos de interesse: não há.













 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter