

Original Article - Year 2024 - Volume 39 -
Compressão intermitente imediata sobre anastomose vascular: Uma nova técnica para prevenir trombose?
Immediate intermittent compression over vascular anastomosis: a new technique to prevent thrombosis?
RESUMO
Introdução: Este estudo tem o objetivo de avaliar o efeito da compressão intermitente imediata sobre anastomoses arteriais microcirúrgicas em comparação com compressão fixa e com utilização isolada de irrigação com soro fisiológico e heparina em laboratório experimental.
Método: 12 ratos Wistar foram aleatoriamente divididos em três grupos para terem suas artérias femorais seccionas e anastomosadas de forma término-terminal, para comparação de patência com 30 minutos e 7 dias. Grupo I: foi realizada compressão intermitente imediata sobre a anastomose por 60 segundos; grupo II: uma compressão fixa foi mantida imediatamente após a anastomose, também por 60 segundos; grupo III, após o término da anastomose, não foi feita nenhuma intervenção adicional. Além da avaliação da patência, os animais foram pesados e medidos os diâmetros arteriais operados.
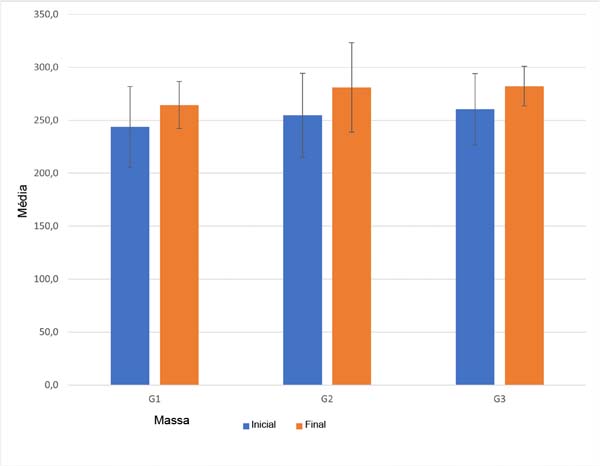
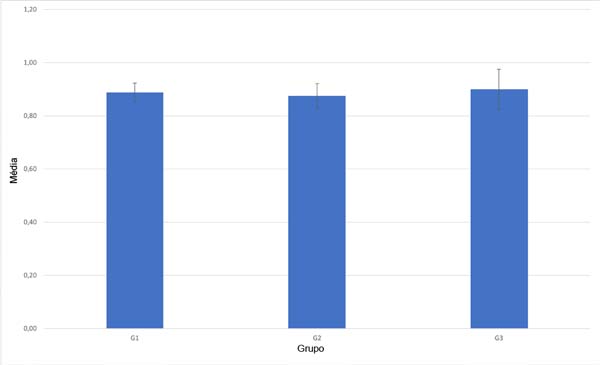
Resultados: 24 artérias femorais foram abordadas. As médias de peso inicial dos ratos dos grupos I, II e III foram, respectivamente, de 243,8g, 254,6g e 260,4g, enquanto as finais foram de 264,4g, 281g e 282,1g (p<0,001). O diâmetro médio das artérias abordadas foi, respectivamente, de 0,89mm, 0,88mm e 0,90mm, e os tempos de anastomoses em minutos, de 25,6, 24,5 e 24,5, respectivamente; As patências finais após 7 dias foram, respectivamente, de 62,5% (p=0,07), 25% (p=0,48) e 50% (p=0,13).
Conclusão: A compressão intermitente imediata pode ser realizada ao término de anastomoses arteriais microcirúrgicos sem prejuízo na patência final do procedimento.
Palavras-chave: Anastomose arteriovenosa; Microcirurgia; Procedimentos de cirurgia plástica; Trombose; Ratos Wistar.
ABSTRACT
Introduction: This study aims to evaluate the effect of immediate intermittent compression on microsurgical arterial anastomoses in comparison with fixed compression and only observation in an experimental laboratory.
Methods: The two femoral arteries of twelve male Wistar rats were sectioned and reanastomosed to compare patency at 30 minutes and 7 days. Group I: immediate intermittent compression was performed over the anastomosis for 60 s; group II: a fixed compression was maintained immediately after the anastomosis for 60 s; group III: after completion of the anastomosis, no additional intervention was performed. In addition to the patency assessment, the animals were weighed and the operated arterial diameters were measured.
Results: Twenty-four femoral arteries were examined. Initial average weights of the rats in groups I, II, and III were 243.8g, 254.6g, and 260.4g, respectively, while the final weights were 264.4g, 281g, and 282.1g (p<0.001), respectively; mean diameter of the approached arteries was 0.89, 0.88, and 0.90mm, respectively, and the anastomoses (time in minutes) were 25.6, 24.5, and 24.5, respectively; final patencies after 7 days were 62.5% (p=0.07), 25% (p=0.48), and 50% (p=0.13), respectively.
Conclusion: Immediate intermittent compression can be performed at the end of microsurgical arterial anastomoses without affecting the final patency of the procedure.
Keywords: Arteriovenous anastomosis; Microsurgery; Plastic surgery procedures; Thrombosis; Rats, Wistar.
INTRODUÇÃO
Os avanços nas técnicas de ampliação óptica permitiram aos cirurgiões abordarem estruturas menores, criando uma enorme gama de possibilidades para diferentes especialidades. Esse conjunto de procedimentos auxiliados pela magnificação óptica é conhecido como microcirurgia1.
Logo após a disseminação das técnicas, percebeu-se que um cirurgião devidamente treinado2 era componente fundamental. Assim, logo surgiram os primeiros laboratórios de treinamento, sendo o Brasil pioneiro na América do Sul, em 19713.
A sequência de treinamento varia um pouco entre os diversos centros atuais e geralmente começa com a familiarização com o microscópio e outros materiais, seguida pelo aprendizado de variações de suturas microcirúrgicas, com materiais simples como luvas de látex4, até evoluir para anastomoses vasculares em animais não vivos e modelos vivos, quando disponíveis5.
A formação visa desenvolver as competências profissionais do cirurgião, para preparar e proporcionar segurança durante suas atividades clínicas; são esperados excelentes resultados na patência das anastomoses vasculares, uma vez que os serviços primários relatam taxas de sobrevivência dos retalhos acima de 90%6,7.
Os modelos não biológicos evitam conflitos éticos relacionados ao uso de animais, além de alguns serem acessíveis, como tubos feitos de materiais sintéticos, e outros permitirem uma avaliação mais precisa das habilidades, principalmente as virtuais; entretanto, os modelos animais são mais consistentes e mais próximos da realidade encontrada na prática clínica8-10.
Uma das técnicas necessárias para o treinamento em microcirurgia é a anastomose vascular. Algumas regras fundamentais das anastomoses vasculares devem ser seguidas, as que incluem margens proximais e distais bem vascularizadas, livres de doença ativa e tensão. A anastomose também deve ser hemostática, circunferencialmente hermética e com bordas invertidas11.
Sendo a trombose um dos principais obstáculos para o sucesso do fluxo vascular, modelos animais específicos foram desenvolvidos para avaliar o impacto do dano endotelial na formação de trombos12, demonstrando como a agressão à camada íntima pode evoluir para esta complicação e como aplicações externas de diferentes forças podem causar consequências semelhantes13. Embora o conceito de anastomose compressiva tenha sido investigado há quase dois séculos, ainda não obteve ampla aceitação, mas poderia ser uma forma de reduzir o risco de trombose11.
Sabe-se que após a trombose arterial da anastomose o retalho pode sobreviver apenas com terapia conservadora quando o evento ocorre após período crítico mínimo. É mais provável que esse tempo ocorra após o 12º dia de pós-operatório, mas esse período crítico mínimo pode ser tão baixo quanto 6 dias para oclusão arterial14. Assim, é essencial compreender e desenvolver formas de evitar a trombose, quando viável, e tratá-la, quando necessário, para a realização com sucesso de retalhos microcirúrgicos complexos.
OBJETIVO
Este estudo teve como objetivo principal avaliar o impacto da compressão imediata intermitente nas anastomoses arteriais microcirúrgicas e sua patência em modelo experimental. O objetivo secundário foi avaliar o impacto da compressão fixa suave imediatamente após a remoção da pinça vascular.
MÉTODO
Durante o treinamento experimental, 12 ratos Wistar (sexo masculino; idade, 60-90 dias) foram selecionados para secção e anastomoses das duas artérias femorais, a fim de avaliar o impacto da compressão intermitente imediata nas anastomoses arteriais microcirúrgicas. Todos os animais receberam anastomose bilateral pelo mesmo método.
O estudo foi realizado entre abril e julho de 2021, na Faculdade de Medicina de Botucatu, Botucatu-SP, e o número de aprovação do CEP é 1378/2021.
As 24 anastomoses arteriais foram divididas aleatoriamente em três grupos, conforme descrito a seguir. Um sorteio foi realizado imediatamente antes da anestesia dos ratos, e um papel escrito com a técnica a ser realizada em cada rato foi retirado da bolsa.
Grupo 1 (G1) - Compressão Intermitente por 60s; Grupo 2 (G2) - Compressão Fixa por 60s;
Grupo 3 (G3) - Controle (somente observação).
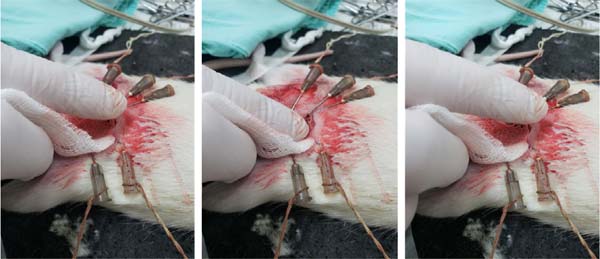
No Grupo 1, imediatamente após a anastomose microcirúrgica, foram realizadas 60 compressões suaves e intermitentes, tipo massagem, por 60 segundos (Figura 1). No Grupo 2, a mesma compressão suave foi aplicada constantemente, por 60 segundos. No Grupo 3 a anastomose foi observada apenas, sem qualquer intervenção. A medida do diâmetro dos vasos foi realizada com régua milimetrada sob visão microscópica com aumento de 10x antes do procedimento.
Programação
O estudo foi dividido em dois períodos de intervenção. O primeiro período envolveu uma divisão aleatória das artérias femorais para separar os grupos e realizar a cirurgia inicial. No segundo período, após 7 dias, foi verificada a patência final da anastomose.
Os dados iniciais incluíram peso, diâmetro do vaso no ponto de secção, tempo cirúrgico para anastomose arterial término-terminal e número de suturas. Os dados finais incluíram avaliações de peso e patência após 7 dias.
Anestesia
Optou-se pela anestesia combinada com cloridrato de cetamina 10% (Cetamin®, Syntec, Brasil) e cloridrato de xilazina 2% (Xilazin®, Syntec, Brasil) por via intraperitoneal, nas doses de 80 e 10mg/kg, respectivamente, associada à lidocaína (Xylestesin®, Cristália, Brasil) para aplicação nos locais de incisão na dose de 7mg/kg. Para analgesia intra e pós-operatória, tramadol (Tramadon®, Cristália, Brasil) e dipirona (Febrax®, Lema-Injex Biologic, Brasil) foram administrados por via subcutânea nas doses de 5mg/kg e 100mg/kg, respectivamente. A dipirona foi reaplicada diariamente para controle da dor até o segundo procedimento e posterior eutanásia do animal com tiopental (Thiopentax®, Cristália, Brasil), na dose de 120mg/kg, no sétimo dia.
Cirurgia
Após pesagem inicial e tricotomia da região inguinal bilateral, foi realizada incisão oblíqua na região inguinal do rato, com abertura e dissecção por plano até a identificação dos vasos femorais. A artéria femoral foi dissecada e isolada em seu maior e mais proximal calibre, com uma fita azul abaixo para melhor contraste. Nesse momento, a camada adventícia foi removida e o diâmetro da artéria foi medido no ponto onde foi seccionada. Antes da secção, a pinça dupla metálica foi posicionada proximal e distalmente a este ponto. Foi iniciada sutura interrompida com mononáilon 10-0, com agulhas cilíndricas de 3/8 e 0,65cm para realização da anastomose. Depois que a sutura ponta a ponta foi cronometrada e o número de suturas contado, imediatamente após a retirada do pinçamento foi realizada uma das três propostas, de acordo com o grupo escolhido para a artéria. Aguardamos 30 minutos para verificação da patência, conforme descrito a seguir e em seguida procedemos à aproximação do músculo, tecido subcutâneo e pele do rato com suturas simples de mononáilon 5-0.
Após 7 dias, os ratos foram anestesiados novamente. Após aferição do peso, a sutura vascular foi reexplorada e a patência verificada.
Teste de patência
A patência foi sempre verificada por um examinador independente.
A patência aos 30min e 72h foi verificada pela técnica proposta por Acland13. Duas pinças foram posicionadas distalmente à anastomose e realizada manobra para esvaziar a região central em ambos os locais. Posteriormente, a pinça proximal foi liberada para preencher novamente o espaço central. Se o espaço intravascular criado fosse imediatamente preenchido com sangue proximal à direção distal, consideramos a patência (fluxo) bem-sucedida.
A coloração e a pulsação dos vasos foram consideradas sinais indiretos de patência (fluxo) bem-sucedida.
A ausência de fluxo após 30min ou 7 dias foi considerada falha da anastomose. A limitação deste teste é que embora seja útil para verificar a técnica, ele não considera o fluxo sanguíneo.
Análise estatística
Os dados foram tabulados no software Microsoft Excel. A análise de perfil foi utilizada para determinar os pesos inicial e final (Tabela 1).
| Massa (g) | ||
|---|---|---|
| Inicial | Final | |
| G1 | 243,8 | 264,4 |
| 38,2 | 22,2 | |
| G2 | 254,6 | 281,0 |
| 39,5 | 42,2 | |
| G3 | 260,4 | 282,1 |
| 33,5 | 18,7 | |
A análise de variância foi utilizada para outras variáveis quantitativas (Tabela 2).
| Variáveis | |||
|---|---|---|---|
| Diâmetro da artéria (milímetros) | Número de suturas | Tempo (min) | |
| G1 | 0,89 | 6,5 | 25,6 |
| 0,04 | 1,4 | 2,0 | |
| G2 | 0,88 | 7,0 | 24,5 |
| 0,05 | 0,8 | 3,7 | |
| G3 | 0,90 | 6,0 | 24,5 |
| 0,08 | 1,1 | 3,9 | |
| p | 0,67 | 0,22 | 0,74 |
Para patências nos momentos inicial e final, foi utilizado o teste de McNemar (Tabela 3).
| Patência | |||
|---|---|---|---|
| Inicial | Final | p | |
| G1 | 8 | 5 | 0,07 |
| 100,0 | 62,5 | ||
| G2 | 8 | 2 | 0,48 |
| 100,0 | 25,0 | ||
| G3 | 8 | 4 | 0,23 |
| 100,0 | 50,0 | ||
| Total | 24 100,0 |
11 45,8 |
|
Laboratório Experimental
Todas as atividades foram realizadas em um laboratório experimental da Faculdade de Medicina de Botucatu, onde estavam disponíveis biotério, material microcirúrgico básico (Microsuture®) e microscópios (DFV®) com ampliação de até 40 vezes.
Os animais foram mantidos em gaiolas distintas, com água e ração ad libitum, sistema de exaustão de ar, ciclos claro/escuro de 12 horas e controle de temperatura, além de materiais para enriquecimento ambiental.
Ao final do procedimento, os ratos foram sacrificados e as respectivas carcaças foram mantidas congeladas a -20°C até posterior utilização para treinamento experimental. Quando necessário, as carcaças eram incineradas.
RESULTADOS
Foram realizadas 24 anastomoses nos 12 ratos incluídos no estudo, que foram divididas em três grupos, com 8 anastomoses vasculares em cada grupo. Inicialmente, o peso dos animais foi avaliado antes da realização do procedimento e, após a cirurgia, os ratos apresentaram ganho de peso nos três grupos (p<0,001), conforme pode ser observado na Figura 2. A média dos valores de peso individuais dos ratos de cada grupo pode ser observada na Tabela 1, porém não houve diferença estatisticamente significativa no peso quando comparados os três grupos (p=0,53), nem quando comparados os pesos antes e após o procedimento (p=0,84).
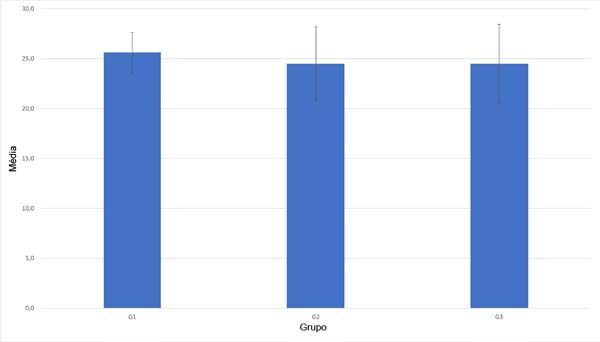
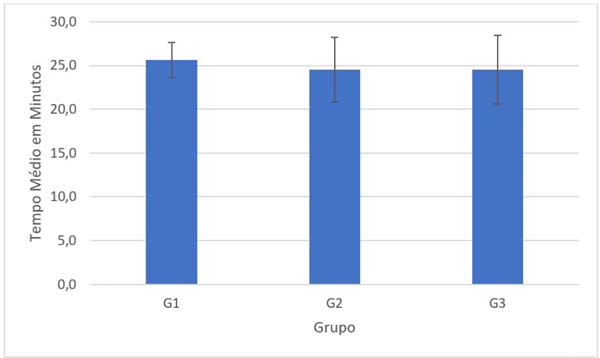
Outra variável quantitativa avaliada antes do procedimento foi a medida do diâmetro da artéria a ser anastomosada, como pode ser observado na Figura 3 (p=0,67), e o número de suturas realizadas em cada grupo, como pode ser observado na Figura 4 (p=0,22). Não houve significância estatística (p>0,05) na frequência de patência de acordo com o grupo. O tempo operatório médio também foi considerado em cada grupo, sendo pouco superior a 25 minutos no Grupo 1, o que pode ser observado na Figura 5 (p=0,74).
Em relação à taxa de patência, observou-se que em todos os grupos houve uma taxa de patência de 100% imediatamente após a anastomose, mas após 7 dias a taxa de patência foi de 62,5% (p=0,07), 25% (p=0,48) e 50% (p=0,13) nos Grupos 1, 2 e 3, respectivamente. Consequentemente, a taxa de trombose foi de 37,5%, 75% e 50% nos grupos 1, 2 e 3, respectivamente, destacando que no Grupo 2 houve maior taxa de trombose em relação aos demais grupos, com diferença estatisticamente significativa (p<0,05).
DISCUSSÃO
A aplicação prática da microcirurgia em serviços especializados envolve uma tríade de condições fundamentais: formação profissional, instrumentos adequados e suporte hospitalar3. Por meio de revisão de literatura, não foi possível identificar estudos que aplicassem alguma tática semelhante à nossa pesquisa, embora vários estudos discutiram fatores que seriam importantes para prevenir ou tratar a trombose arterial.
Pode ser complexo prever qual anastomose pode ser danificada pela trombose. Em humanos, é fundamental considerar a condição clínica do paciente; entretanto, isso é mais complexo em modelos animais sem alterações específicas ou geneticamente programadas. A utilidade da ultrassonografia por medida de fluxo já foi demonstrada; entretanto, o procedimento não é viável em laboratórios comuns15.
A irrigação com solução de heparina já se mostrou útil na prevenção; entretanto, não foi descrita como capaz de causar trombólise13. Alguns estudos tentaram definir uma concentração equilibrada dessa solução16 e estimaram que 100U/mL é superior a 250U/mL. A dose utilizada em nossa experiência foi de 150U/mL e a consideramos segura, pois não observamos sangramento anormal.
A heparina, bem como seus derivados, incluindo a dalteparina (uma forma de heparina de baixo peso molecular), que não aumenta o risco de sangramento cirúrgico, são conhecidos por serem uma abordagem eficaz para anastomoses microcirúrgicas17.
A lidocaína tem efeito especial no tratamento de vasoespasmos, com início de ação rápido, mas de curta duração18. A lidocaína a 2% aplicada em nosso estudo teve efeito de dilatação arterial satisfatório, no que diz respeito ao intervalo de ação proposto por Ogawa et al.19.
Vários estudos avaliaram o uso de certos medicamentos, incluindo ácido acetilsalicílico, heparina parenteral e inibidores da glicoproteína IIB-IIIA (tirofiban); entretanto, estes apresentam benefícios apenas quando administrados em conjunto20. Quando heparina e tirofiban foram associados à injeção intraluminal antes de passar o último ponto da anastomose, houve aumento significativo da patência seriada com 62 anastomoses21.
Alguns flavonoides antioxidantes naturais, como a epigalocatequina, presente no chá verde, foram testados contra solução salina no local da anastomose arterial microcirúrgica com bons efeitos; quando facilmente acessíveis ao laboratório, podem ser mais uma ferramenta para prevenir trombose precoce e causar vasodilatação22.
Os inibidores da fosfodiesterase tipo III, como o cilostazol, já foram aplicados com sucesso em modelos animais destinados ao desenvolvimento de trombose arterial, com sucesso estatisticamente significativo23. Porém, devido à sua aplicação algumas horas antes da cirurgia, aumenta o tempo de preparação para o treinamento e não é tão prática quanto as medidas apresentadas em nossa série, todas realizadas de forma rápida e no intraoperatório.
A pentoxifilina, droga derivada da xantina com ação vasodilatadora periférica, já foi utilizada com sucesso em modelos experimentais que favorecem a trombose24. Porém, a técnica envolveu aplicações seriadas, o que também aumentou o tempo de preparo e o custo do treinamento.
Entre outras possibilidades, tem sido relatado o uso de etanol a 10%, aplicado por via subcutânea, próximo à área do vaso, 7 dias antes da abordagem cirúrgica25. O etanol pode ativar o óxido nítrico e as prostaglandinas, reduzir o vasoespasmo e inibir a agregação plaquetária. Este estudo relatou aumento no diâmetro vascular e menores taxas de trombose arterial.
A toxina botulínica também desempenha um papel na prevenção da trombose arterial. Ambos os tipos A26 e B27 apresentam benefícios por reduzirem as taxas de trombose, além de gerarem vasos com diâmetros maiores.
As ações mecânicas também afetam diretamente as taxas de patência. Quando é realizado algum tipo de torção28 ou alteração nas angulações29 das anastomoses, as taxas de patência diminuem proporcionalmente.
Ao comparar a taxa de patência entre as diferentes técnicas, a compressão intermitente foi superior, em números absolutos, em relação às demais; a compressão fixa apresentou o menor índice de patência absoluta. Entretanto, não houve diferença estatística entre os grupos, embora o Grupo 1, compressão intermitente, tenha apresentado p=0,07. Considerando que o número de ratos deste estudo foi pequeno, uma provável diferença estatística poderia ser esperada se fossem realizadas mais anastomoses arteriais. Não foi possível encontrar na literatura outros artigos que realizassem estudos com uso de compressão fixa e intermitente para redução de trombose e, portanto, não foi possível fazer comparação com artigos semelhantes.
A maioria dos estudos compara as taxas de patência das anastomoses no período entre uma e 24 horas após o procedimento. Um estudo recente publicado com o uso de heparina em anastomoses microcirúrgicas arteriais encontrou uma taxa de 13% de trombose após 1 hora de anastomose em comparação com o grupo controle. Outro estudo que comparou a patência da anastomose microcirúrgica cirúrgica com sildenafil e papaverina observou taxa de trombose imediata de 20% e 30%, respectivamente, em comparação ao grupo controle30. O presente artigo comparou os grupos com a taxa de patência aos 7 dias após a anastomose, o que pode explicar as taxas de patência mais baixas em comparação com a literatura.
Uma tática fundamental é a necessidade de evitar o uso de soluções ou ambientes cirúrgicos em baixas temperaturas, uma vez que a hipotermia é reconhecidamente um fator complicador, levando ao vasoespasmo e maiores taxas de trombose.
Futuramente, a tática apresentada poderá ser testada em anastomoses venosas, servindo como treinamento avançado, uma vez que as veias dos animais abordados possuem pequeno calibre, tornando o procedimento mais desafiador. Novos estudos utilizando “n” maior devem ser realizados para validar a superioridade da técnica de compressão intermitente.
Existem algumas limitações metodológicas no presente estudo: o pequeno número de animais em consequência da baixa disponibilidade na cirurgia experimental, a ausência de grupo com heparina e o fato de a anastomose realizada em uma artéria femoral poder afetar a patência da anastomose contralateral.
CONCLUSÃO
A compressão arterial mostrou-se uma possibilidade na tentativa de reduzir as taxas de trombose em anastomoses arteriais microcirúrgicas. Embora a compressão intermitente tenha apresentado menores riscos de trombose, não houve diferença estatisticamente significativa neste estudo. Observou-se também que a compressão fixa aumentou as chances de falha da anastomose. Assim, é necessária a realização de estudos com populações maiores para determinar a validade dos métodos mecânicos em anastomoses arteriais.
Agradecimentos
Agradecemos aos profissionais das Unidades de Pesquisa Experimental da Faculdade de Medicina de Botucatu e à professora e estatística, Lídia Raquel de Carvalho. Gostaríamos de agradecer à Editage pela edição em inglês.
REFERÊNCIAS
1. Rickard RF, Hudson DA. A history of vascular and microvascular surgery. Ann Plast Surg. 2014;73(4):465-72.
2. Viterbo F. A importância da microcirurgia na cirurgia plástica. Rev Bras Cir Plást. 2012;27(1):2.
3. Cunha MS, Ramos RS, Torres ALG, Souza DAM, Agra IMG, Eulálio JN. Aplicação da microcirurgia no serviço de cirurgia plástica da Universidade Federal da Bahia: análise dos resultados e complicações. Rev Col Bras Cir. 2005;32(6):297-303.
4. Pessoa BBGP, Pessoa SGP. Treinamento em microanastomoses utilizando tubos de látex. Acta Cir Bras. 2002;17(2):143-6.
5. Dias IS, Pessoa SGP, Benevides AN, Macêdo JE. Treinamento inicial em microcirurgia Rev Bras Cir Plást. 2010;25(4):595-9.
6. Brown E, Suh HP, Han HH, Pak CJ, Hong JP. Best new flaps and tips for success in microsurgery. Plast Reconstr Surg. 2020;146(6):796-807.
7. Colakoglu S, Tebockhorst S, Chong TW, Mathes DW. Patient safety in microvascular plastic surgery. J Reconstr Microsurg. 2019;35(9):631-9.
8. Abi-Rafeh J, Zammit D, Mojtahed Jaberi M, Al-Halabi B, Thibaudeau S. Nonbiological Microsurgery Simulators in Plastic Surgery Training: A Systematic Review. Plast Reconstr Surg. 2019;144(3):496e-507e.
9. Kinshoku MR, Rodriguez CAL, Fidalgo RS, Duran CCG, Leme PLS, Duarte IS. Rational use of animal models for research and microsurgery training. Rev Col Bras Cir. 2012;39(5):414-7.
10. Mathon B. Learning vascular microsurgical techniques on an animal model. Neuro-Chirurgie. 2014;60(5):227-33.
11. Mücke T, Wolff C, von Düring M, Mitchell DA, Ritschl LM, Fichter AM. Form and size matter: Increased risk of thrombosis in microvessels with surgically created endothelial lesions. J Reconstr Microsurg. 2017;33(1):40-4.
12. Kaidar-Person O, Rosenthal RJ, Wexner SD, Szomstein S, Person B. Compression anastomosis: history and clinical considerations. Am J Surg. 2008;195(6):818-26.
13. Chen LE, Seaber AV, Urbaniak JR. Thrombosis and thrombolysis in crushed arteries with or without anastomosis: a new microvascular thrombosis model. J Reconstr Microsurg. 1996;12(1):31-8.
14. Menezes Neto BF, Oliveira Neto FV, Secanho MS, Carvalho LB, Moragas WR, Fernandes MS. Submerged vascular anastomosis. A technique for vascular suturing in experimental microsurgery. Acta Cir Bras. 2021;36(8):e360807.
15. Yoon AP, Jones NF. Critical time for neovascularization/angiogenesis to allow free flap survival after delayed postoperative anastomotic compromise without surgical intervention: A review of the literature. Microsurgery. 2016;36(7):604-12.
16. Shaughness G, Blackburn C, Ballestín A, Akelina Y, Ascherman JA. Predicting Thrombosis Formation in 1-mm-Diameter Arterial Anastomoses with Transit-Time Ultrasound Technology. Plast Reconstr Surg. 2017;139(6):1400-5.
17. Cox GW, Runnels S, Hsu HS, Das SK. A comparison of heparinised saline irrigation solutions in a model of microvascular thrombosis. Br J Plast Surg. 1992;45(5):345-8.
18. Malm K, Dahlbäck B, Arnljots B. Low-molecular-weight heparin (dalteparin) effectively prevents thrombosis in a rat model of deep arterial injury. Plast Reconstr Surg. 2003;111(5):1659-66.
19. Ogawa H, Kusumoto J, Nomura T, Hashikawa K, Terashi H, Sakakibara S. Wire Myography for Continuous Estimation of the Optimal Concentration of Topical Lidocaine as a Vasodilator in Microsurgery. J Reconstr Microsurg. 2021;37(6):541-50.
20. Yokoyama T, Kadota S, Takeuchi K, Tosa Y, Kadomatsu K, Shimizu Y, et al. Changes in the blood flow and prevention of vasospasm of the femoral artery by topical application of lidocaine in rats. Ann Plast Surg. 2011;67(2):178-83.
21. Chung TL, Pumplin DW, Holton LH 3rd, Taylor JA, Rodriguez ED, Silverman RP. Prevention of microsurgical anastomotic thrombosis using aspirin, heparin, and the glycoprotein IIb/IIIa inhibitor tirofiban. Plast Reconstr Surg. 2007;120(5):1281-8.
22. Yates YJ, Farias CL, Kazmier FR, Puckett CL, Concannon MJ. The effect of tirofiban on microvascular thrombosis: crush model. Plast Reconstr Surg. 2005;116(1):205-8.
23. İğde M, Onur Öztürk M, Yaşar B, Hakan Bulam M, Ergani HM, Ünlü RE. Antithrombotic effect of epigallocatechin gallate on the patency of arterial microvascular anastomoses. Arch Plast Surg. 2019;46(3):214-20.
24. Kim SH, Chang HW, Choi TH, Kim JH, Son D, Han K, et al. Cilostazol effectively reduces the decrease of flow volume in a thrombotic anastomosis model in a rat: a novel application of ultrasonography for evaluation. Ann Plast Surg. 2010;64(4):482-6.
25. Kronen G, Ferder M, Hunzicker K, Strauch B. The use of pentoxifylline in microvascular surgery. J Reconstr Microsurg. 1994;10(1):17-20.
26. Nasiri M, Kardar MH. Effect of Ethanol on Micro-Vessels Diameter and Prevention of Thrombosis. World J Plast Surg. 2019;8(2):249-53.
27. Fathi M, Fathi H, Mazloumi M, Khalilzadeh O, Amanpour S, Meysamie A, et al. Preventive effect of botulinum toxin A in microanastomotic thrombosis: a rabbit model. J Plast Reconstr Aesthet Surg. 2010;63(10):e720-4.
28. Janz BA, Thomas PR, Fanua SP, Dunn RE, Wilgis EF, Means KR Jr. Prevention of anastomotic thrombosis by botulinum toxin B after acute injury in a rat model. J Hand Surg Am. 2011;36(10):1585-91.
29. Bilgin SS, Topalan M, Ip WY, Chow SP. Effect of torsion on microvenous anastomotic patency in a rat model and early thrombolytic phenomenon. Microsurgery. 2003;23(4):381-6.
30. Salgarello M, Lahoud P, Selvaggi G, Gentileschi S, Sturla M, Farallo E. The effect of twisting on microanastomotic patency of arteries and veins in a rat model. Ann Plast Surg. 2001;47(6):643-6.
1. Hospital das Clínicas da Faculdade de Medicina de Botucatu, Botucatu, SP, Brasil
Autor correspondente: Balduino Ferreira de Menezes Neto Rua Doutor Adolfo Pardini Filho, 1028, Chácara Recreio Vista Alegre, Botucatu, SP, Brasil, CEP: 18608-760, E-mail: balduinofmneto@gmail.com
Artigo submetido: 22/11/2023.
Artigo aceito: 04/02/2024.
Conflitos de interesse: não há.










 Read in Portuguese
Read in Portuguese
 Read in English
Read in English
 PDF PT
PDF PT
 Print
Print
 Send this article by email
Send this article by email
 How to Cite
How to Cite
 Mendeley
Mendeley
 Pocket
Pocket
 Twitter
Twitter